磷酸二氢钾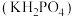 是重要的精细磷酸盐,其大晶体已应用于我国研制的巨型激光器“神光二号”中。某兴趣小组制备
是重要的精细磷酸盐,其大晶体已应用于我国研制的巨型激光器“神光二号”中。某兴趣小组制备 的流程如下:
的流程如下:
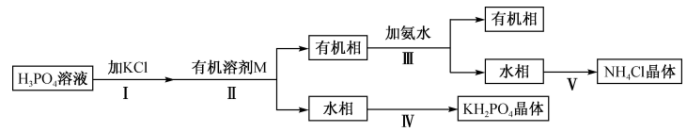
已知:a. 易溶于水,不溶于乙醇和醚等有机溶剂;溶解度随温度升高而增大。
易溶于水,不溶于乙醇和醚等有机溶剂;溶解度随温度升高而增大。
b.HCl易溶于乙醇和醚等有机溶剂。
回答下列问题:
(1)步骤II的实验操作中除烧杯外,还必须用到的硅酸盐材质的仪器有___________ 。
(2)有关步骤II和步骤III,下列说法正确的是___________(填标号)。
(3)试从平衡角度分析,由步骤I、II得到 溶液的原理:
溶液的原理:___________ 。
(4)步骤IV主要包括蒸发浓缩、冷却结晶、减压过滤、洗涤、干燥等多步操作,在冷却结晶操作中,为了得到 大晶体,常采取的措施有
大晶体,常采取的措施有___________ ;减压过滤后进行洗涤操作方法为___________ (洗涤剂用“X溶液”表示)。
(5)提纯 晶体的方法是
晶体的方法是___________ 。
(6)已知常温下,磷酸的电离常数 、
、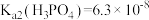 、
、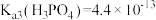 ,则
,则 溶液呈
溶液呈___________ (填“酸性”“碱性”或“中性”),并通过计算说明:___________ 。
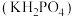 是重要的精细磷酸盐,其大晶体已应用于我国研制的巨型激光器“神光二号”中。某兴趣小组制备
是重要的精细磷酸盐,其大晶体已应用于我国研制的巨型激光器“神光二号”中。某兴趣小组制备 的流程如下:
的流程如下:
已知:a.
 易溶于水,不溶于乙醇和醚等有机溶剂;溶解度随温度升高而增大。
易溶于水,不溶于乙醇和醚等有机溶剂;溶解度随温度升高而增大。b.HCl易溶于乙醇和醚等有机溶剂。
回答下列问题:
(1)步骤II的实验操作中除烧杯外,还必须用到的硅酸盐材质的仪器有
(2)有关步骤II和步骤III,下列说法正确的是___________(填标号)。
| A.有机溶剂M可用乙醇 |
| B.步骤III与步骤II的实验操作基本相同 |
C. 在水中的溶解度明显大于在有机溶剂M中的溶解度 在水中的溶解度明显大于在有机溶剂M中的溶解度 |
| D.有机溶剂M可循环使用 |
 溶液的原理:
溶液的原理:(4)步骤IV主要包括蒸发浓缩、冷却结晶、减压过滤、洗涤、干燥等多步操作,在冷却结晶操作中,为了得到
 大晶体,常采取的措施有
大晶体,常采取的措施有(5)提纯
 晶体的方法是
晶体的方法是(6)已知常温下,磷酸的电离常数
 、
、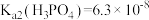 、
、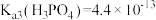 ,则
,则 溶液呈
溶液呈
更新时间:2021-11-07 19:47:41
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:

(1)FeOOH中Fe元素的化合价为_____ 。
(2)“酸溶”时,所选择的硫酸为溶质质量分数49%,密度1.20g•cm﹣3,该硫酸物质的量浓度是_____ mol•L﹣1,Fe2O3反应的离子方程式为_____ 。
(3)滤渣Ⅰ的主要成分是FeS2和_____ (填化学式);Fe3+被FeS2还原的离子方程式为_____ 。
(4)“氧化”中,需检验溶液中的离子是否氧化完全,所选用的试剂是_____ 。
(5)滤液Ⅱ中溶质是_____ (填化学式);洗涤固体的操作是_____ 。

(1)FeOOH中Fe元素的化合价为
(2)“酸溶”时,所选择的硫酸为溶质质量分数49%,密度1.20g•cm﹣3,该硫酸物质的量浓度是
(3)滤渣Ⅰ的主要成分是FeS2和
(4)“氧化”中,需检验溶液中的离子是否氧化完全,所选用的试剂是
(5)滤液Ⅱ中溶质是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰。已知:菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。焙烧后的产物用浓盐酸酸浸,再对浸出液净化除杂,得到的净化液加入碳酸氢铵溶液生成沉淀,洗涤干燥后即可得到产品。回答:
(1)焙烧过程中产生两种气体,一种可使湿润的蓝色石蕊试纸变红,另一种可使湿润的红色石蕊试纸变蓝。请写出焙烧过程中主要反应的方程式___________ 。
(2)对浸出液净化除杂时,需先加入MnO2将Fe2+转化为Fe3+,写出该反应的离子方程式___________ 。检验Fe3+所用试剂的名称是___________ 。
(3)净化液加入碳酸氢铵溶液时反应的离子方程式为___________ 。
(4)上述生产过程中可循环使用的物质是___________ 。
A.MnCO3 B. HCl C. NH4Cl D. 碳酸氢铵
(5)用滴定法测定浸出液中Mn2+的含量时,需向其中加入稍过量的磷酸和硝酸,加热会生成NO2-。加入稍过量的硫酸铵可以将其转化成无污染的物质而除去,该反应的离子方程式为___________ 。
(1)焙烧过程中产生两种气体,一种可使湿润的蓝色石蕊试纸变红,另一种可使湿润的红色石蕊试纸变蓝。请写出焙烧过程中主要反应的方程式
(2)对浸出液净化除杂时,需先加入MnO2将Fe2+转化为Fe3+,写出该反应的离子方程式
(3)净化液加入碳酸氢铵溶液时反应的离子方程式为
(4)上述生产过程中可循环使用的物质是
A.MnCO3 B. HCl C. NH4Cl D. 碳酸氢铵
(5)用滴定法测定浸出液中Mn2+的含量时,需向其中加入稍过量的磷酸和硝酸,加热会生成NO2-。加入稍过量的硫酸铵可以将其转化成无污染的物质而除去,该反应的离子方程式为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】铁有两种氯化物,都是重要的化工试剂,它们的一些性质及制备方法如下所示:
Ⅰ.氯化铁;熔点为306℃,沸点为315℃、易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
Ⅱ.氯化亚铁:熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
实验室可用如图所示的装置模拟工业生产无水氯化铁,请回答相关问题:
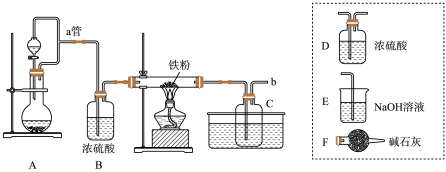
(1)装置A用于 与浓盐酸反应制氯气,反应的离子方程式为
与浓盐酸反应制氯气,反应的离子方程式为_______ 。
(2)装置C的作用是_______ 。
(3)导管b口应与_______ (从虚线框内选择一个装置,用字母代号填空)连接,这样可避免反应系统与环境间的相互影响。
(4)用此装置制得的无水氯化铁含铁量偏高,显然其中含有_______ (填化学式)杂质。为验证这一结论,设计一个简单实验证明:取少量产物固体溶解于盐酸,向其中滴加少量_______ ,若观察到_______ ,则上述结论成立。
(5)若要得到较纯净的无水氯化铁,对装置改进措施是_______ 。
(6)反应制得的氯化铁可用于制备高效消毒剂高铁酸钠( ),将氯化铁与浓的次氯酸钠、氢氧化钠溶液混合反应,发生的化学反应方程式为
),将氯化铁与浓的次氯酸钠、氢氧化钠溶液混合反应,发生的化学反应方程式为_______ ,该反应每生成0.1mol目标产物,转移的电子数为_______ 。
(7)向 溶液加入适量饱和KOH溶液,有
溶液加入适量饱和KOH溶液,有 折出,该反应的离子方程式为
折出,该反应的离子方程式为_______ 。
Ⅰ.氯化铁;熔点为306℃,沸点为315℃、易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
Ⅱ.氯化亚铁:熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
实验室可用如图所示的装置模拟工业生产无水氯化铁,请回答相关问题:

(1)装置A用于
 与浓盐酸反应制氯气,反应的离子方程式为
与浓盐酸反应制氯气,反应的离子方程式为(2)装置C的作用是
(3)导管b口应与
(4)用此装置制得的无水氯化铁含铁量偏高,显然其中含有
(5)若要得到较纯净的无水氯化铁,对装置改进措施是
(6)反应制得的氯化铁可用于制备高效消毒剂高铁酸钠(
 ),将氯化铁与浓的次氯酸钠、氢氧化钠溶液混合反应,发生的化学反应方程式为
),将氯化铁与浓的次氯酸钠、氢氧化钠溶液混合反应,发生的化学反应方程式为(7)向
 溶液加入适量饱和KOH溶液,有
溶液加入适量饱和KOH溶液,有 折出,该反应的离子方程式为
折出,该反应的离子方程式为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】2020年春节前后,新型冠状病毒 严重影响了人们正常生活。含次氯酸钠
严重影响了人们正常生活。含次氯酸钠 的水溶液具备良好的杀菌消毒效果。某化学兴趣小组拟利用实验室的常见药品制备次氯酸钠消毒液,并探讨提高消毒液中次氯酸钠百分比的方法。
的水溶液具备良好的杀菌消毒效果。某化学兴趣小组拟利用实验室的常见药品制备次氯酸钠消毒液,并探讨提高消毒液中次氯酸钠百分比的方法。
Ⅰ 该小组同学采用了高锰酸钾和浓盐酸在图1所示装置①中制氯气,请回答下列问题:
该小组同学采用了高锰酸钾和浓盐酸在图1所示装置①中制氯气,请回答下列问题:
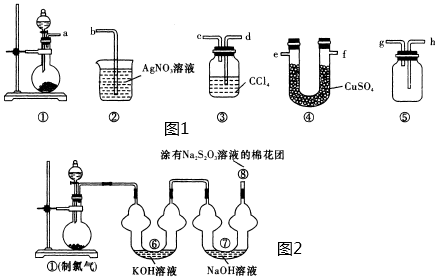
 ①中反应的化学方程式为
①中反应的化学方程式为___________ 。
 甲同学利用图1中的装置①~⑤证明从a出来的氯气潮湿且含有氯化氢,则接口的连接顺序a
甲同学利用图1中的装置①~⑤证明从a出来的氯气潮湿且含有氯化氢,则接口的连接顺序a
___________  填接口编号
填接口编号 ⑤中放入
⑤中放入___________ 。乙同学认为甲同学的装置太复杂,可去掉装置⑤,同时将②中的溶液换成W,溶液W及实验中对应的现象为___________ 。
Ⅱ,该小组同学将氯气通入含氢氧化钠溶液的烧杯中,发现反应放热明显,查阅资料获悉,氯气与碱溶液反应,产物会随反应温度的不同而不同。具体如下: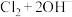
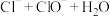
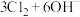
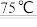
 该小组利用该信息又设计了如图2所示的装置制取
该小组利用该信息又设计了如图2所示的装置制取 和NaClO。
和NaClO。
 该小组应控制的实验条件是
该小组应控制的实验条件是___________ 。反应后,从装置⑥中溶液蒸发浓缩获得晶体,将该晶体与二氧化锰共热,生成了能使带火星的木条复燃气体。
 ⑧处发生反应的离子方程式为
⑧处发生反应的离子方程式为___________ 。
 根据上述Ⅰ、Ⅱ两个实验过程,你认为在实验室制取消毒液并提高次氯酸钠的质量分数,应该注意的事项有
根据上述Ⅰ、Ⅱ两个实验过程,你认为在实验室制取消毒液并提高次氯酸钠的质量分数,应该注意的事项有 列举两条
列举两条 。①
。①___________ ;② ___________ 。
 严重影响了人们正常生活。含次氯酸钠
严重影响了人们正常生活。含次氯酸钠 的水溶液具备良好的杀菌消毒效果。某化学兴趣小组拟利用实验室的常见药品制备次氯酸钠消毒液,并探讨提高消毒液中次氯酸钠百分比的方法。
的水溶液具备良好的杀菌消毒效果。某化学兴趣小组拟利用实验室的常见药品制备次氯酸钠消毒液,并探讨提高消毒液中次氯酸钠百分比的方法。Ⅰ
 该小组同学采用了高锰酸钾和浓盐酸在图1所示装置①中制氯气,请回答下列问题:
该小组同学采用了高锰酸钾和浓盐酸在图1所示装置①中制氯气,请回答下列问题:
 ①中反应的化学方程式为
①中反应的化学方程式为 甲同学利用图1中的装置①~⑤证明从a出来的氯气潮湿且含有氯化氢,则接口的连接顺序a
甲同学利用图1中的装置①~⑤证明从a出来的氯气潮湿且含有氯化氢,则接口的连接顺序a
 填接口编号
填接口编号 ⑤中放入
⑤中放入Ⅱ,该小组同学将氯气通入含氢氧化钠溶液的烧杯中,发现反应放热明显,查阅资料获悉,氯气与碱溶液反应,产物会随反应温度的不同而不同。具体如下:
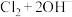
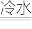
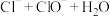
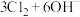
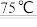
 该小组利用该信息又设计了如图2所示的装置制取
该小组利用该信息又设计了如图2所示的装置制取 和NaClO。
和NaClO。 该小组应控制的实验条件是
该小组应控制的实验条件是 ⑧处发生反应的离子方程式为
⑧处发生反应的离子方程式为 根据上述Ⅰ、Ⅱ两个实验过程,你认为在实验室制取消毒液并提高次氯酸钠的质量分数,应该注意的事项有
根据上述Ⅰ、Ⅱ两个实验过程,你认为在实验室制取消毒液并提高次氯酸钠的质量分数,应该注意的事项有 列举两条
列举两条 。①
。①
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
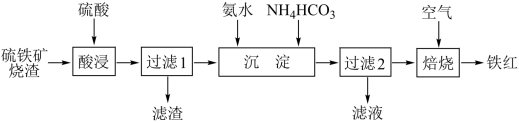
【推荐3】铁红(Fe2O3)常用于油漆、油墨及橡胶工业。工业上以一定质量的硫铁矿烧渣(主要成分为Fe2O3、Fe3O4,另含少量难溶杂质)为主要原料制备铁红的一种工艺流程如下:
已知:某些过渡元素(如Cu、Fe、Ag等)的离子能与NH3、H2O、OH-、SCN-等形成可溶性配合物。
(1) 工业常将硫铁矿烧渣经过粉碎后再进行“酸浸”,其目的是________ 。
(2) “酸浸”时加入的硫酸不宜过量太多的原因是________ 。
(3) “过滤1”所得滤液中含有的阳离子有________ 。
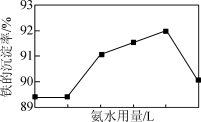
(4) “沉淀”过程中,控制NH4HCO3用量不变,铁的沉淀率随氨水用量变化如右图所示。当氨水用量超过一定体积时,铁的沉淀率下降。其可能的原因是________ 。
(5) “过滤2”所得滤渣的主要成分为FeOOH和FeCO3,所得滤液中的主要溶质是________ (填化学式)。
(6) 写出FeCO3在空气中焙烧生成铁红的化学方程式:________ 。

已知:某些过渡元素(如Cu、Fe、Ag等)的离子能与NH3、H2O、OH-、SCN-等形成可溶性配合物。
(1) 工业常将硫铁矿烧渣经过粉碎后再进行“酸浸”,其目的是

(2) “酸浸”时加入的硫酸不宜过量太多的原因是
(3) “过滤1”所得滤液中含有的阳离子有
(4) “沉淀”过程中,控制NH4HCO3用量不变,铁的沉淀率随氨水用量变化如右图所示。当氨水用量超过一定体积时,铁的沉淀率下降。其可能的原因是
(5) “过滤2”所得滤渣的主要成分为FeOOH和FeCO3,所得滤液中的主要溶质是
(6) 写出FeCO3在空气中焙烧生成铁红的化学方程式:
您最近半年使用:0次

 是一种压电材料。以
是一种压电材料。以 为原料,采用下列路线可制备粉状
为原料,采用下列路线可制备粉状
 、易溶于水的
、易溶于水的 和微溶于水的
和微溶于水的 。“浸取”时主要反应的离子方程式为
。“浸取”时主要反应的离子方程式为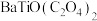 的化学方程式为
的化学方程式为

