某厂废弃的铁触媒催化剂主要含Al、Fe、Cu、CuO,采用如下工艺流程回收其中的铜并制备硫酸亚铁晶体(FeSO4·7H2O)。
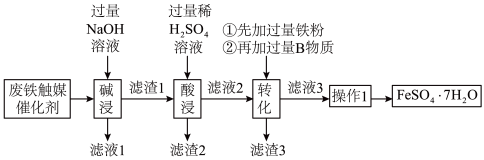
已知:①Fe、Cu、CuO与NaOH溶液不反应
②2Al+2NaOH+2H2O=2NaAlO2+3H2↑,NaAlO2易溶于水。
回答下列问题:
(1)“滤渣1”的主要成分为___________ (填化学式,下同);物质B为___________ 。
(2)“转化”中发生的反应的化学方程式有___________ 、___________ 。
(3)“操作1”的步骤有:蒸发浓缩、________ 、_______ 、_______ 、干燥。

已知:①Fe、Cu、CuO与NaOH溶液不反应
②2Al+2NaOH+2H2O=2NaAlO2+3H2↑,NaAlO2易溶于水。
回答下列问题:
(1)“滤渣1”的主要成分为
(2)“转化”中发生的反应的化学方程式有
(3)“操作1”的步骤有:蒸发浓缩、
更新时间:2021-11-10 13:30:11
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】在“比较钠、镁、铝金属活泼性”实验中,甲、乙两组的实验如下:
(1)写出钠和水反应的化学方程式___________ 。
(2)下列实验依据可判断某元素的金属性强弱的是___________。
(3)钠、镁、铝金属活泼性由强到弱顺序是___________ ;甲、乙两组实验中,组___________ 的实验更可靠,另一组不可靠的原因可能是___________ 。
(4)下列性质比较中错误的是___________。
(5)运用元素周期律分析下面的推断,其中错误的是___________。
| 甲组 | 乙组 | ||
| 实验步骤 | 实验现象 | 实验步骤 | 实验现象 |
1.取两支试管,加入 水,各滴入2滴酚酞试液,分别加入一小粒金属钠和少量镁粉,观察现象。 水,各滴入2滴酚酞试液,分别加入一小粒金属钠和少量镁粉,观察现象。将加入镁粉的试管加热至沸腾,观察现象。 | 钠:在冷水中,浮于水面,熔成小球,四处游动,逐渐缩小,溶液很快变红色。 镁:在冷水中几乎无现象,加热至沸后产生大量气体,溶液变红。 | 1.取两支试管,加入 水,各滴入2滴酚酞试液,分别加入一小粒金属钠和少量镁粉,观察现象。 水,各滴入2滴酚酞试液,分别加入一小粒金属钠和少量镁粉,观察现象。将加入镁粉的试管加热至沸腾,观察现象。 | 钠:在冷水中,浮于水面,熔成小球,四处游动,逐渐缩小,溶液很快变红色。 镁:在冷水中几乎无现象,加热至沸后产生大量气体,溶液变红。 |
2.取一小块铝和一小块镁带,用砂纸擦去表面的氧化膜,分别同时投入盛有 盐酸的两个试管中,观察现象。 盐酸的两个试管中,观察现象。 | 镁:剧烈反应,很快产生大量气体。 铝:也产生大量气体,但反应比镁慢。 | 2.取一小块铝和一小块镁带,分别同时投入盛有 盐酸的两个试管中,观察现象。 盐酸的两个试管中,观察现象。 | 镁:开始时没有现象,过一会儿产生大量气体。 铝:基本没有变化。 |
(2)下列实验依据可判断某元素的金属性强弱的是___________。
| A.导电性的强弱 |
| B.跟非金属反应生成化合物的价态高低 |
C. 该金属跟酸反应放出氢气的多少 该金属跟酸反应放出氢气的多少 |
| D.最高价氧化物对应水化物碱性的强弱 |
(4)下列性质比较中错误的是___________。
| A.元素的非金属性:P>S |
B.离子的还原性: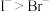 |
C.含氧酸的酸性: |
D.气态氢化物的热稳定性: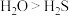 |
| A.硼的氧化物的水化物可能具有两性 |
B.砹 (87At)为有色固体,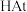 不稳定, 不稳定, 见光容易分解,不溶于水也不溶于稀酸 见光容易分解,不溶于水也不溶于稀酸 |
| C.氢氧化铷(37RbOH)易溶于水 |
D.硒化氢 (34Se)是无色、有毒、比 稳定的气体 稳定的气体 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F 是无色无味的气体,M为红褐色。
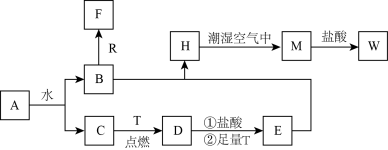
请回答下列问题:
(1)A与水反应的离子方程式为___________ 。
(2)D与盐酸反应的化学方程式为___________ 。
(3)H在潮湿的空气中生成M的现象为___________ ,反应的化学方程式为___________ 。
(4)B生成F的反应中氧化剂是___________ ,反应的离子方程式为___________ 。
(5)向W溶液中加入一定量T后,为检验所得溶液中金属阳离子,甲、乙两位同学做了如下实验:甲同学取出少量反应后溶液,加入少量H2O2,再滴加几滴KSCN溶液,发现溶液显血红色,由此得出结论有Fe2+; 乙同学取出少量反应后溶液,加入少量酸性 KMnO4溶液,发现酸性KMnO4溶液褪色,由此得出结论有 Fe2+,丙同学看了实验过程后认为甲、乙同学的结论都有问题,你觉得丙同学判断甲、乙同学结论的依据是:
甲同学:___________ ;乙同学: ___________ 。

请回答下列问题:
(1)A与水反应的离子方程式为
(2)D与盐酸反应的化学方程式为
(3)H在潮湿的空气中生成M的现象为
(4)B生成F的反应中氧化剂是
(5)向W溶液中加入一定量T后,为检验所得溶液中金属阳离子,甲、乙两位同学做了如下实验:甲同学取出少量反应后溶液,加入少量H2O2,再滴加几滴KSCN溶液,发现溶液显血红色,由此得出结论有Fe2+; 乙同学取出少量反应后溶液,加入少量酸性 KMnO4溶液,发现酸性KMnO4溶液褪色,由此得出结论有 Fe2+,丙同学看了实验过程后认为甲、乙同学的结论都有问题,你觉得丙同学判断甲、乙同学结论的依据是:
甲同学:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。

已知:
①G的摩尔质量是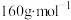 ;
;
②反应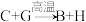 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;
③I是一种常见的温室气体,它和E可以发生反应: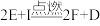 ,F中的E元素的质量分数为60%。
,F中的E元素的质量分数为60%。
回答下列问题:
(1)②中反应的化学方程式为_______ 。
(2)化合物I的电子式为_______ ;它的空间结构是_______ 。
(3)1.6gG溶于盐酸后,得到的溶液与铜粉完全反应,写出发生反应的离子方程式:_______ ,_______ ;计算至少所需铜粉的_______ g。
(4)C与NaOH溶液反应的离子方程式为_______ ;反应后溶液与过量化合物I反应的离子方程式为_______ 。

已知:
①G的摩尔质量是
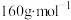 ;
;②反应
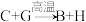 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;③I是一种常见的温室气体,它和E可以发生反应:
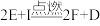 ,F中的E元素的质量分数为60%。
,F中的E元素的质量分数为60%。回答下列问题:
(1)②中反应的化学方程式为
(2)化合物I的电子式为
(3)1.6gG溶于盐酸后,得到的溶液与铜粉完全反应,写出发生反应的离子方程式:
(4)C与NaOH溶液反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】碘是人体不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:在溶液中KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)用双线桥表示该反应中电子转移的方向和数目___________ ,该反应中还原产物与氧化产物的物质的量比是___________ ,
(2)0.5 mol KIO3参加反应时转移电子___________ mol。
(3)实验结束后分离I2和K2SO4溶液所用的试剂是___________ 。
A.Na2SO4溶液 B.酒精 C.CCl4 D.食盐水
所用的分离方法是___________ ,所用主要玻璃仪器是___________ 。
(4)上面实验中用到一定物质的量浓度的稀硫酸,若配制1 mol/L的稀硫酸溶液480 mL,需用18 mol/L浓H2SO4___________ mL(写出计算过程)
(5)下面操作造成所配稀硫酸溶液浓度偏高的是___________
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
(1)用双线桥表示该反应中电子转移的方向和数目
(2)0.5 mol KIO3参加反应时转移电子
(3)实验结束后分离I2和K2SO4溶液所用的试剂是
A.Na2SO4溶液 B.酒精 C.CCl4 D.食盐水
所用的分离方法是
(4)上面实验中用到一定物质的量浓度的稀硫酸,若配制1 mol/L的稀硫酸溶液480 mL,需用18 mol/L浓H2SO4
(5)下面操作造成所配稀硫酸溶液浓度偏高的是
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】工业上常以黄铜矿(主要成分是CuFeS2)为原料制备铜以及副产物铁红(Fe2O3),两种方法均能实现铜的冶炼,其工艺流程如图:

回答下列问题:
(1)为使“焙烧”反应充分进行,工业上可采取的措施是____ (写一条),写出“焙烧”时反应的化学方程式:___ 。
(2)“灼烧1”工序中起氧化作用的物质是____ 。
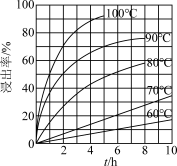
(3)FeCl3溶液“浸取”时,铜的浸出率结果如图所示。由图可知,当铜的浸出率为90%时,所采用的实验条件为____ ,写出该工序发生反应的离子方程式:______ 。
(4)“调节pH”所用试剂X是_____ ,该工序的目的是除去溶液中的Fe3+。当调节溶液的pH=3.5时,Fe3+______ (填“是”或“不是”)沉淀完全[c(Fe3+)≤1×10-5mol•L-1时可认为Fe3+沉淀完全],若滤液中c(Cu2+)=0.2mol•L-1,此时是否有Cu(OH)2析出?_______ (列式计算)。{已知:25℃时,Ksp[Fe(OH)3]=1.0×10-39、Ksp[Cu(OH)2]=2.2×10-20}
(5)方法乙比方法甲更好,其原因是_____ (写一点)。

回答下列问题:
(1)为使“焙烧”反应充分进行,工业上可采取的措施是
(2)“灼烧1”工序中起氧化作用的物质是
(3)FeCl3溶液“浸取”时,铜的浸出率结果如图所示。由图可知,当铜的浸出率为90%时,所采用的实验条件为

(4)“调节pH”所用试剂X是
(5)方法乙比方法甲更好,其原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。

(1)写出在高温下发生反应①的化学方程_____
(2)生产中用足量的浓氨水吸收反应①的尾气合成肥料,写出该反应的离子方程式:___
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有_____
(4)某同学利用如图所示装置来制备氢气,利用氢气还原三氧化钼,根据要求回答问题:

①步骤⑤的化学反应方程式为___ 。请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是____ 。
②在烧瓶A中加入少量硫酸铜的目的是__
③两次使用D装置,其中所盛的药品依次是_____ 、____ 。

(1)写出在高温下发生反应①的化学方程
(2)生产中用足量的浓氨水吸收反应①的尾气合成肥料,写出该反应的离子方程式:
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有
(4)某同学利用如图所示装置来制备氢气,利用氢气还原三氧化钼,根据要求回答问题:

①步骤⑤的化学反应方程式为
②在烧瓶A中加入少量硫酸铜的目的是
③两次使用D装置,其中所盛的药品依次是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】除杂或分离物质是化学实验中的基础内容。回答下列问题:
(1)选择合适的药品,把下列物质中含有的少量杂质(括号内为杂质)除去,写出所需的药品和有关的离子方程式________ 。
(2)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液法 B.加热分解 C.结晶法 D.分液法 E.蒸馏法 F.过滤法
①________________ 从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
②________________ 分离水和苯的混合物;
③________________ 分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C),已知四氯化碳和甲苯互溶;该分离方法中用到的盛放混合液的仪器名称____________ 。
(1)选择合适的药品,把下列物质中含有的少量杂质(括号内为杂质)除去,写出所需的药品和有关的离子方程式
| 物质(杂质) | 除杂药品 | 离子方程式 |
| NaHCO3溶液(Na2CO3) | ||
| CO2(HCl) | ||
| FeCl2溶液(FeCl3) |
A.萃取分液法 B.加热分解 C.结晶法 D.分液法 E.蒸馏法 F.过滤法
①
②
③
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】粉煤灰中含有SiO2、Al2O3、Fe2O3等,某实验室对其进行处理的流程如图所示:
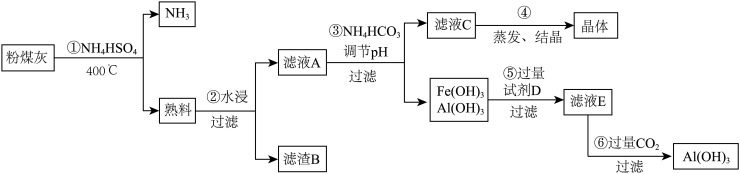
回答下列问题:
(1)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,写出生成NH4Fe(SO4)2的化学方程式______ 。在物质分类体系中,NH4Fe(SO4)2、NH4Al(SO4)2不属于_____ (填字母)。
a.硫酸盐 b.复盐 c.强电解质 d.共价化合物
(2)滤渣B的主要成分为______ 。
(3)已知Ksp[Fe(OH)3]=4×10-38,Ksp[Al(OH)3]=1×10-32。为实现步骤③的实验目的,应使溶液中c(Fe3+)、c(Al3+)均小于或等于1×10-5 mol•L﹣1可认为完全沉淀,则溶液A至少应调节到pH=___ 。
(4)实验室进行第④步操作时,所需的主要仪器是酒精灯、三脚架、_______ 、______ ,得到的晶体主要成分是______ (填化学式)。

回答下列问题:
(1)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,写出生成NH4Fe(SO4)2的化学方程式
a.硫酸盐 b.复盐 c.强电解质 d.共价化合物
(2)滤渣B的主要成分为
(3)已知Ksp[Fe(OH)3]=4×10-38,Ksp[Al(OH)3]=1×10-32。为实现步骤③的实验目的,应使溶液中c(Fe3+)、c(Al3+)均小于或等于1×10-5 mol•L﹣1可认为完全沉淀,则溶液A至少应调节到pH=
(4)实验室进行第④步操作时,所需的主要仪器是酒精灯、三脚架、
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】“侯氏制碱法”是我国化工专家侯德榜为世界制碱工业作出的突出贡献。某学习小组模拟“侯氏制碱法”开展如下项目化学习:
项目一、粗盐(含Ca2+、Mg2+、 等杂质)提纯氯化钠
等杂质)提纯氯化钠
粗盐提纯的流程如下:

(1)试剂X为___________ 。
(2)“操作1”所需玻璃仪器为烧杯、___________ 。
(3)“沉淀”的成分为CaCO3、Mg(OH)2、___________ 。
(4)“滤液”中加入稀盐酸生成气泡的离子方程式为___________ 。
项目二、模拟“侯氏制碱法”制备纯碱

(5)气体A为___________ 。
(6)“悬浊液”过滤所得滤液中含有的主要离子有___________ 。
(7)写出晶体转化为纯碱的化学方程式___________ 。
项目一、粗盐(含Ca2+、Mg2+、
 等杂质)提纯氯化钠
等杂质)提纯氯化钠粗盐提纯的流程如下:

(1)试剂X为
(2)“操作1”所需玻璃仪器为烧杯、
(3)“沉淀”的成分为CaCO3、Mg(OH)2、
(4)“滤液”中加入稀盐酸生成气泡的离子方程式为
项目二、模拟“侯氏制碱法”制备纯碱

(5)气体A为
(6)“悬浊液”过滤所得滤液中含有的主要离子有
(7)写出晶体转化为纯碱的化学方程式
您最近一年使用:0次
【推荐1】实验室以K2MnO4为原料,用两种方法制备高锰酸钾。已知:K2MnO4在浓强碱溶液中可稳定存在,溶液呈墨绿色,当溶液碱性减弱时易发生反应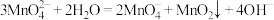 。
。
(1) CO2法:实验装置如图。

①反应一段时间后,用玻璃棒蘸取溶液点在滤纸上,仅有紫红色而没有绿色痕迹,由此可知___________ 。
②停止通入CO2,过滤除去___________ (填化学式,下同),将滤液蒸发浓缩、冷却结晶,抽滤得到KMnO4粗品。若通入过多CO2,产品中可能混有的杂质是___________ 。
(2)电解法:实验装置如图。
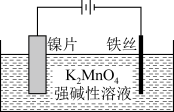
阳极的电极反应式为___________ ,阴极产生的气体为___________ (填化学式)。
(3)如用氨燃料电池电解溶液,已知氨燃料电池使用的电解质溶液是KOH溶液,电池总反应为 。则其负极反应式为
。则其负极反应式为___________ 。
(4)若用钢铁(含Fe、C)制品盛装NaClO溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化学腐蚀过程中的正极反应式为___________ 。
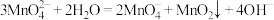 。
。(1) CO2法:实验装置如图。

①反应一段时间后,用玻璃棒蘸取溶液点在滤纸上,仅有紫红色而没有绿色痕迹,由此可知
②停止通入CO2,过滤除去
(2)电解法:实验装置如图。

阳极的电极反应式为
(3)如用氨燃料电池电解溶液,已知氨燃料电池使用的电解质溶液是KOH溶液,电池总反应为
 。则其负极反应式为
。则其负极反应式为(4)若用钢铁(含Fe、C)制品盛装NaClO溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化学腐蚀过程中的正极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某铁和铜的固体混合物在空气中部分生锈(锈的成分为 CuO 和 Fe2O3),其总质量为 6.4 g,某实验小组对此固体混合物进行实验探究。

(1)操作 1 的名称为_____ ,此操作使用的玻璃仪器有_____ 、_____ 、_____ 。
(2)固体混合物中两种氧化物与稀硫酸反应的离子方程式为_____ 、_____ 。
(3)红色固体滤渣为_____ (填“铜”或“氧化铁”)。
(4)查阅资料知 Cu+Fe2(SO4)3 CuSO4+2FeSO4,说明在浅绿色强酸性溶液中
CuSO4+2FeSO4,说明在浅绿色强酸性溶液中___________ (填“含”或“不含”)Fe2(SO4)3。
(5)“一系列操作”中,其中有一步反应如下,请将此反应方程式配平:
_____ Fe(OH)2+_________ O2+_____ H2O
_____ Fe(OH)3
(6)通过进一步实验得出:浅绿色溶液中不含 Cu2+,则原部分生锈的固体混合物中氧元素的质量分数为_________ 。

(1)操作 1 的名称为
(2)固体混合物中两种氧化物与稀硫酸反应的离子方程式为
(3)红色固体滤渣为
(4)查阅资料知 Cu+Fe2(SO4)3
 CuSO4+2FeSO4,说明在浅绿色强酸性溶液中
CuSO4+2FeSO4,说明在浅绿色强酸性溶液中(5)“一系列操作”中,其中有一步反应如下,请将此反应方程式配平:

(6)通过进一步实验得出:浅绿色溶液中不含 Cu2+,则原部分生锈的固体混合物中氧元素的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】Li2CO3可用于制备锂电池的正极材料LiCoO2,以某锂云母矿石(主要成分为Li2O,还有Al2O3、Fe2O3、MnO、MgF2等杂质)制备Li2CO3。
已知:①有关沉淀数据如下表(“完全沉淀”时金属离子浓度≤1.0×10-5mol·L-1)。
②部分物质的溶解度曲线见下图。
(1)酸浸,向锂云母矿石中加入50%硫酸,加热至90℃,装置如图所示。烧杯中试剂的作用是___________ 。___________ 。分两次调节pH的主要原因是___________ 。
(3)沉锂,将已经除杂的溶液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和Na2CO3溶液,加热煮沸,趁热过滤,将滤渣洗涤烘干,得Li2CO3固体。浓缩液中离子浓度过大将在产品中引入___________ 杂质(填化学式)。
(4)Li2CO3和Co3O4混合后,在空气中高温加热可以制备锂电池的正极材料LiCoO2,写出反应方程式:___________ 。
(5)CoC2O4·2H2O热分解可制备Co3O4。请补充完整由含c(Co2+)=0.1mol·L-1的浸出液(含有杂质Al3+、Fe3+、Fe2+)制备纯净的CoC2O4·2H2O实验方案:___________ ,干燥,得到CoC2O4·2H2O晶体。(须使用的试剂:NaClO3,NaOH,AgNO3溶液,(NH4)2C2O4,蒸馏水)
(6)为确定由CoC2O4·2H2O获得Co3O4的最佳煅烧温度,准确称取4.575g的CoC2O4·2H2O样品,在空气中加热,固体样品的剩余质量随温度的变化如图所示(已知385℃以上残留固体均为金属氧化物)经测定,205~385℃的煅烧过程中,产生的气体为CO2,计算AB段消耗O2在标准状况下的体积___________ 。(写出计算过程,结果保留2位有效数字)
已知:①有关沉淀数据如下表(“完全沉淀”时金属离子浓度≤1.0×10-5mol·L-1)。
| 沉淀 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Co(OH)2 | Mn(OH)2 | Mg(OH)2 |
| 恰好完全沉淀时pH | 5.2 | 8.8 | 3.2 | 9.4 | 9.8 | 11.1 |

(1)酸浸,向锂云母矿石中加入50%硫酸,加热至90℃,装置如图所示。烧杯中试剂的作用是

(3)沉锂,将已经除杂的溶液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和Na2CO3溶液,加热煮沸,趁热过滤,将滤渣洗涤烘干,得Li2CO3固体。浓缩液中离子浓度过大将在产品中引入
(4)Li2CO3和Co3O4混合后,在空气中高温加热可以制备锂电池的正极材料LiCoO2,写出反应方程式:
(5)CoC2O4·2H2O热分解可制备Co3O4。请补充完整由含c(Co2+)=0.1mol·L-1的浸出液(含有杂质Al3+、Fe3+、Fe2+)制备纯净的CoC2O4·2H2O实验方案:
(6)为确定由CoC2O4·2H2O获得Co3O4的最佳煅烧温度,准确称取4.575g的CoC2O4·2H2O样品,在空气中加热,固体样品的剩余质量随温度的变化如图所示(已知385℃以上残留固体均为金属氧化物)经测定,205~385℃的煅烧过程中,产生的气体为CO2,计算AB段消耗O2在标准状况下的体积
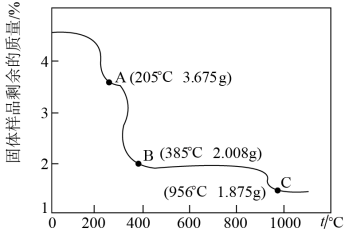
您最近一年使用:0次



