“84消毒液”是一种以NaClO为有效成分的高效消毒剂,在新冠肺炎防治中被广泛用于宾馆、旅游、医院、家庭等的卫生消毒。
Ⅰ.如表为“84”消毒液说明书,请回答下列问题。
(1)常温下用烧碱溶液吸收Cl2制备“84”消毒液。写出该反应的离子方程式___ ,若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当混合液中Cl-和ClO 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为___ ,从氧化还原角度分析Cl2表现了___ 性。
(2)家庭用“84”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是___ (用离子方程式表达)。(已知:酸性:H2CO3>HClO>HCO ),家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是
),家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是___ 。
Ⅱ.某“84消毒液”瓶体部分标签如图1所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
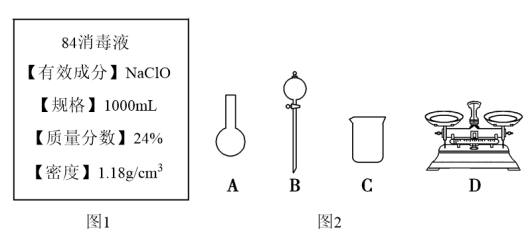
(3)此“84消毒液”的物质的量浓度约为___ mol·L-1。(计算结果保留一位小数)
(4)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL该消毒液。
①如图2所示的仪器中配制溶液需要使用的是___ 。(填仪器序号),还缺少的玻璃仪器是___ 。
②请计算该同学配制此溶液需用托盘天平称量NaClO固体的质量为___ g。
(5)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是___ (填字号)。
Ⅰ.如表为“84”消毒液说明书,请回答下列问题。
 说明书 | 药品名称 | 84消毒液 |
| 主要成分 | NaClO,有效氯含量50.00g/L~60.00g/L | |
| 注意事项 | 不可与其他洗涤剂或消毒液混合使用 | |
| 用法用量 | 稀释后浸泡或洗刷白色衣物,浴缸等1:200水溶液餐饮具,瓜果等1:100水溶液 |
(1)常温下用烧碱溶液吸收Cl2制备“84”消毒液。写出该反应的离子方程式
 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为(2)家庭用“84”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是
 ),家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是
),家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是Ⅱ.某“84消毒液”瓶体部分标签如图1所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(3)此“84消毒液”的物质的量浓度约为
(4)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL该消毒液。
①如图2所示的仪器中配制溶液需要使用的是
②请计算该同学配制此溶液需用托盘天平称量NaClO固体的质量为
(5)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是
| A.定容时俯视制度线 | B.转移前,容量瓶内有蒸馏水 |
| C.未冷至室温就转移定容 | D.定容时水多用胶头滴管吸出 |
更新时间:2021-12-18 01:37:56
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】元素化合物在日常生活、化工生产和环境科学中有着重要的用途。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是______________ 。
(2)自然界中Cr主要以+3价和+6价形式存在。Cr2O72-中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将Cr2O72-还原。写出反应的离子方程式:____________ 。
(3)当皮肤划破时可用FeCl3溶液应急止血,其主要原因是_________________ 。 用氯化铁固体配制成 98mL 0.1mol/L 的溶液,配制过程中所需要的玻璃仪器有量筒、玻璃棒、烧杯、胶头滴管、__________________________ 。
(4)高铁酸钾(K2FeO4)是一种既能杀菌、消毒、又能絮凝净水的水处理剂。工业制备高铁酸钾的反应离子方程式Fe(OH)3+ C1O-+ OH-→ FeO42-+ C1-+ H2O(未配平),配平后的离子方程式为:________________________________ ,每生成1mol K2FeO4, 转移的电子数是_________ 。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是
(2)自然界中Cr主要以+3价和+6价形式存在。Cr2O72-中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将Cr2O72-还原。写出反应的离子方程式:
(3)当皮肤划破时可用FeCl3溶液应急止血,其主要原因是
(4)高铁酸钾(K2FeO4)是一种既能杀菌、消毒、又能絮凝净水的水处理剂。工业制备高铁酸钾的反应离子方程式Fe(OH)3+ C1O-+ OH-→ FeO42-+ C1-+ H2O(未配平),配平后的离子方程式为:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放,脱硝的方法有多种。
完成下列填空:
Ⅰ直接脱硝
(1)NO在催化剂作用下分解为氮气和氧气。在10L密闭容器中,NO经直接脱硝反应时,其物质的量变化如图1所示。则0~5min内氧气的平均反应速率为___ mol/(L•min)。
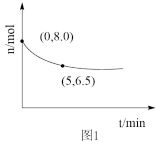
Ⅱ臭氧脱硝
(2)O3氧化NO结合水洗可完全转化为HNO3,此时O3与NO的物质的量之比为___ 。
Ⅲ氨气脱硝
(3)实验室制取纯净的氨气,除了氯化铵外,还需要___ 、___ (填写试剂名称)。不使用碳酸铵的原因是___ (用化学方程式表示)。
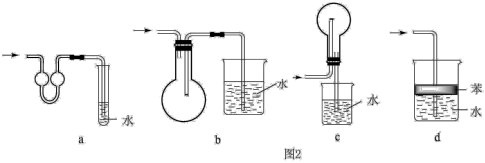
(4)吸收氨气时,常使用防倒吸装置,图2装置不能达到此目的是___ 。
NH3脱除烟气中NO的原理如图3:
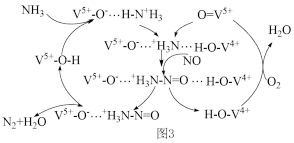
(5)该脱硝原理中,NO最终转化为___ (填化学式)和H2O。当消耗1molNH3和0.25molO2时,除去的NO在标准状况下的体积为___ L。
完成下列填空:
Ⅰ直接脱硝
(1)NO在催化剂作用下分解为氮气和氧气。在10L密闭容器中,NO经直接脱硝反应时,其物质的量变化如图1所示。则0~5min内氧气的平均反应速率为

Ⅱ臭氧脱硝
(2)O3氧化NO结合水洗可完全转化为HNO3,此时O3与NO的物质的量之比为
Ⅲ氨气脱硝
(3)实验室制取纯净的氨气,除了氯化铵外,还需要
(4)吸收氨气时,常使用防倒吸装置,图2装置不能达到此目的是

NH3脱除烟气中NO的原理如图3:

(5)该脱硝原理中,NO最终转化为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1)将 Al、Al2O3和 Al(OH)3的混合物恰好与 NaOH 溶液反应,向反应后的溶液中通入过量 CO2。写出所有反应的离子方程式为_____ 。
(2)取 400mL 0.3mol/L 的 KI 溶液与一定量的酸性 KMnO4 溶液恰好反应,生成等物质的量的I2 和KIO3,则消耗KMnO4 的物质的量的是_____ mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。又变为棕黄色的原因是_____
(4)向 100mLFeBr2溶液中通入标况下 2.24LCl2,反应后溶液中有1/2的Br-被氧化成单质 Br2,写出离子方程式_____ 。
(2)取 400mL 0.3mol/L 的 KI 溶液与一定量的酸性 KMnO4 溶液恰好反应,生成等物质的量的I2 和KIO3,则消耗KMnO4 的物质的量的是
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。又变为棕黄色的原因是
(4)向 100mLFeBr2溶液中通入标况下 2.24LCl2,反应后溶液中有1/2的Br-被氧化成单质 Br2,写出离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】实验室用高锰酸钾和浓盐酸反应制备氯气:2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O
(1)用双线桥法标出上述反应方程式中电子转移的方向与数目___ 。
(2)上述反应中,氧化剂是___ (填化学式,下同),氧化产物___ ,浓盐酸体现了___ 性和____ 性,当有4mol水生成的时候,转移的电子有___ mol。
(3)实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是___ (填写化学式),请用化学方程式表示该反应的原理___ 。
(4)若在标准状况下,将一个充满HCl气体的集气瓶倒扣于盛水的水槽中,水充满整个集气瓶,(假设HCl全部留在集气瓶内),则该集气瓶内溶液中HCl的物质的量浓度为___ mol/L。(保留三位小数)
(1)用双线桥法标出上述反应方程式中电子转移的方向与数目
(2)上述反应中,氧化剂是
(3)实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是
(4)若在标准状况下,将一个充满HCl气体的集气瓶倒扣于盛水的水槽中,水充满整个集气瓶,(假设HCl全部留在集气瓶内),则该集气瓶内溶液中HCl的物质的量浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)在该反应中,如有1molCl2生成,被氧化的HCl的物质的量是__ ,转移电子的数目是___ 。
(2)在反应3Cl2+6KOH(浓)=5KCl+KClO3+3H2O中,氧化产物与还原产物的物质的量之比为___ ,3molCl2参加该反应时,反应中转移___ mol电子。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是___ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)___ 。
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O(1)在该反应中,如有1molCl2生成,被氧化的HCl的物质的量是
(2)在反应3Cl2+6KOH(浓)=5KCl+KClO3+3H2O中,氧化产物与还原产物的物质的量之比为
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】国际化学年的中国宣传口号是“化学——我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”的道理。请填空:
(1)金属钠等活泼金属着火时,应该用___________ 来灭火,不能用水灭火的原因是___________ 。
(2)用下面方法可以制得白色的 沉淀。
沉淀。
用不含 的
的 溶液与用不含
溶液与用不含 的蒸馏水配制的NaOH溶液反应制备。
的蒸馏水配制的NaOH溶液反应制备。
①用硫酸亚铁晶体配制上述 溶液时还需加入
溶液时还需加入___________ 。
②除去蒸馏水中溶解的 常采用
常采用___________ 的方法。
③如果没有除去氧气会看到白色沉淀变为红褐色沉淀,该反应的化学方程式为___________ 。
(3)某化工厂的贮氯罐意外发生泄漏,消防员向贮氯罐周围空气中喷洒稀NaOH溶液,发生反应的离子方程式是___________ 。为了安全,组织群众疏散的地方应是___________ (填序号)。
A.顺风高坡处 B.逆风高坡处 C.顺风低洼处 D.逆风低洼处
(4)二氧化氯( )是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与
)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与 相比不会产生对人体有潜在危害的有机氯代物。可以由
相比不会产生对人体有潜在危害的有机氯代物。可以由 、
、 、
、 制备
制备 :
:
①配平下列方程式:___________


②上述反应中氧化剂是___________ 。
③若反应中有0.1mol电子转移,则产生的 气体在标准状况下的体积约为
气体在标准状况下的体积约为___________ L。
(1)金属钠等活泼金属着火时,应该用
(2)用下面方法可以制得白色的
 沉淀。
沉淀。用不含
 的
的 溶液与用不含
溶液与用不含 的蒸馏水配制的NaOH溶液反应制备。
的蒸馏水配制的NaOH溶液反应制备。①用硫酸亚铁晶体配制上述
 溶液时还需加入
溶液时还需加入②除去蒸馏水中溶解的
 常采用
常采用③如果没有除去氧气会看到白色沉淀变为红褐色沉淀,该反应的化学方程式为
(3)某化工厂的贮氯罐意外发生泄漏,消防员向贮氯罐周围空气中喷洒稀NaOH溶液,发生反应的离子方程式是
A.顺风高坡处 B.逆风高坡处 C.顺风低洼处 D.逆风低洼处
(4)二氧化氯(
 )是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与
)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与 相比不会产生对人体有潜在危害的有机氯代物。可以由
相比不会产生对人体有潜在危害的有机氯代物。可以由 、
、 、
、 制备
制备 :
:①配平下列方程式:


②上述反应中氧化剂是
③若反应中有0.1mol电子转移,则产生的
 气体在标准状况下的体积约为
气体在标准状况下的体积约为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】回答下列问题:
(1)相同质量的O2和SO2,所含分子的数目之比为_______ ,所含氧原子的物质的量之比为_______ ;
(2)实验室需要0.10 mol/L的硫酸980mL,某同学欲用密度为1.84 g/cm 、溶质的质量分数为98%的浓硫酸进行配制,需量取98%浓硫酸的体积为
、溶质的质量分数为98%的浓硫酸进行配制,需量取98%浓硫酸的体积为_______ mL,若向容量瓶转移溶液时,有少量液体溅出,则会使所配制的溶液物质的量浓度_______ (填“偏高”,“偏低”或“不变”)。
(1)相同质量的O2和SO2,所含分子的数目之比为
(2)实验室需要0.10 mol/L的硫酸980mL,某同学欲用密度为1.84 g/cm
 、溶质的质量分数为98%的浓硫酸进行配制,需量取98%浓硫酸的体积为
、溶质的质量分数为98%的浓硫酸进行配制,需量取98%浓硫酸的体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】“84”消毒液是生活中常见的一种消毒剂,常用于环境的消毒,其主要成分是NaClO。
(1)“84”消毒液使用时除了要按一定比例稀释,对消毒时间也有要求,一般在10~20分钟左右、用化学方程式解释原因:___________ 。
(2)次氯酸钠可以用于去除废水中的铵态氮,配平下列离子方程式:___________ 。
 。
。
(3)“84”消毒液的制取和漂粉精的制取原理相同,请写出该反应的离子方程式:___________ 。
(4)消毒学专家指出,将“84”消毒液与洁厕灵(主要成分:浓盐酸)一起合并使用,可能会对使用者的呼吸道造成伤害。请用离子方程式分析可能的原因:___________ 。
(5)已知某市售84消毒液瓶体部分标签如图所示,该84消毒液通常稀释100倍(体积之比)后使用。请回答下列问题:
①该“84”消毒液中NaClO的物质的量浓度约为___________ mol/L。(保留1位小数)
②“84”消毒液与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用18.4mol/L的浓硫酸配制480mL2.3mol/L的稀硫酸用于增强84消毒液的消毒能力,则配置时需用浓硫酸的体积为___________ mL。
③在配制稀硫酸过程中不需要用到的仪器有___________ 。
A.玻璃棒 B.托盘天平 C.烧杯 D.量筒 E.容量瓶 F.漏斗
④配制该稀硫酸过程中,下列情况会使所配制的溶液的浓度大于2.3mol/L的有___________ 。
A.未经冷却趁热将溶液注入容量瓶中并进行定容
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视容量瓶刻度线
(1)“84”消毒液使用时除了要按一定比例稀释,对消毒时间也有要求,一般在10~20分钟左右、用化学方程式解释原因:
(2)次氯酸钠可以用于去除废水中的铵态氮,配平下列离子方程式:
 。
。(3)“84”消毒液的制取和漂粉精的制取原理相同,请写出该反应的离子方程式:
(4)消毒学专家指出,将“84”消毒液与洁厕灵(主要成分:浓盐酸)一起合并使用,可能会对使用者的呼吸道造成伤害。请用离子方程式分析可能的原因:
(5)已知某市售84消毒液瓶体部分标签如图所示,该84消毒液通常稀释100倍(体积之比)后使用。请回答下列问题:
| 84消毒液 [有效成分]NaClO [规格]1000mL [质量分数]25% [密度] 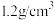 |
②“84”消毒液与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用18.4mol/L的浓硫酸配制480mL2.3mol/L的稀硫酸用于增强84消毒液的消毒能力,则配置时需用浓硫酸的体积为
③在配制稀硫酸过程中不需要用到的仪器有
A.玻璃棒 B.托盘天平 C.烧杯 D.量筒 E.容量瓶 F.漏斗
④配制该稀硫酸过程中,下列情况会使所配制的溶液的浓度大于2.3mol/L的有
A.未经冷却趁热将溶液注入容量瓶中并进行定容
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视容量瓶刻度线
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】实验室欲使用480mL 0.2
 溶液,配制该溶液包含以下步骤:
溶液,配制该溶液包含以下步骤:
①称取一定质量胆矾( )、放入烧杯,用适量蒸馏水将其完全溶解。
)、放入烧杯,用适量蒸馏水将其完全溶解。
②把溶液小心地注入容量瓶中。
③继续向容量瓶中加蒸馏水至凹液面距刻度线1~2cm时,改用胶头滴管滴加,直到溶液的凹液面恰好与刻度线相切为止。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都转入容量瓶中,并轻轻摇匀。
⑤将容量瓶塞好,充分摇匀。
请填写下列空白:
(1)应该称取胆矾的质量是___________ 。
(2)上述操作的正确顺序是___________ 。
(3)实验用到的仪器有托盘天平(砝码)、药匙、烧杯、玻璃棒、___________ 。
(4)下列情况中会导致所配溶液浓度偏小的是___________ (填序号)。
A.容量瓶使用前未干燥
B.转移溶液后,烧杯没有洗涤
C.定容过程观察容量瓶内液面时,俯视刻度线
D.颠倒摇匀后,发现液面低于刻度线,不作任何处置
E.加蒸馏水时不慎超过刻度线,用滴管小心地吸去超出部分,使液面与刻度线相切

 溶液,配制该溶液包含以下步骤:
溶液,配制该溶液包含以下步骤:①称取一定质量胆矾(
 )、放入烧杯,用适量蒸馏水将其完全溶解。
)、放入烧杯,用适量蒸馏水将其完全溶解。②把溶液小心地注入容量瓶中。
③继续向容量瓶中加蒸馏水至凹液面距刻度线1~2cm时,改用胶头滴管滴加,直到溶液的凹液面恰好与刻度线相切为止。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都转入容量瓶中,并轻轻摇匀。
⑤将容量瓶塞好,充分摇匀。
请填写下列空白:
(1)应该称取胆矾的质量是
(2)上述操作的正确顺序是
(3)实验用到的仪器有托盘天平(砝码)、药匙、烧杯、玻璃棒、
(4)下列情况中会导致所配溶液浓度偏小的是
A.容量瓶使用前未干燥
B.转移溶液后,烧杯没有洗涤
C.定容过程观察容量瓶内液面时,俯视刻度线
D.颠倒摇匀后,发现液面低于刻度线,不作任何处置
E.加蒸馏水时不慎超过刻度线,用滴管小心地吸去超出部分,使液面与刻度线相切
您最近一年使用:0次



