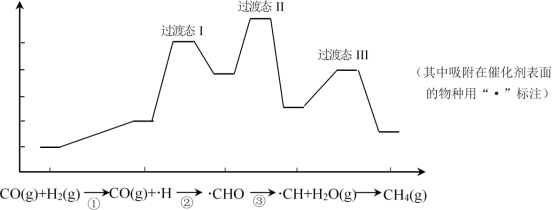
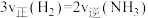甲烷化也是实现“碳达峰”的重要途径,反应机理如下图。下列说法错误的是
甲烷化也是实现“碳达峰”的重要途径,反应机理如下图。下列说法错误的是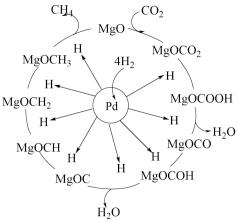
A.该反应使用的催化剂既加快了甲烷化速率,又提高 的平衡转化率 的平衡转化率 |
B. 吸附在催化剂Pd表面而发生反应 吸附在催化剂Pd表面而发生反应 |
C.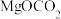 和 和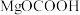 均为该反应过程的中间产物 均为该反应过程的中间产物 |
D.上述甲烷化过程总反应可表示为 |
21-22高三上·全国·阶段练习 查看更多[7]
山东省实验中学2022-2023学年高三下学期开学考试化学试题 湖南省株洲市第一中学2022-2023学年高二上学期期中考试化学试题(已下线)化学(山东A卷)-学易金卷:2023年高考第一次模拟考试卷(已下线)化学(湖南A卷)-学易金卷:2023年高考化学第一次模拟考试卷福建省厦门市湖滨中学2022-2023学年高二上学期期中考试化学试题(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-练习八省八校(T8联考湖北版)2021-2022学年高三上学期第一次联考化学试题
更新时间:2022-01-11 15:48:43
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】一氧化碳甲烷化反应为:CO(g)+3H2(g)=CH4(g)+H2O(g)。如图是使用某种催化剂时转化过程中的能量变化(部分物质省略)。下列说法正确的是

| A.步骤①是放热过程 |
B.步骤① ②只有极性键的断裂 ②只有极性键的断裂 |
| C.过渡态I能量最高,因此其对应的步骤①反应速率最慢,对整个反应的速率起决定作用 |
| D.该方法可以清除剧毒气体CO,从而保护环境 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列说法正确的是
| A.物质发生化学变化不一定都伴有能量的变化 |
| B.活化能越大,表明反应断裂旧化学键需要克服的能量越高 |
| C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| D.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】对可逆反应:A(g) + B(s)  C(s) + D(g) ΔH > 0,下图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②升温;③加压;④加入催化剂;⑤减少C,符合图示的条件是
C(s) + D(g) ΔH > 0,下图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②升温;③加压;④加入催化剂;⑤减少C,符合图示的条件是

 C(s) + D(g) ΔH > 0,下图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②升温;③加压;④加入催化剂;⑤减少C,符合图示的条件是
C(s) + D(g) ΔH > 0,下图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②升温;③加压;④加入催化剂;⑤减少C,符合图示的条件是
| A.②③ | B.①② | C.③④ | D.④⑤ |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列实验方案能达到实验目的是
| 选项 | 实验方案 | 实验目的或结论 |
| A | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄 | 证明氧化性:H2O2>Fe3+ |
| B | 相同条件下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入等体积等浓度的CuSO4溶液和FeCl3溶液 | 探究CuSO4、FeCl3对H2O2分解速率的影响 |
| C | 取a g铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为V L(已转化为标准状况下) | 测定铝箔中Al2O3含量 |
| D | 比较不同反应的反应热数据大小 | 判断反应速率的快慢 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

 2NH3 反应,仅改变下列一个条件,就能提高活化分子的浓度从而加快正反应速率的是
2NH3 反应,仅改变下列一个条件,就能提高活化分子的浓度从而加快正反应速率的是
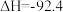 kJ·mol
kJ·mol ,用○、●分别表示H原子、N原子,
,用○、●分别表示H原子、N原子,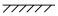 表示催化剂,反应微观历程如下图所示,下列说法中错误的是
表示催化剂,反应微观历程如下图所示,下列说法中错误的是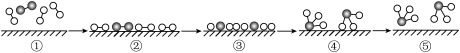
 与
与