Ⅰ.在某温度(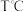 )的水溶液中,
)的水溶液中,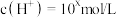 ,
,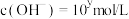 ,x与y关系如图所示。
,x与y关系如图所示。
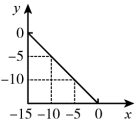
(1)该温度下,水的离子积为_______ ,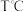
_______ 25℃(填“大于”“小于”或“等于”)。
(2)将此温度下 的
的 溶液与
溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的 约为
约为_______ (已知 )。
)。
Ⅱ. 俗称砒霜,可作长效杀虫剂、杀菌剂和除草剂,在医疗上还可用于治疗急性白血病.测定某
俗称砒霜,可作长效杀虫剂、杀菌剂和除草剂,在医疗上还可用于治疗急性白血病.测定某 粗产品(含
粗产品(含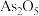 杂质)中
杂质)中 的质量分数实验过程如下:
的质量分数实验过程如下:
①称取0.2g粗产品完全溶解于适量的 溶液后,配制成含
溶液后,配制成含 、
、 的混合溶液100mL。
的混合溶液100mL。
②分别移取25.00mL上述溶液于锥形瓶中,用 的
的 标准溶液进行滴定(在碱性环境中
标准溶液进行滴定(在碱性环境中 可将
可将 氧化为
氧化为 ,指示剂为淀粉).每次滴定开始时液面读数如图a所示,3次滴定结束时,
,指示剂为淀粉).每次滴定开始时液面读数如图a所示,3次滴定结束时, 标准溶液液面读数如图b~d所示。
标准溶液液面读数如图b~d所示。
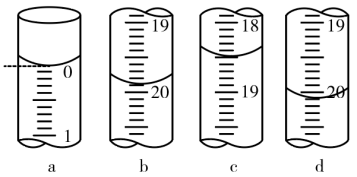
回答下列问题:
(3)配制成含 、
、 的的混合溶液时用到的定量仪器为
的的混合溶液时用到的定量仪器为_______ 。
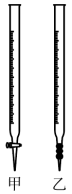
(4)滴定时将 标准溶液装在如图中的
标准溶液装在如图中的_______ (填“甲”或“乙”)滴定管中。
(5)滴定终点的现象是_______ 。
(6)碱性环境中 将
将 氧化为
氧化为 的离子方程式是
的离子方程式是_______ 。
(7)粗产品中 的质量分数为
的质量分数为_______ 。若测定结果偏高,其原因可能是_______ (填字母)
A滴定管用蒸馏水洗净后未用标准溶液润洗
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水清洗后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
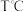 )的水溶液中,
)的水溶液中,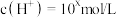 ,
, ,x与y关系如图所示。
,x与y关系如图所示。
(1)该温度下,水的离子积为
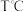
(2)将此温度下
 的
的 溶液与
溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的 约为
约为 )。
)。Ⅱ.
 俗称砒霜,可作长效杀虫剂、杀菌剂和除草剂,在医疗上还可用于治疗急性白血病.测定某
俗称砒霜,可作长效杀虫剂、杀菌剂和除草剂,在医疗上还可用于治疗急性白血病.测定某 粗产品(含
粗产品(含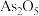 杂质)中
杂质)中 的质量分数实验过程如下:
的质量分数实验过程如下:①称取0.2g粗产品完全溶解于适量的
 溶液后,配制成含
溶液后,配制成含 、
、 的混合溶液100mL。
的混合溶液100mL。②分别移取25.00mL上述溶液于锥形瓶中,用
 的
的 标准溶液进行滴定(在碱性环境中
标准溶液进行滴定(在碱性环境中 可将
可将 氧化为
氧化为 ,指示剂为淀粉).每次滴定开始时液面读数如图a所示,3次滴定结束时,
,指示剂为淀粉).每次滴定开始时液面读数如图a所示,3次滴定结束时, 标准溶液液面读数如图b~d所示。
标准溶液液面读数如图b~d所示。
回答下列问题:
(3)配制成含
 、
、 的的混合溶液时用到的定量仪器为
的的混合溶液时用到的定量仪器为(4)滴定时将
 标准溶液装在如图中的
标准溶液装在如图中的
(5)滴定终点的现象是
(6)碱性环境中
 将
将 氧化为
氧化为 的离子方程式是
的离子方程式是(7)粗产品中
 的质量分数为
的质量分数为A滴定管用蒸馏水洗净后未用标准溶液润洗
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水清洗后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
更新时间:2021-12-21 10:21:11
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】酸、碱、盐的水溶液在生产生活及化学实验中有广泛的应用,请同学们运用所学知识解决下列问题。
(1)某温度 T 下,0.1mol/L 的 NaOH 溶液中,c(H+)=1.0×10- 11mol/L,此时水的离子积常数 Kw=_______ 。温度 T_______ 25℃(填“大于”“小于”或“等于”) ,原因是_______ 。
(2)已知水溶液中 c(H+)和 c(OH-)的关系如图所示:
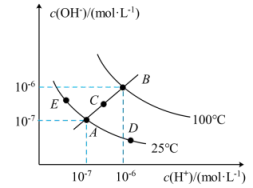
①图中 A 、B 、C 、D 四点对应的水的离子积常数由大到小的顺序是_______ 。
②若 A 点到 E 点,可采用的措施是_______ (填序号,下同);从 A 点到 C 点,可采用的措 施是_______ ;促进水的电离平衡的措施是_______ 。(以上填序号)
a.升温 b.加入少量的盐酸 c.加入少量的 NaOH
(3)常温下 0. 1mol/L 的 HA 溶液中,c(H+)=0.001mol/L ,写出 HA 的电离方程式_______ ,水 电离的 c(H+)=_______ mol/L。为使 HA 溶液中 HA 的电离平衡正向移动,而水的 Kw 保持不 变可以采取的措施是_______ 。
(1)某温度 T 下,0.1mol/L 的 NaOH 溶液中,c(H+)=1.0×10- 11mol/L,此时水的离子积常数 Kw=
(2)已知水溶液中 c(H+)和 c(OH-)的关系如图所示:

①图中 A 、B 、C 、D 四点对应的水的离子积常数由大到小的顺序是
②若 A 点到 E 点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的 NaOH
(3)常温下 0. 1mol/L 的 HA 溶液中,c(H+)=0.001mol/L ,写出 HA 的电离方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】水是“生命之基质”,是“永远值得探究的物质”。
(1)关于反应H2(g)+ O2(g)=H2O(l),下列说法不正确的是
O2(g)=H2O(l),下列说法不正确的是______
A. 焓变ΔH<0,熵变ΔS<0
B. 可以把反应设计成原电池,实现能量的转化
C. 一定条件下,若观察不到水的生成,说明该条件下反应不能自发进行
D. 选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
(2)根据H2O的成键特点,画出与图中H2O分子直接相连的所有氢键(O—H…O)______ 。

(3)水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2℃)、临界压强(22.1MPa)时的水称为超临界水。
①与常温常压的水相比。高温高压液态水的离子积会显著增大。解释其原因______ 。
②如果水的离子积Kw从10×10-14增大到1.0×10-10,则相应的电离度是原来的______ 倍。
③超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图所示,其中x为以碳元素计算的物质的量分数,t为反应时间。

下列说法合理的是______
A. 乙醇的超临界水氧化过程中,一氧化碳是中间产物,二氧化碳是最终产物
B. 在550℃条件下,反应时间大于15s时,乙醇氧化为二氧化碳已趋于完全
C. 乙醇的超临界水氧化过程中,乙醇的消耗速率或二氧化碳的生成速率都可以用来表示反应的速率,而且两者数值相等
D. 随温度升高,xCO峰值出现的时间提前,且峰值更高,说明乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大
(4)以铂阳极和石墨阴极设计电解池,通过电解NH4HSO4溶液产生(NH4)2S2O8,再与水反应得到H2O2;其中生成的NH4HSO4可以循环使用。
①阳极的电极反应式是______ 。
②制备H2O2的总反应方程式是______ 。
(1)关于反应H2(g)+
 O2(g)=H2O(l),下列说法不正确的是
O2(g)=H2O(l),下列说法不正确的是A. 焓变ΔH<0,熵变ΔS<0
B. 可以把反应设计成原电池,实现能量的转化
C. 一定条件下,若观察不到水的生成,说明该条件下反应不能自发进行
D. 选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
(2)根据H2O的成键特点,画出与图中H2O分子直接相连的所有氢键(O—H…O)

(3)水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2℃)、临界压强(22.1MPa)时的水称为超临界水。
①与常温常压的水相比。高温高压液态水的离子积会显著增大。解释其原因
②如果水的离子积Kw从10×10-14增大到1.0×10-10,则相应的电离度是原来的
③超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图所示,其中x为以碳元素计算的物质的量分数,t为反应时间。

下列说法合理的是
A. 乙醇的超临界水氧化过程中,一氧化碳是中间产物,二氧化碳是最终产物
B. 在550℃条件下,反应时间大于15s时,乙醇氧化为二氧化碳已趋于完全
C. 乙醇的超临界水氧化过程中,乙醇的消耗速率或二氧化碳的生成速率都可以用来表示反应的速率,而且两者数值相等
D. 随温度升高,xCO峰值出现的时间提前,且峰值更高,说明乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大
(4)以铂阳极和石墨阴极设计电解池,通过电解NH4HSO4溶液产生(NH4)2S2O8,再与水反应得到H2O2;其中生成的NH4HSO4可以循环使用。
①阳极的电极反应式是
②制备H2O2的总反应方程式是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】Ⅰ、水的电离平衡曲线如图所示。

(1)若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从________ 变化到_________ 。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的pH=7,则Ba(OH)2和盐酸的体积比为__________________ 。
Ⅱ、有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复 ):阳离子 Na+、Ba2+、NH4+ 阴离子 CH3COO-、Cl-、OH-、SO42-。已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
①A是__________________ ,B是 __________________ 。
②用离子方程式表示A溶液呈碱性的原因__________________________ 。

(1)若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的pH=7,则Ba(OH)2和盐酸的体积比为
Ⅱ、有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质
①A是
②用离子方程式表示A溶液呈碱性的原因
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】滴定常用来定同分析,在科研、实验、工农业生产、环保等方面应用广泛。回答下列问题:
Ⅰ.现称取 某品牌奶粉利用凯氏定氮法和滴定法测其含氮量,其原理是在高温浓硫酸的作用下,将样品中的有机氮转化为无机铵盐,冷却后加入过量的碱,再将氨蒸出后用一定量水充分吸收,最后利用标准酸溶液滴定吸收液,推算样品中的含氮量。
某品牌奶粉利用凯氏定氮法和滴定法测其含氮量,其原理是在高温浓硫酸的作用下,将样品中的有机氮转化为无机铵盐,冷却后加入过量的碱,再将氨蒸出后用一定量水充分吸收,最后利用标准酸溶液滴定吸收液,推算样品中的含氮量。
(1)向酸式滴定管中注入标准盐酸之前的一步操作为_______ 。
(2)用甲基橙作指示剂,用标准盐酸滴定吸收液,终点现象为_______ 。
(3)滴定全部吸收液,消耗 盐酸VmL,则样品中氮元素的质量分数为
盐酸VmL,则样品中氮元素的质量分数为_______ 。(用含m、c、V的代数式表示)。
Ⅱ.某化学兴趣小组利用滴定原理测定无水碱式氯化铜 [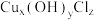 ]组成实验如下:
]组成实验如下:
①溶解:称取产品 ,加稀硝酸溶解,并加水定容至
,加稀硝酸溶解,并加水定容至 ,得到待测液。
,得到待测液。
②铜的测定:取 待测液,加入足量稀的氢氧化钠溶液,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为
待测液,加入足量稀的氢氧化钠溶液,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为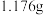 。
。
③沉淀滴定法测定氯,步骤如下:
a.准确量取 待测液于雉形瓶中,加入
待测液于雉形瓶中,加入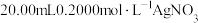 溶液,充分反应;
溶液,充分反应;
b.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
c.加入指示剂,用 标准溶液滴定过量的
标准溶液滴定过量的 溶液;
溶液;
d.重复实验操作三次,消耗 溶液的体积平均为
溶液的体积平均为 。已知
。已知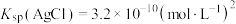 ,
,
(4)滴定可选用的指示剂是_______(填标号)。
(5)步骤b加入硝基苯的作用_______ ,如果不加硝基苯,则导致所测含氯量_______ (填“偏大”、“偏小”或“不变”)。
(6)根据上述实验结果可推知该碱式氯化铜的化学式为_______ 。
Ⅰ.现称取
 某品牌奶粉利用凯氏定氮法和滴定法测其含氮量,其原理是在高温浓硫酸的作用下,将样品中的有机氮转化为无机铵盐,冷却后加入过量的碱,再将氨蒸出后用一定量水充分吸收,最后利用标准酸溶液滴定吸收液,推算样品中的含氮量。
某品牌奶粉利用凯氏定氮法和滴定法测其含氮量,其原理是在高温浓硫酸的作用下,将样品中的有机氮转化为无机铵盐,冷却后加入过量的碱,再将氨蒸出后用一定量水充分吸收,最后利用标准酸溶液滴定吸收液,推算样品中的含氮量。(1)向酸式滴定管中注入标准盐酸之前的一步操作为
(2)用甲基橙作指示剂,用标准盐酸滴定吸收液,终点现象为
(3)滴定全部吸收液,消耗
 盐酸VmL,则样品中氮元素的质量分数为
盐酸VmL,则样品中氮元素的质量分数为Ⅱ.某化学兴趣小组利用滴定原理测定无水碱式氯化铜 [
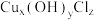 ]组成实验如下:
]组成实验如下:①溶解:称取产品
 ,加稀硝酸溶解,并加水定容至
,加稀硝酸溶解,并加水定容至 ,得到待测液。
,得到待测液。②铜的测定:取
 待测液,加入足量稀的氢氧化钠溶液,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为
待测液,加入足量稀的氢氧化钠溶液,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为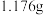 。
。③沉淀滴定法测定氯,步骤如下:
a.准确量取
 待测液于雉形瓶中,加入
待测液于雉形瓶中,加入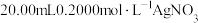 溶液,充分反应;
溶液,充分反应;b.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
c.加入指示剂,用
 标准溶液滴定过量的
标准溶液滴定过量的 溶液;
溶液;d.重复实验操作三次,消耗
 溶液的体积平均为
溶液的体积平均为 。已知
。已知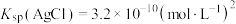 ,
,
(4)滴定可选用的指示剂是_______(填标号)。
A. | B. | C. | D. |
(6)根据上述实验结果可推知该碱式氯化铜的化学式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】碘是人体不可缺少的微量元素,也是制造各种无机及有机碘化物的重要原料。
(1)采用离子交换法从卤水(含有I-)中提取碘的工艺流程如下:
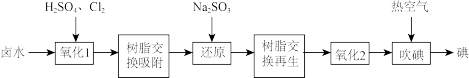
①树脂吸附原理是将氧化生成的In-与树脂中的阴离子发生交换。写出“氧化1”步骤中生成In-的离子反应方程式为_______ 。
②还原前对树脂进行处理。证明“还原”时Na2SO3被氧化的实验操作是_______ 。
(2)实验室中,可采用如图昕示装置制取碘。

①实验中,冷凝管中的冷凝水通常从a端通入,其目的是_______ 。
②该实验温度控制在40℃左右的原因_______ 。
(3)为测定卤水样品中I的含量,进行下列实验:
①取100.00 mL卤水样品减压浓缩垒20.00 mL,加入过量的0.1500 mol·L-1 CuCl2溶液20.00mL。(发生反应为2Cu2++4I-=I2+2CuI↓)。
②密封静置2h,生成白色沉淀,过滤。
③用0.1000 mol·L-1 Na2S2O3标准溶液进行滴定。(反应I2+2S2O =2I-+S4O
=2I-+S4O )
)
请补充完整滴定过程的有关实验操作:将过滤所得的滤液全部转移至锥形瓶中,_______ ;向洗涤干净的碱式滴定管中加入Na2S2O3标准溶液,_______ ,边振荡边逐滴加入标准溶液,观察锥形瓶中溶液颜色变化,直至_______ ,停止滴定,读数并记录数据。
(4)实验测得消耗Na2S2O3溶液的体积为22.00 mL。计算卤水样品中I-的物质的量浓度_______ (写出计算过程)。
(1)采用离子交换法从卤水(含有I-)中提取碘的工艺流程如下:
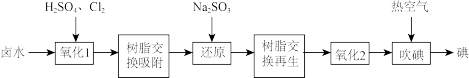
①树脂吸附原理是将氧化生成的In-与树脂中的阴离子发生交换。写出“氧化1”步骤中生成In-的离子反应方程式为
②还原前对树脂进行处理。证明“还原”时Na2SO3被氧化的实验操作是
(2)实验室中,可采用如图昕示装置制取碘。

①实验中,冷凝管中的冷凝水通常从a端通入,其目的是
②该实验温度控制在40℃左右的原因
(3)为测定卤水样品中I的含量,进行下列实验:
①取100.00 mL卤水样品减压浓缩垒20.00 mL,加入过量的0.1500 mol·L-1 CuCl2溶液20.00mL。(发生反应为2Cu2++4I-=I2+2CuI↓)。
②密封静置2h,生成白色沉淀,过滤。
③用0.1000 mol·L-1 Na2S2O3标准溶液进行滴定。(反应I2+2S2O
 =2I-+S4O
=2I-+S4O )
)请补充完整滴定过程的有关实验操作:将过滤所得的滤液全部转移至锥形瓶中,
(4)实验测得消耗Na2S2O3溶液的体积为22.00 mL。计算卤水样品中I-的物质的量浓度
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】现使用酸碱中和滴定法测定市售白醋的总酸量 [g/100mL]。
(1)用_______ (填仪器名称,下同)量取 食用白醋,在烧杯中用水稀释后转移到
食用白醋,在烧杯中用水稀释后转移到 容量瓶中定容,摇匀即得待测白醋溶液。
容量瓶中定容,摇匀即得待测白醋溶液。
(2)取待测白醋溶液 于锥形瓶中,向其中滴加2滴
于锥形瓶中,向其中滴加2滴_______ 作指示剂。
(3)读取盛装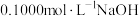 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为
溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为_______  。
。

(4)滴定。当_______ 时,停止滴定,并记录 溶液的终读数。重复滴定3次。
溶液的终读数。重复滴定3次。
(5)该市售白醋的总酸量_______ 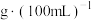 。
。
(6)在本实验的滴定过程中,下列操作会使实验结果偏小的是_______。
(7)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将 血液用蒸馏水稀释后,向其中加入足量草酸铵
血液用蒸馏水稀释后,向其中加入足量草酸铵 晶体,反应生成
晶体,反应生成 沉淀,将沉淀用稀硫酸处理得
沉淀,将沉淀用稀硫酸处理得 溶液。
溶液。
②将①得到的 溶液,再用酸性
溶液,再用酸性 溶液滴定,氧化产物为
溶液滴定,氧化产物为 ,还原产物为
,还原产物为 。
。
③终点时用去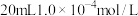 的
的 溶液。
溶液。
通过计算可知,血液中含钙离子的浓度为_______  。
。
(1)用
 食用白醋,在烧杯中用水稀释后转移到
食用白醋,在烧杯中用水稀释后转移到 容量瓶中定容,摇匀即得待测白醋溶液。
容量瓶中定容,摇匀即得待测白醋溶液。(2)取待测白醋溶液
 于锥形瓶中,向其中滴加2滴
于锥形瓶中,向其中滴加2滴(3)读取盛装
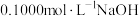 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为
溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为 。
。
(4)滴定。当
 溶液的终读数。重复滴定3次。
溶液的终读数。重复滴定3次。| 滴定次数 | 1 | 2 | 3 | 4 |
| V样品(mL) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)消耗 (mL) | 15.95 | 15.00 | 15.05 | 14.95 |
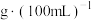 。
。(6)在本实验的滴定过程中,下列操作会使实验结果偏小的是_______。
A.碱式滴定管在滴定时用标准 溶液润洗 溶液润洗 |
| B.酸式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失 |
| C.锥形瓶中加入待测白醋溶液后,再加少量水 |
| D.锥形瓶在滴定时剧烈摇动,有少量液体溅出 |
①可将
 血液用蒸馏水稀释后,向其中加入足量草酸铵
血液用蒸馏水稀释后,向其中加入足量草酸铵 晶体,反应生成
晶体,反应生成 沉淀,将沉淀用稀硫酸处理得
沉淀,将沉淀用稀硫酸处理得 溶液。
溶液。②将①得到的
 溶液,再用酸性
溶液,再用酸性 溶液滴定,氧化产物为
溶液滴定,氧化产物为 ,还原产物为
,还原产物为 。
。③终点时用去
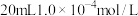 的
的 溶液。
溶液。通过计算可知,血液中含钙离子的浓度为
 。
。
您最近一年使用:0次



