(1)某温度 T 下,0.1mol/L 的 NaOH 溶液中,c(H+)=1.0×10- 11mol/L,此时水的离子积常数 Kw=
(2)已知水溶液中 c(H+)和 c(OH-)的关系如图所示:
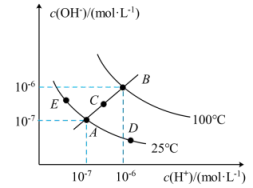
①图中 A 、B 、C 、D 四点对应的水的离子积常数由大到小的顺序是
②若 A 点到 E 点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的 NaOH
(3)常温下 0. 1mol/L 的 HA 溶液中,c(H+)=0.001mol/L ,写出 HA 的电离方程式
相似题推荐

(1)若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的pH=7,则Ba(OH)2和盐酸的体积比为
Ⅱ、有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质
①A是
②用离子方程式表示A溶液呈碱性的原因
(1) 关于反应H2(g)+1/2O2(g)
 H2O(l),下列说法
H2O(l),下列说法A.焓变ΔH<0,熵变ΔS<0
B.可以把反应设计成原电池,实现能量的转化
C.一定条件下,若观察不到水的生成,说明该条件下反应不能自发进行
D.选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
(2) ①根据H2O的成键特点,画出与图中H2O分子直接相连的所有氢键(O-H…O)
②将一定量水放入抽空的恒容密闭容器中,测定不同温度(T)下气态、液态水平衡共存[H2O(l)H2O(g)]时的压强(p)。在图中画出从20℃开始经过100℃的p随T变化关系示意图(20℃时的平衡压强用p1表示)
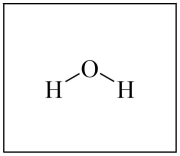

(3) 水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2℃)、临界压强(22.1 MPa)时的水称为超临界水。
①与常温常压的水相比,高温高压液态水的离子积会显著增大。解释其原因
②如果水的离子积Kw从1.0×10−14增大到1.0×10−10,则相应的电离度是原来的
③超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图所示,其中x为以碳元素计的物质的量分数,t为反应时间。
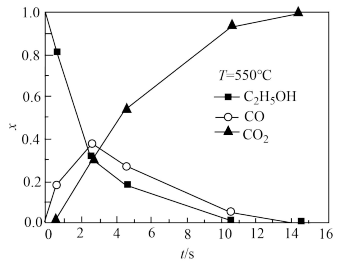
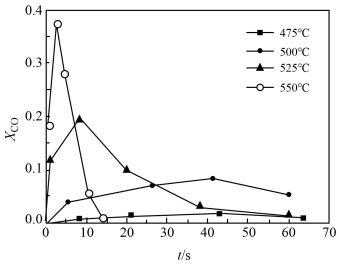
下列说法合理的是
A.乙醇的超临界水氧化过程中,一氧化碳是中间产物,二氧化碳是最终产物
B.在550℃条件下,反应时间大于15 s时,乙醇氧化为二氧化碳已趋于完全
C.乙醇的超临界水氧化过程中,乙醇的消耗速率或二氧化碳的生成速率都可以用来表示反应的速率,而且两者数值相等
D.随温度升高,xCO峰值出现的时间提前,且峰值更高,说明乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大
(4) 以铂阳极和石墨阴极设计电解池,通过电解NH4HSO4溶液产生(NH4)2S2O8,再与水反应得到H2O2,其中生成的NH4HSO4可以循环使用。
①阳极的电极反应式是
②制备H2O2的总反应方程式是
 和
和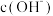 的关系如图所示:
的关系如图所示: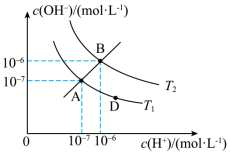
(1)下列说法正确的是
a.图中A、B、D三点处
 的大小关系:
的大小关系: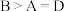
b.在
 温度下,向水中加入少量的NaOH可实现由A点向D点移动
温度下,向水中加入少量的NaOH可实现由A点向D点移动c.AB线上任意点的溶液均呈中性
d.图中温度
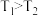
(2)①在
 温度下,pH=2的
温度下,pH=2的 溶液中由水电离的
溶液中由水电离的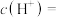
 。
。②保持
 温度不变,将pH=11的KOH溶液
温度不变,将pH=11的KOH溶液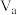 L与pH=2的
L与pH=2的 溶液
溶液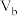 L混合后溶液pH=6(忽略混合时溶液体积变化),则
L混合后溶液pH=6(忽略混合时溶液体积变化),则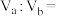
③
 温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用
温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用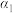 、
、 表示,则
表示,则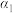 (填“>”“=”或“<”)
(填“>”“=”或“<”) 。
。Ⅱ.已知常温下几种酸的电离平衡常数如表:
| 化学式 | HCOOH | HCN |  |
| 电离平衡常数 |  |  |  、 、 |
(3)同温下,相同物质的量浓度的NaCN与NaHCO3溶液,二者的pH大小关系为:NaCN
(4)常温下,0.1mol/L的HCN溶液中,
 约为
约为(5)根据电离平衡常数判断,以下反应不能进行的是__________。
A. |
B.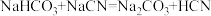 |
C.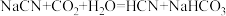 |
D. |
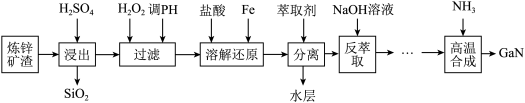
已知:常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表。
| 金属离子 | Fe2+ | Fe3+ | Zn2+ | Ga3+ |
| 开始沉淀pH | 8.0 | 1.7 | 5.5 | 3.0 |
| 沉淀完全pH | 9.6 | 3.2 | 8.0 | 4.9 |
| 萃取率(%) | 0 | 99 | 0 | 97~98.5 |
(1)写出铁酸锌(ZnFe2O4) 中铁元素的化合价
(2)Ga位于周期表IIIA族,性质与Al相似,反萃取后水溶液中镓元素以
(3)处理浸出液时,调节pH至5.4的目的是
(4)加入铁的原因为
(5)写出“高温合成”操作中Ga(CH3)3与NH3反应生成GaN的化学方程式
(6)利用炼锌矿矿渣所获得的三种金属盐,分别为镓盐、
(7)取一定量GaN样品溶于足量的热NaOH溶液中,用H3BO3溶液将产生的NH3完全吸收,用标准浓度的盐酸滴定,通过消耗盐酸的体积,可测定样品的纯度。已知:NH3+ H3BO3= NH3·H3BO3;NH3·H3BO3 +HCl= NH4Cl+H3BO3,硼酸的Ka=10-9.24,从滴定角度分析可用过量H3BO3溶液吸收NH3的可能原因是
(1)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3-):c(CO32-)=2:1,溶液中由水电离出的c(H+)=
(2)CO2和H2充入一定体积的密闭容器中,反应过程和在两种温度下CH3OH的物质的量随时间的变化如图所示。
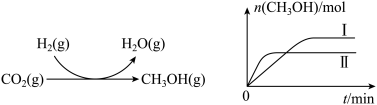
①已知图所示反应每消耗1molH2,热量变化是16.3kJ,则反应的热化学方程式为
②一定温度下,若此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有3个H—H断裂
③一定比例的合成气在装有催化剂的反应器中反应12小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。

当温度为470K时,图中P点
(3)用二氧化碳可合成低密度聚乙烯(LDPE)。常温常压下以纳米二氧化钛膜为工作电极,电解CO2,可制得LDPE,可能的机理如图所示。

则过程I中阴极电极反应式
(1)若三种酸溶液中的
 相等,则三种酸的物质的量浓度由大到小的顺序为
相等,则三种酸的物质的量浓度由大到小的顺序为(2)若三种酸的物质的量浓度相等,取等体积上述三种溶液,分别与等量锌粉反应,反应的初始速率由快到慢的顺序为
II:25℃时,部分物质的电离平衡常数如表所示:
| 化学式 |  | H2CO3 |  |  |
电离平衡常数 |  |   |  | 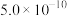 |
请回答下列问题:
(3)已知常温下
 的pH为3,则常温下
的pH为3,则常温下 的电离度为
的电离度为(4)
 、
、 、HCN的酸性由强到弱的顺序为
、HCN的酸性由强到弱的顺序为(5)向NaCN中通少量的CO2,发生反应的化学方程式为
Ⅰ.化学家研究发现,SbF5能将MnF4从离子[MnF6]2-的盐中反应得到,SbF5转化成稳定离子[SbF6]-的盐。而MnF4很不稳定,受热易分解为MnF3和F2。根据以上研究写出以K2MnF6和SbF5为原料,在 423 K 的温度下制备F2的化学方程式:

现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。
已知KHF2是一种酸式盐,写出阴极上发生的电极反应式
Ⅱ.①卤化氢的熔沸点随相对分子质量增加而升高,而HF熔沸点高于HCl的原因是
②已知25 ℃时,氢氟酸(HF)的电离平衡常数Ka=3.6×10-4。
某pH=2的氢氟酸溶液,由水电离出的c(H+)=
③又已知25 ℃时,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol/L HF溶液中加入 1 L 0.2 mol/L CaCl2 溶液,通过列式计算说明是否有沉淀产生:
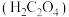 俗称草酸,为无色晶体,是二元弱酸,广泛分布于植物、动物和真菌体中,在实验研究和化学工业中应用广泛。请回答下列问题:
俗称草酸,为无色晶体,是二元弱酸,广泛分布于植物、动物和真菌体中,在实验研究和化学工业中应用广泛。请回答下列问题:(1)工业上由以下反应制取乙二酸:
 ,能说明该反应已达到平衡状态的是
,能说明该反应已达到平衡状态的是a.平衡常数K保持不变 b.溶液的
 保持不变
保持不变c.反应液的总质量保持不变 d.丁醇的物质的量保持不变
(2)人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一、有研究发现,EDTA(一种能结合钙离子的试剂)在一定条件下可有效溶解结石,用化学平衡原理解释其原因:
(3)乙二酸溶液中微粒的物质的量分数随溶液
 变化如图所示:
变化如图所示:
①向乙二酸溶液中滴加
 溶液,
溶液, 由2.5至5.5过程中发生的主要反应的离子方程式是
由2.5至5.5过程中发生的主要反应的离子方程式是②向
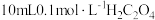 溶液中逐滴加入
溶液中逐滴加入 溶液,此时溶液中
溶液,此时溶液中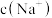
 (填“>”、“=”或“<”),若加入
(填“>”、“=”或“<”),若加入 溶液体积为
溶液体积为 ,此时溶液中阴离子浓度的大小顺序为
,此时溶液中阴离子浓度的大小顺序为 时,溶液中
时,溶液中
(4)设计实验证明乙二酸的酸性比碳酸的强
(5)利用草酸制备草酸亚铁晶体
 的流程如图:
的流程如图:
已知:ⅰ.
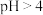 时,
时, 易被氧气氧化。
易被氧气氧化。ⅱ.几种物质的溶解度
 如下:
如下: | 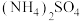 |  | |
 | 48 | 75 | 37 |
 | 101 | 88 | 38 |
①用稀硫酸调溶液
 至1~2的目的是
至1~2的目的是②趁热过滤的原因是
Ⅰ.
 是实验室常见的电解质,根据要求回答下列问题:
是实验室常见的电解质,根据要求回答下列问题:(1)下列物质中,与醋酸同属弱电解质的是_______
| A.氯化氢 | B.醋酸铵 | C.一水合氨 | D.二氧化碳 |
A.含 的溶液 的溶液 | B.能使酚酞呈无色的溶液 |
C.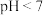 的溶液 的溶液 | D. |
A.溶液中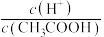 的值增大 的值增大 | B. 增大2个单位 增大2个单位 |
C.溶液中 减小 减小 | D. 减小 减小 |
 介入,则有_______
介入,则有_______| A.反应速率减缓 | B.产生氢气的总量不变 |
C.溶液的 减小 减小 | D.溶液中 减小 减小 |
Ⅱ.将一定浓度的醋酸稀释10倍并配成
 溶液,取
溶液,取 稀释后的溶液,用
稀释后的溶液,用 标准溶液滴定。
标准溶液滴定。(5)实验中需要的定量仪器除了移液管,还需要

(6)下列相关操作会造成所测定醋酸的浓度偏高的有___________。
| A.用待测液洗锥形瓶 | B.没有用标准液润洗碱式滴定管 |
| C.滴定结束时,俯视刻度读数 | D.滴定开始时锥形瓶中有水 |
| 实验次数 | ||||
 | 19.82 | 19.80 | 22.00 | 19.78 |
Ⅲ.将等体积的
 溶液和
溶液和 溶液分别加水稀释,
溶液分别加水稀释, 随加水稀释倍数的变化如图所示。
随加水稀释倍数的变化如图所示。
(8)比较电离平衡常数:
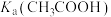
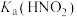 。(填“>、<或=”下同)
。(填“>、<或=”下同)(9)a点由水电离的
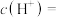
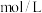 ,比较a、b、c三点水的电离程度大小顺序为
,比较a、b、c三点水的电离程度大小顺序为 恰好中和,溶液中
恰好中和,溶液中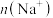 :d点
:d点(10)已知:25℃时
 和
和 (亚磷酸)的电离平衡常数:
(亚磷酸)的电离平衡常数:| 化学式 |  |  (亚磷酸) (亚磷酸) |
电离平衡常数 | 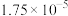 |  , , |
①
 与足量
与足量 反应的化学方程式
反应的化学方程式②书写
 溶液中加入足量醋酸的离子方程式:
溶液中加入足量醋酸的离子方程式:


