【加试题】水是“生命之基质”,是“永远值得探究的物质”。
(1) 关于反应H2(g)+1/2O2(g) H2O(l),下列说法
H2O(l),下列说法不正确 的是________ 。
A.焓变ΔH<0,熵变ΔS<0
B.可以把反应设计成原电池,实现能量的转化
C.一定条件下,若观察不到水的生成,说明该条件下反应不能自发进行
D.选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
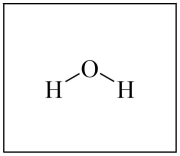
(2) ①根据H2O的成键特点,画出与图中H2O分子直接相连的所有氢键(O-H…O)________ 。
②将一定量水放入抽空的恒容密闭容器中,测定不同温度(T)下气态、液态水平衡共存[H2O(l)H2O(g)]时的压强(p)。在图中画出从20℃开始经过100℃的p随T变化关系示意图(20℃时的平衡压强用p1表示)________ 。

(3) 水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2℃)、临界压强(22.1 MPa)时的水称为超临界水。
①与常温常压的水相比,高温高压液态水的离子积会显著增大。解释其原因________ 。
②如果水的离子积Kw从1.0×10−14增大到1.0×10−10,则相应的电离度是原来的________ 倍。
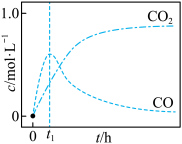
③超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图所示,其中x为以碳元素计的物质的量分数,t为反应时间。
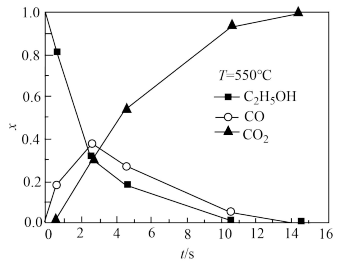
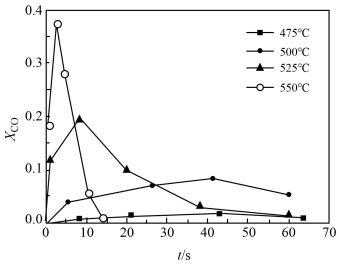
下列说法合理的是________ 。
A.乙醇的超临界水氧化过程中,一氧化碳是中间产物,二氧化碳是最终产物
B.在550℃条件下,反应时间大于15 s时,乙醇氧化为二氧化碳已趋于完全
C.乙醇的超临界水氧化过程中,乙醇的消耗速率或二氧化碳的生成速率都可以用来表示反应的速率,而且两者数值相等
D.随温度升高,xCO峰值出现的时间提前,且峰值更高,说明乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大
(4) 以铂阳极和石墨阴极设计电解池,通过电解NH4HSO4溶液产生(NH4)2S2O8,再与水反应得到H2O2,其中生成的NH4HSO4可以循环使用。
①阳极的电极反应式是________ 。
②制备H2O2的总反应方程式是________ 。
(1) 关于反应H2(g)+1/2O2(g)
 H2O(l),下列说法
H2O(l),下列说法A.焓变ΔH<0,熵变ΔS<0
B.可以把反应设计成原电池,实现能量的转化
C.一定条件下,若观察不到水的生成,说明该条件下反应不能自发进行
D.选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
(2) ①根据H2O的成键特点,画出与图中H2O分子直接相连的所有氢键(O-H…O)
②将一定量水放入抽空的恒容密闭容器中,测定不同温度(T)下气态、液态水平衡共存[H2O(l)H2O(g)]时的压强(p)。在图中画出从20℃开始经过100℃的p随T变化关系示意图(20℃时的平衡压强用p1表示)


(3) 水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2℃)、临界压强(22.1 MPa)时的水称为超临界水。
①与常温常压的水相比,高温高压液态水的离子积会显著增大。解释其原因
②如果水的离子积Kw从1.0×10−14增大到1.0×10−10,则相应的电离度是原来的
③超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图所示,其中x为以碳元素计的物质的量分数,t为反应时间。


下列说法合理的是
A.乙醇的超临界水氧化过程中,一氧化碳是中间产物,二氧化碳是最终产物
B.在550℃条件下,反应时间大于15 s时,乙醇氧化为二氧化碳已趋于完全
C.乙醇的超临界水氧化过程中,乙醇的消耗速率或二氧化碳的生成速率都可以用来表示反应的速率,而且两者数值相等
D.随温度升高,xCO峰值出现的时间提前,且峰值更高,说明乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大
(4) 以铂阳极和石墨阴极设计电解池,通过电解NH4HSO4溶液产生(NH4)2S2O8,再与水反应得到H2O2,其中生成的NH4HSO4可以循环使用。
①阳极的电极反应式是
②制备H2O2的总反应方程式是
2019·浙江·高考真题 查看更多[4]
(已下线)2019年高考浙江卷化学试题变式题(原理综合题)(已下线)专题17 原理综合题(已下线)专题20.化学反应原理综合应用-十年(2012-2021)高考化学真题分项汇编(浙江专用)2019年4月浙江省普通高校招生选考科目考试化学试题
更新时间:2019-04-12 15:06:23
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】氮氧化物气体是造成光化学污染的主要气体,降低氮氧化物气体的排放是环境保护的重要课题。
(1)用 氧化可脱除氮氧化物。
氧化可脱除氮氧化物。
已知:①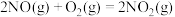
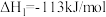
②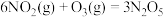
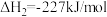
③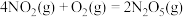
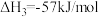
用 氧化脱除NO的总反应是:
氧化脱除NO的总反应是: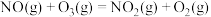 的
的
_______ ,该反应在热力学上趋势大,其原因是_______ 。
(2)氮氧化物间的相互转化,已知 的反应历程分两步:
的反应历程分两步:
第一步: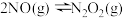 (快反应)
(快反应)
第二步: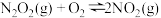 (慢反应)
(慢反应)
①总反应的速率由_______ 决定(填“第一步”或“第二步”)。
②用 表示的速率方程为
表示的速率方程为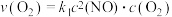 ;
; 表示的速率方程为
表示的速率方程为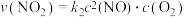 ,
, 与
与 分别表示速率常数,则
分别表示速率常数,则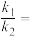
_______ (填数值)。
③下列关于反应 的说法正确的是
的说法正确的是_______ (填序号)。
A.反应的总活化能等于第一步和第二步反应的活化能之和
B.使压强增大,反应速率常数一定增大
C.第一步反应的活化能小于第二步反应的活化能
(3)电解氧化吸收法可将废气中的 转变为硝态氮。分别向
转变为硝态氮。分别向 溶液和
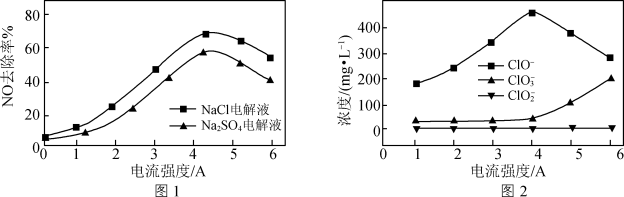
溶液和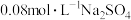 溶液(起始pH均调至9)中通入NO,测得电流强度与NO的脱除率的关系如图1所示。电解
溶液(起始pH均调至9)中通入NO,测得电流强度与NO的脱除率的关系如图1所示。电解 溶液时,溶液中相关成分的浓度变化与电流强度的关系如图2所示。
溶液时,溶液中相关成分的浓度变化与电流强度的关系如图2所示。
①电解 溶液时产生
溶液时产生 ,
, 氧化吸收NO的离子方程式为
氧化吸收NO的离子方程式为_______ 。
②电解NaCl溶液作吸收液时,NO的去除率始终比 溶液的大,原因是
溶液的大,原因是_______ 。
③随着电流强度的增大,电解NaCl溶液时NO去除率下降的原因是_______ 。
(1)用
 氧化可脱除氮氧化物。
氧化可脱除氮氧化物。已知:①
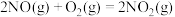
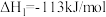
②
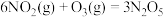
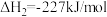
③
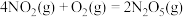
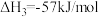
用
 氧化脱除NO的总反应是:
氧化脱除NO的总反应是: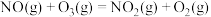 的
的
(2)氮氧化物间的相互转化,已知
 的反应历程分两步:
的反应历程分两步:第一步:
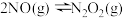 (快反应)
(快反应)第二步:
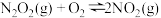 (慢反应)
(慢反应)①总反应的速率由
②用
 表示的速率方程为
表示的速率方程为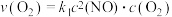 ;
; 表示的速率方程为
表示的速率方程为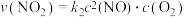 ,
, 与
与 分别表示速率常数,则
分别表示速率常数,则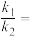
③下列关于反应
 的说法正确的是
的说法正确的是A.反应的总活化能等于第一步和第二步反应的活化能之和
B.使压强增大,反应速率常数一定增大
C.第一步反应的活化能小于第二步反应的活化能
(3)电解氧化吸收法可将废气中的
 转变为硝态氮。分别向
转变为硝态氮。分别向 溶液和
溶液和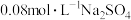 溶液(起始pH均调至9)中通入NO,测得电流强度与NO的脱除率的关系如图1所示。电解
溶液(起始pH均调至9)中通入NO,测得电流强度与NO的脱除率的关系如图1所示。电解 溶液时,溶液中相关成分的浓度变化与电流强度的关系如图2所示。
溶液时,溶液中相关成分的浓度变化与电流强度的关系如图2所示。
①电解
 溶液时产生
溶液时产生 ,
, 氧化吸收NO的离子方程式为
氧化吸收NO的离子方程式为②电解NaCl溶液作吸收液时,NO的去除率始终比
 溶液的大,原因是
溶液的大,原因是③随着电流强度的增大,电解NaCl溶液时NO去除率下降的原因是
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
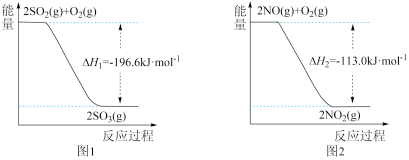
(1)NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO,已知下列两反应过程中能量变化如图1、图2所示,则NO2氧化SO2生成SO3(g)的热化学方程式为____ 。
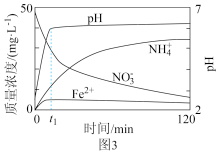
(2)在氮气保护下,在实验室中用足量的Fe粉还原KNO3溶液(pH =2.5)。反应过程中溶液中相关离子的质量浓度、pH随时间的变化曲线(部分副反应产物曲线略去)如图3所示。请根据图3中信息写出 min前反应的离子方程式
min前反应的离子方程式____ 。
(3)研究人员用活性炭对汽车尾气中的NO进行吸附,发生反应C(s) +2NO(g) N2(g) +CO2(g)
N2(g) +CO2(g)  H<0。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,反应相同时间时,测得NO的转化率
H<0。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,反应相同时间时,测得NO的转化率 (NO)随温度的变化如图4所示:
(NO)随温度的变化如图4所示:

①由图4可知,温度低于1 050 K时,NO的转化率随温度升高而增大,原因是__ ;温度为1050 K时CO2的平衡体积分数为__ 。
②对于反应C(s) +2NO(g) N2(g)+CO2(g)的反应体系,标准平衡常数
N2(g)+CO2(g)的反应体系,标准平衡常数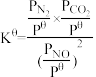 ,其中
,其中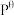 为标准压强(1×105Pa),
为标准压强(1×105Pa),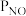 、
、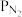 和
和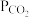 为各组分的平衡分压,如
为各组分的平衡分压,如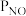 =
=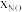 ·
·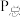 ,
,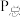 为平衡总压,
为平衡总压,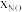 为平衡系统中 NO的物质的量分数。若NO的起始物质的量为1 mol,假设反应在恒定温度和标准压强下进行,NO的平衡转化率为
为平衡系统中 NO的物质的量分数。若NO的起始物质的量为1 mol,假设反应在恒定温度和标准压强下进行,NO的平衡转化率为 ,则
,则 =
=__ (用含 的最简式表示)。
的最简式表示)。
(4)利用现代手持技术传感器探究压强对2NO2 (g) N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在
N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在 s、
s、 s时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图5所示。
s时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图5所示。
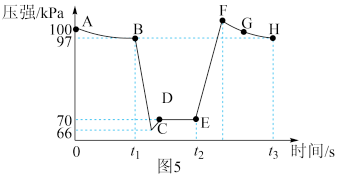
①B、E两点对应的正反应速率大小为
__ (填“ > ”“ < ”或“ =”)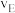 。
。
②E、F、G、H四点对应气体的平均相对分子质量最大的点为__ 。
(1)NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO,已知下列两反应过程中能量变化如图1、图2所示,则NO2氧化SO2生成SO3(g)的热化学方程式为


(2)在氮气保护下,在实验室中用足量的Fe粉还原KNO3溶液(pH =2.5)。反应过程中溶液中相关离子的质量浓度、pH随时间的变化曲线(部分副反应产物曲线略去)如图3所示。请根据图3中信息写出
 min前反应的离子方程式
min前反应的离子方程式(3)研究人员用活性炭对汽车尾气中的NO进行吸附,发生反应C(s) +2NO(g)
 N2(g) +CO2(g)
N2(g) +CO2(g)  H<0。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,反应相同时间时,测得NO的转化率
H<0。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,反应相同时间时,测得NO的转化率 (NO)随温度的变化如图4所示:
(NO)随温度的变化如图4所示:
①由图4可知,温度低于1 050 K时,NO的转化率随温度升高而增大,原因是
②对于反应C(s) +2NO(g)
 N2(g)+CO2(g)的反应体系,标准平衡常数
N2(g)+CO2(g)的反应体系,标准平衡常数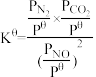 ,其中
,其中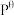 为标准压强(1×105Pa),
为标准压强(1×105Pa),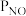 、
、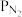 和
和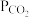 为各组分的平衡分压,如
为各组分的平衡分压,如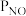 =
=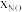 ·
·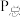 ,
,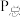 为平衡总压,
为平衡总压,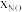 为平衡系统中 NO的物质的量分数。若NO的起始物质的量为1 mol,假设反应在恒定温度和标准压强下进行,NO的平衡转化率为
为平衡系统中 NO的物质的量分数。若NO的起始物质的量为1 mol,假设反应在恒定温度和标准压强下进行,NO的平衡转化率为 ,则
,则 =
= 的最简式表示)。
的最简式表示)。(4)利用现代手持技术传感器探究压强对2NO2 (g)
 N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在
N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在 s、
s、 s时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图5所示。
s时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图5所示。
①B、E两点对应的正反应速率大小为

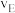 。
。②E、F、G、H四点对应气体的平均相对分子质量最大的点为
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】以 为原料制备甲烷、甲醇等能源物质具有较好的发展前景。回答下列问题:
为原料制备甲烷、甲醇等能源物质具有较好的发展前景。回答下列问题:
(1) 在固体催化表面加氢合成甲烷过程中发生以下两个反应:
在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应: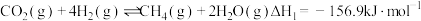
副反应: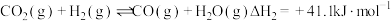
①已知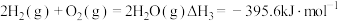 ,则
,则 燃烧的热化学方程式
燃烧的热化学方程式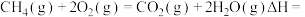
_______  。
。
②对于主反应,在一定条件下存在: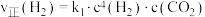 或
或 ,相应的速率与温度关系如图所示。
,相应的速率与温度关系如图所示。
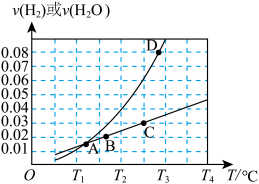
则主反应的平衡常数
_______ (用含 的代数式表示);图中
的代数式表示);图中 四个点中,能表示反应已达到平衡状态的是
四个点中,能表示反应已达到平衡状态的是_______ 。
(2)某研究小组采用双合金团簇催化甲烷干法重整法(DRM)取得了良好的效果。通过大量的研究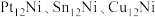 三种双金属合金团簇可用于催化
三种双金属合金团簇可用于催化 反应,在催化剂表面涉及多个基元反应,分别为过程1:甲烷逐步脱氢,过程2:
反应,在催化剂表面涉及多个基元反应,分别为过程1:甲烷逐步脱氢,过程2: 的活化(包括直接活化和氢诱导活化),过程3:
的活化(包括直接活化和氢诱导活化),过程3: 和
和 的氧化,过程4:扩散吸附反应。其反应机理如图所示。
的氧化,过程4:扩散吸附反应。其反应机理如图所示。
则过程3的最终产物为_______ ,过程4发生扩散吸附反应的微粒为_______ 。
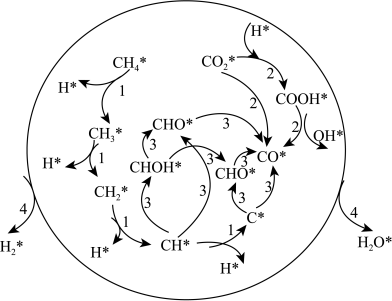
(3)光催化 制甲醇技术也是研究热点。铜基纳米光催化材料还原
制甲醇技术也是研究热点。铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。
,具有强氧化性)。
光催化原理与电解原理类似,写出高能导带的电极反应式:_______ 。太阳光激发下,在导带和价带中除了产生电子和空穴外,还会生成_______ (填写微粒名称)参与 的还原再生。
的还原再生。
 为原料制备甲烷、甲醇等能源物质具有较好的发展前景。回答下列问题:
为原料制备甲烷、甲醇等能源物质具有较好的发展前景。回答下列问题:(1)
 在固体催化表面加氢合成甲烷过程中发生以下两个反应:
在固体催化表面加氢合成甲烷过程中发生以下两个反应:主反应:
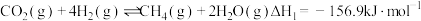
副反应:
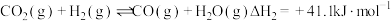
①已知
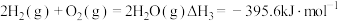 ,则
,则 燃烧的热化学方程式
燃烧的热化学方程式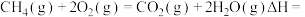
 。
。②对于主反应,在一定条件下存在:
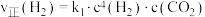 或
或 ,相应的速率与温度关系如图所示。
,相应的速率与温度关系如图所示。
则主反应的平衡常数

 的代数式表示);图中
的代数式表示);图中 四个点中,能表示反应已达到平衡状态的是
四个点中,能表示反应已达到平衡状态的是(2)某研究小组采用双合金团簇催化甲烷干法重整法(DRM)取得了良好的效果。通过大量的研究
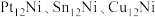 三种双金属合金团簇可用于催化
三种双金属合金团簇可用于催化 反应,在催化剂表面涉及多个基元反应,分别为过程1:甲烷逐步脱氢,过程2:
反应,在催化剂表面涉及多个基元反应,分别为过程1:甲烷逐步脱氢,过程2: 的活化(包括直接活化和氢诱导活化),过程3:
的活化(包括直接活化和氢诱导活化),过程3: 和
和 的氧化,过程4:扩散吸附反应。其反应机理如图所示。
的氧化,过程4:扩散吸附反应。其反应机理如图所示。
则过程3的最终产物为
(3)光催化
 制甲醇技术也是研究热点。铜基纳米光催化材料还原
制甲醇技术也是研究热点。铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。
,具有强氧化性)。
光催化原理与电解原理类似,写出高能导带的电极反应式:
 的还原再生。
的还原再生。
您最近半年使用:0次
【推荐1】甲酸是一种有机化工原料,广泛用于农药、皮革、医药和橡胶等工业。请回答:
(1)活性Fe3O4-x催化反应 ,进而可制得甲酸。该反应的
,进而可制得甲酸。该反应的
_______ 0(填“>”或“<”),理由是_______ 。
(2)某温度下,HCOOH电离平衡常数为 ,当HCOOH平衡浓度为xmol/L时,HCOOH已电离的弱电解质分子数的电离度
,当HCOOH平衡浓度为xmol/L时,HCOOH已电离的弱电解质分子数的电离度
_______ (电离度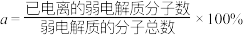 ,用含
,用含 和x的代数式表示,可不化简)。
和x的代数式表示,可不化简)。
(3)某研究小组发现HCOOH水溶液在密封石英管中的分解反应如下:
Ⅰ.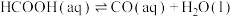
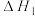
Ⅱ.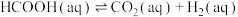
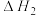
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。T℃下,在密封石英管内完全充满1.0mol/LHCOOH水溶液,分解产物均完全溶于水中。CO2、CO浓度与反应时间的变化关系如图所示。_______ 。
A.反应Ⅰ活化能小于反应Ⅱ
B.反应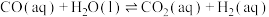
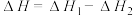
C.混合体系达平衡后: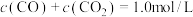
D.若在起始溶液中加入盐酸,则CO达浓度峰值时,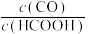 的值与未加盐酸时相同
的值与未加盐酸时相同
②保持其它条件不变,若反应起始时溶液中同时还含有0.10mol/L盐酸,请在上图中画出CO的浓度与反应时间的变化关系图_______ 。
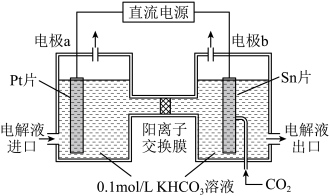
(4)一种由CO2电化学法合成甲酸盐的工作原理如图所示。电极b为_______ 极。电解一段时间后,若两侧电解液中K+的物质的量相差0.08mol,则阳极产生的气体在标准状况下的总体积为_______ L(假设产生的气体全部逸出)。
(1)活性Fe3O4-x催化反应
 ,进而可制得甲酸。该反应的
,进而可制得甲酸。该反应的
(2)某温度下,HCOOH电离平衡常数为
 ,当HCOOH平衡浓度为xmol/L时,HCOOH已电离的弱电解质分子数的电离度
,当HCOOH平衡浓度为xmol/L时,HCOOH已电离的弱电解质分子数的电离度
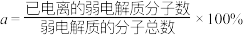 ,用含
,用含 和x的代数式表示,可不化简)。
和x的代数式表示,可不化简)。(3)某研究小组发现HCOOH水溶液在密封石英管中的分解反应如下:
Ⅰ.
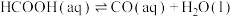
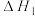
Ⅱ.
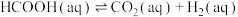
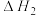
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。T℃下,在密封石英管内完全充满1.0mol/LHCOOH水溶液,分解产物均完全溶于水中。CO2、CO浓度与反应时间的变化关系如图所示。
A.反应Ⅰ活化能小于反应Ⅱ
B.反应
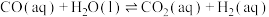
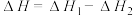
C.混合体系达平衡后:
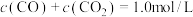
D.若在起始溶液中加入盐酸,则CO达浓度峰值时,
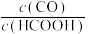 的值与未加盐酸时相同
的值与未加盐酸时相同②保持其它条件不变,若反应起始时溶液中同时还含有0.10mol/L盐酸,请在上图中画出CO的浓度与反应时间的变化关系图
(4)一种由CO2电化学法合成甲酸盐的工作原理如图所示。电极b为
您最近半年使用:0次
【推荐2】二氧化碳催化加氢合成乙烯在环境保护、资源利用、战略需求等方面具有重要意义。 CO2和H2 在铁系催化剂作用下发生化学反应:
I.2CO2(g)+6H2(g) C2H4(g)+4H2O(g)ΔH1
C2H4(g)+4H2O(g)ΔH1
II.CO2(g)+H2(g) CO(g)+H2O(g)ΔH2>0
CO(g)+H2O(g)ΔH2>0
请回答下列问题:
(1)反应I能自发进行,则 ΔH1___ 0(填“<”或“>”或“=”);该反应自发进行的条件是______ 。
(2)在密闭容器中通入1mol CO2和3molH2,在铁系催化剂作用下进行反应,CO2的平衡转化率随温度和压强的变化如图所示。
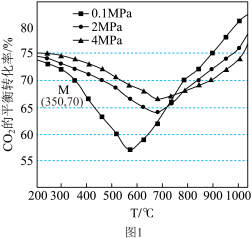
①下列说法正确的是____
A.由图1可知:0.1MPa下,200℃~550℃时以反应I为主,550℃以后以反应II为主
B.反应II化学方程式前后物质的化学计量数之和相等,所以反应II的ΔS等于零
C.恒温恒压下,容器内气体的密度不变时,说明反应已达平衡
D.其他条件不变,将CO2和H2的初始物质的量比改变为2:3,可提高CO2平衡转化率
②图1中点M(350,70)、此时乙烯的选择性为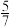 (选择性:转化的CO2中生成C2H4和CO的百分比)。计算该温度时:反应II的平衡常数Kc =
(选择性:转化的CO2中生成C2H4和CO的百分比)。计算该温度时:反应II的平衡常数Kc =_____ 。
③在图1中,温度大于800℃时,随着压强的增大,CO2的平衡转化率减小,请解释原因____ 。
(3)有研究表明,在铁系催化剂作用下反应I分两步进行:
i CO2(g)+H2(g) CO(g)+H2O(g)慢
CO(g)+H2O(g)慢
ii 2CO(g)+4H2(g) C2H4 (g)+2H2O(g)快
C2H4 (g)+2H2O(g)快
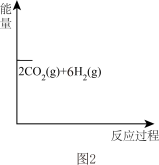
在图2中画出反应I分两步进行的“能量−反应过程图”。起点从[2CO2(g)+6H2(g)]开始____ 。
I.2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)ΔH1
C2H4(g)+4H2O(g)ΔH1 II.CO2(g)+H2(g)
 CO(g)+H2O(g)ΔH2>0
CO(g)+H2O(g)ΔH2>0 请回答下列问题:
(1)反应I能自发进行,则 ΔH1
(2)在密闭容器中通入1mol CO2和3molH2,在铁系催化剂作用下进行反应,CO2的平衡转化率随温度和压强的变化如图所示。

①下列说法正确的是
A.由图1可知:0.1MPa下,200℃~550℃时以反应I为主,550℃以后以反应II为主
B.反应II化学方程式前后物质的化学计量数之和相等,所以反应II的ΔS等于零
C.恒温恒压下,容器内气体的密度不变时,说明反应已达平衡
D.其他条件不变,将CO2和H2的初始物质的量比改变为2:3,可提高CO2平衡转化率
②图1中点M(350,70)、此时乙烯的选择性为
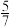 (选择性:转化的CO2中生成C2H4和CO的百分比)。计算该温度时:反应II的平衡常数Kc =
(选择性:转化的CO2中生成C2H4和CO的百分比)。计算该温度时:反应II的平衡常数Kc =③在图1中,温度大于800℃时,随着压强的增大,CO2的平衡转化率减小,请解释原因
(3)有研究表明,在铁系催化剂作用下反应I分两步进行:
i CO2(g)+H2(g)
 CO(g)+H2O(g)慢
CO(g)+H2O(g)慢 ii 2CO(g)+4H2(g)
 C2H4 (g)+2H2O(g)快
C2H4 (g)+2H2O(g)快在图2中画出反应I分两步进行的“能量−反应过程图”。起点从[2CO2(g)+6H2(g)]开始

您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】Ⅰ.工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,反应为N2 (g)+3H2(g) 2NH3(g) △H =−92.4kJ·mol−1, △S=−200J·mol−1·K−1。请回答下列问题:
2NH3(g) △H =−92.4kJ·mol−1, △S=−200J·mol−1·K−1。请回答下列问题:
(1)常温下,合成氨反应________ (填“能”或“不能”)自发进行,其平衡常数表达式K=_______ 。
(2)______ 温(填“高”或“低”)有利于提高反应速率,______ 温(填“高”或“低”)有利于提高平衡转化率,综合考虑催化剂活性等因素,工业常采用400~500℃。
(3)针对反应速率与平衡产率的矛盾,我国科学家提出了解决方案:双温—双控—双催化剂。使用Fe-TiO2∙xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,Fe的温度为 547℃,而TiO2∙xHy的温度为415℃)。

该方案的优势:___________ 。
Ⅱ.合成氨工艺可以进一步优化,实现尿素的合成,简易流程图如下:
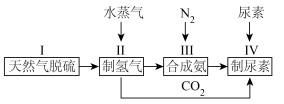
(4)步骤Ⅱ中制氢气原理如下:CH4(g)+H2O(g) CO(g)+3H2(g) ,CO(g)+H2O(g)
CO(g)+3H2(g) ,CO(g)+H2O(g) CO2(g)+H2(g),恒容容器中,对于以上反应,能加快反应速率的是___________。
CO2(g)+H2(g),恒容容器中,对于以上反应,能加快反应速率的是___________。
(5)已知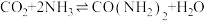 ,若合成尿素的流程中转化率为 80%时,100吨甲烷为原料能够合成
,若合成尿素的流程中转化率为 80%时,100吨甲烷为原料能够合成___________ 吨尿素。
Ⅲ.盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与 NH4Cl类似。
(6)写出盐酸肼第一步水解反应的离子方程式___________ 。
(7)盐酸肼水溶液中离子浓度的排列顺序正确的是___________。
 2NH3(g) △H =−92.4kJ·mol−1, △S=−200J·mol−1·K−1。请回答下列问题:
2NH3(g) △H =−92.4kJ·mol−1, △S=−200J·mol−1·K−1。请回答下列问题:(1)常温下,合成氨反应
(2)
(3)针对反应速率与平衡产率的矛盾,我国科学家提出了解决方案:双温—双控—双催化剂。使用Fe-TiO2∙xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,Fe的温度为 547℃,而TiO2∙xHy的温度为415℃)。

该方案的优势:
Ⅱ.合成氨工艺可以进一步优化,实现尿素的合成,简易流程图如下:

(4)步骤Ⅱ中制氢气原理如下:CH4(g)+H2O(g)
 CO(g)+3H2(g) ,CO(g)+H2O(g)
CO(g)+3H2(g) ,CO(g)+H2O(g) CO2(g)+H2(g),恒容容器中,对于以上反应,能加快反应速率的是___________。
CO2(g)+H2(g),恒容容器中,对于以上反应,能加快反应速率的是___________。| A.升高温度 | B.充入 He | C.加入催化剂 | D.降低压强 |
(5)已知
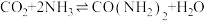 ,若合成尿素的流程中转化率为 80%时,100吨甲烷为原料能够合成
,若合成尿素的流程中转化率为 80%时,100吨甲烷为原料能够合成Ⅲ.盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与 NH4Cl类似。
(6)写出盐酸肼第一步水解反应的离子方程式
(7)盐酸肼水溶液中离子浓度的排列顺序正确的是___________。
A.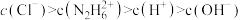 |
B.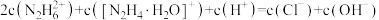 |
C.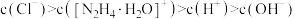 |
D.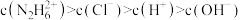 |
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】Ⅰ.在某温度(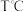 )的水溶液中,
)的水溶液中,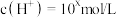 ,
,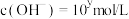 ,x与y关系如图所示。
,x与y关系如图所示。
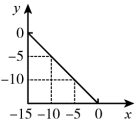
(1)该温度下,水的离子积为_______ ,
_______ 25℃(填“大于”“小于”或“等于”)。
(2)将此温度下 的
的 溶液与
溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的 约为
约为_______ (已知 )。
)。
Ⅱ. 俗称砒霜,可作长效杀虫剂、杀菌剂和除草剂,在医疗上还可用于治疗急性白血病.测定某
俗称砒霜,可作长效杀虫剂、杀菌剂和除草剂,在医疗上还可用于治疗急性白血病.测定某 粗产品(含
粗产品(含 杂质)中
杂质)中 的质量分数实验过程如下:
的质量分数实验过程如下:
①称取0.2g粗产品完全溶解于适量的 溶液后,配制成含
溶液后,配制成含 、
、 的混合溶液100mL。
的混合溶液100mL。
②分别移取25.00mL上述溶液于锥形瓶中,用 的
的 标准溶液进行滴定(在碱性环境中
标准溶液进行滴定(在碱性环境中 可将
可将 氧化为
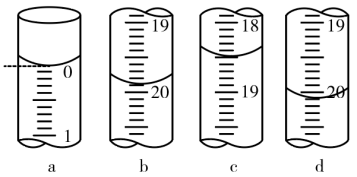
氧化为 ,指示剂为淀粉).每次滴定开始时液面读数如图a所示,3次滴定结束时,
,指示剂为淀粉).每次滴定开始时液面读数如图a所示,3次滴定结束时, 标准溶液液面读数如图b~d所示。
标准溶液液面读数如图b~d所示。
回答下列问题:
(3)配制成含 、
、 的的混合溶液时用到的定量仪器为
的的混合溶液时用到的定量仪器为_______ 。
(4)滴定时将 标准溶液装在如图中的
标准溶液装在如图中的_______ (填“甲”或“乙”)滴定管中。
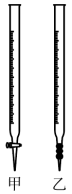
(5)滴定终点的现象是_______ 。
(6)碱性环境中 将
将 氧化为
氧化为 的离子方程式是
的离子方程式是_______ 。
(7)粗产品中 的质量分数为
的质量分数为_______ 。若测定结果偏高,其原因可能是_______ (填字母)
A滴定管用蒸馏水洗净后未用标准溶液润洗
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水清洗后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
 )的水溶液中,
)的水溶液中, ,
, ,x与y关系如图所示。
,x与y关系如图所示。
(1)该温度下,水的离子积为
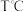
(2)将此温度下
 的
的 溶液与
溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的 约为
约为 )。
)。Ⅱ.
 俗称砒霜,可作长效杀虫剂、杀菌剂和除草剂,在医疗上还可用于治疗急性白血病.测定某
俗称砒霜,可作长效杀虫剂、杀菌剂和除草剂,在医疗上还可用于治疗急性白血病.测定某 粗产品(含
粗产品(含 杂质)中
杂质)中 的质量分数实验过程如下:
的质量分数实验过程如下:①称取0.2g粗产品完全溶解于适量的
 溶液后,配制成含
溶液后,配制成含 、
、 的混合溶液100mL。
的混合溶液100mL。②分别移取25.00mL上述溶液于锥形瓶中,用
 的
的 标准溶液进行滴定(在碱性环境中
标准溶液进行滴定(在碱性环境中 可将
可将 氧化为
氧化为 ,指示剂为淀粉).每次滴定开始时液面读数如图a所示,3次滴定结束时,
,指示剂为淀粉).每次滴定开始时液面读数如图a所示,3次滴定结束时, 标准溶液液面读数如图b~d所示。
标准溶液液面读数如图b~d所示。
回答下列问题:
(3)配制成含
 、
、 的的混合溶液时用到的定量仪器为
的的混合溶液时用到的定量仪器为(4)滴定时将
 标准溶液装在如图中的
标准溶液装在如图中的
(5)滴定终点的现象是
(6)碱性环境中
 将
将 氧化为
氧化为 的离子方程式是
的离子方程式是(7)粗产品中
 的质量分数为
的质量分数为A滴定管用蒸馏水洗净后未用标准溶液润洗
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水清洗后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】苯乙腈主要用于有机合成及生产医药,农药的中间体,对环境有危害。常温常压下,苯乙腈水解一般需加入酸碱催化剂。但研究人员发现,在近临界水(指温度在523~623K之间的压缩液态水)中,不加任何催化剂的情况下,苯乙腈就能发生水解反应生成苯乙酞胺:
C6H5CH2CN(l)+H2O(l) C6H5CH2CONH2(l) △H
C6H5CH2CONH2(l) △H
(苯乙腈) (苯乙酰胺)
请回答下列问题:
(1)已知近临界水中,水的离子积常数为10-10,则此条件下,pH=7的NaAc溶液中由水电离的c(H+)=________ mol·L-1。该反应不加任何催化剂就能发生的主要原因是___________ 。
(2)研究反应的平衡常数(记作lgK)与温度(T)的关系,得到如图1所示的关系,判断该反应的△H__________ 0(填“>”“<”或“=”)。
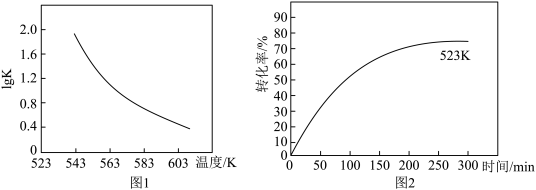
(3)图2表示其他条件不变时,温度和时间对苯乙腈转化率的影响曲线图(不完整)。若图中曲线对应的温度为523K,请你在原图中作出温度为583K的影响曲线。___________ 。
(4)下列哪种仪器可用于分析水解反应过程中苯乙腈浓度的变化_________ (填编号)。
A.元素分析仪B.核磁共振仪C.原子吸收光谱仪D.分光光度计
(5)科学家还在近临界水中分别添加CO2、NH3,研究后得到了如下的图示:
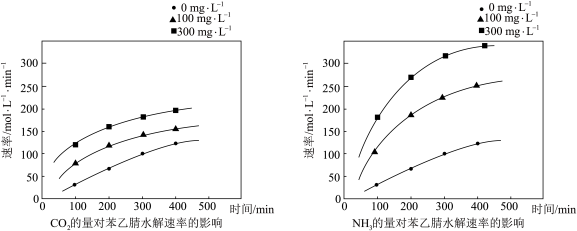
从中你可以得出什么结论(至少写出2点___________ 。
(6)水的用途很广,可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。
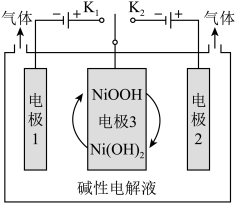
①制H2时,连接______________ ,可得H2。
②改变开关连接方式,产生O2的电极反应式__________________________ 。
③选用NiOOH、Ni(OH)2作为电极3材料的优点(请结合电极反应式进行阐述)___________ 。
C6H5CH2CN(l)+H2O(l)
 C6H5CH2CONH2(l) △H
C6H5CH2CONH2(l) △H(苯乙腈) (苯乙酰胺)
请回答下列问题:
(1)已知近临界水中,水的离子积常数为10-10,则此条件下,pH=7的NaAc溶液中由水电离的c(H+)=
(2)研究反应的平衡常数(记作lgK)与温度(T)的关系,得到如图1所示的关系,判断该反应的△H

(3)图2表示其他条件不变时,温度和时间对苯乙腈转化率的影响曲线图(不完整)。若图中曲线对应的温度为523K,请你在原图中作出温度为583K的影响曲线。
(4)下列哪种仪器可用于分析水解反应过程中苯乙腈浓度的变化
A.元素分析仪B.核磁共振仪C.原子吸收光谱仪D.分光光度计
(5)科学家还在近临界水中分别添加CO2、NH3,研究后得到了如下的图示:

从中你可以得出什么结论(至少写出2点
(6)水的用途很广,可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。

①制H2时,连接
②改变开关连接方式,产生O2的电极反应式
③选用NiOOH、Ni(OH)2作为电极3材料的优点(请结合电极反应式进行阐述)
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】酸、碱、盐的水溶液在生产生活及化学实验中有广泛的应用,请同学们运用所学知识解决下列问题。
(1)某温度 T 下,0.1mol/L 的 NaOH 溶液中,c(H+)=1.0×10- 11mol/L,此时水的离子积常数 Kw=_______ 。温度 T_______ 25℃(填“大于”“小于”或“等于”) ,原因是_______ 。
(2)已知水溶液中 c(H+)和 c(OH-)的关系如图所示:
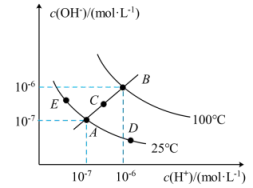
①图中 A 、B 、C 、D 四点对应的水的离子积常数由大到小的顺序是_______ 。
②若 A 点到 E 点,可采用的措施是_______ (填序号,下同);从 A 点到 C 点,可采用的措 施是_______ ;促进水的电离平衡的措施是_______ 。(以上填序号)
a.升温 b.加入少量的盐酸 c.加入少量的 NaOH
(3)常温下 0. 1mol/L 的 HA 溶液中,c(H+)=0.001mol/L ,写出 HA 的电离方程式_______ ,水 电离的 c(H+)=_______ mol/L。为使 HA 溶液中 HA 的电离平衡正向移动,而水的 Kw 保持不 变可以采取的措施是_______ 。
(1)某温度 T 下,0.1mol/L 的 NaOH 溶液中,c(H+)=1.0×10- 11mol/L,此时水的离子积常数 Kw=
(2)已知水溶液中 c(H+)和 c(OH-)的关系如图所示:

①图中 A 、B 、C 、D 四点对应的水的离子积常数由大到小的顺序是
②若 A 点到 E 点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的 NaOH
(3)常温下 0. 1mol/L 的 HA 溶液中,c(H+)=0.001mol/L ,写出 HA 的电离方程式
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】(1)以黄铜矿冶炼金属铜的过程中发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是
6Cu+SO2↑,反应的氧化剂是_____________________ 。
(2) 黄铜矿熔炼后得到的粗铜含少量Fe、Zn、Ag、Au等金属杂质,需进一步采用电解法精制。在电解精炼铜时,电解液中除了硫酸铜外,往往再加入一些硫酸,其作用是_____________________ 。
(3)在精炼铜的过程中,电解液中c(Cu2+)逐渐下降,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。下表为几种物质的溶度积。
某同学设计了如下除杂方案:
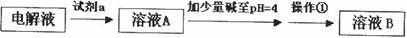
试剂a是__________ ,其目的是____________________________________ ;根据溶度积该方案能够除去的杂质金属阳离子是______ 。操作①用到的玻璃仪器是____________ 。
(4)工业上通常用FeS除去废水中的Cu2+,写出该沉淀转化离子方程式_____________
 6Cu+SO2↑,反应的氧化剂是
6Cu+SO2↑,反应的氧化剂是(2) 黄铜矿熔炼后得到的粗铜含少量Fe、Zn、Ag、Au等金属杂质,需进一步采用电解法精制。在电解精炼铜时,电解液中除了硫酸铜外,往往再加入一些硫酸,其作用是
(3)在精炼铜的过程中,电解液中c(Cu2+)逐渐下降,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。下表为几种物质的溶度积。
| 物质 |  |  |  |  |
溶度积 |  | 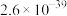 | 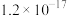 | 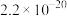 |
某同学设计了如下除杂方案:
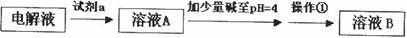
试剂a是
(4)工业上通常用FeS除去废水中的Cu2+,写出该沉淀转化离子方程式
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】I.大气中CO2含量的增多会导致地球表面温度升高及海洋生态环境改变。
已知:CO2(g)+CaO(s) CaCO3 (s)
CaCO3 (s)
(1) 某研究小组在实验室探究不同温度对CaO吸收CO2效率的影响。在体积相同的密闭容器中,均充入一定量的生石灰和足量CO2,在不同温度下,保持其它初始实验条件不变,发生如上平衡分别在t秒时测定CO2的浓度(mol/L) 如图。
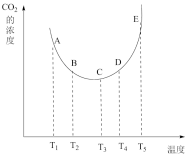
①该反应在_______ 条件下能自发进行。
A.较高温度 B.较低温度 C.任何温度 D.任何温度下均不能
②A、B、C、D、E五点中,达到化学平衡状态的点是_______ 。
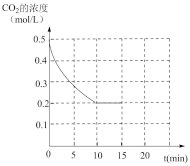
(2)在恒定温度下,一个体积固定为1L的容器中加入20gCaO和一定量的CO2气体,在10分钟达平衡的过程中CO2浓度变化如图所示,为提高CO2的吸收率,下列可以采取的措施有_______ 。
A.缩小反应容器的容积 B.升高温度
C.平衡体系中及时分离出部分CaCO3 D.使用合适的催化剂
若保持平衡时的温度不变,15分钟时将体积迅速增大至2L,在20分钟时重新达到平衡,请在下图中补充体积变化后CO2浓度变化示意图_______ 。
Ⅱ.在容积可变的密闭容器中发生反应:mA(g)+nB(g) pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
(3)当压强为1×106Pa时,此反应的平衡常数表达式:_______ 。
(4)电浮选凝聚法是工业上采用的一种污水处理方法,右图是该方法处理污水的实验装置示意图,实验过程中,污水的pH始终保持在5.0-6.0之间。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用。

阳极区生成沉淀的总电极反应为:_______ 。
已知:CO2(g)+CaO(s)
 CaCO3 (s)
CaCO3 (s)(1) 某研究小组在实验室探究不同温度对CaO吸收CO2效率的影响。在体积相同的密闭容器中,均充入一定量的生石灰和足量CO2,在不同温度下,保持其它初始实验条件不变,发生如上平衡分别在t秒时测定CO2的浓度(mol/L) 如图。

①该反应在
A.较高温度 B.较低温度 C.任何温度 D.任何温度下均不能
②A、B、C、D、E五点中,达到化学平衡状态的点是
(2)在恒定温度下,一个体积固定为1L的容器中加入20gCaO和一定量的CO2气体,在10分钟达平衡的过程中CO2浓度变化如图所示,为提高CO2的吸收率,下列可以采取的措施有
A.缩小反应容器的容积 B.升高温度
C.平衡体系中及时分离出部分CaCO3 D.使用合适的催化剂
若保持平衡时的温度不变,15分钟时将体积迅速增大至2L,在20分钟时重新达到平衡,请在下图中补充体积变化后CO2浓度变化示意图

Ⅱ.在容积可变的密闭容器中发生反应:mA(g)+nB(g)
 pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)mol·L-1 | 0.08 | 0.20 | 0.44 |
(4)电浮选凝聚法是工业上采用的一种污水处理方法,右图是该方法处理污水的实验装置示意图,实验过程中,污水的pH始终保持在5.0-6.0之间。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用。

阳极区生成沉淀的总电极反应为:
您最近半年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】A~J 是中学化学常见的物质,它们之间的转化关系如下图所示 (部分反应条件、生成物已省略)。已知A是一种高熔点物质,D是一种红棕色固体。
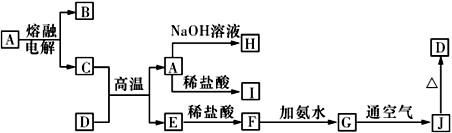
请回答下列问题:
(1)电解A物质的阴极电极反应式为________ ,C 与D在高温下反应,引发该反应需要加入的两种试剂是________________________ (填名称)。
(2)写出G→J 反应的实验现象与化学方程式:____________________________ ,________________________________ 。
(3)C 与NaOH溶液反应的离子方程式为________________________________ 。

请回答下列问题:
(1)电解A物质的阴极电极反应式为
(2)写出G→J 反应的实验现象与化学方程式:
(3)C 与NaOH溶液反应的离子方程式为
您最近半年使用:0次



