重铬酸铵[(NH4)2Cr2O7]可用作媒染剂和有机合成催化剂,具有强氧化性。实验室中将NH3通入重铬酸(H2Cr2O7)溶液制备(NH4)2Cr2O7的装置如图所示(夹持装置略)。回答下列问题:

已知:Cr2O +H2O
+H2O 2CrO
2CrO +2H+。
+2H+。
(1)仪器a的名称是_______ ,b 处的作用为_______ ;实验时控制三颈烧瓶内溶液pH约为4,pH不宜过大的原因是_______ ;A 装置的作用为_______ 。
(2)利用甲醛法测定市售(NH4)2Cr2O7的质量分数(杂质不参与反应),实验步骤如下:
①称取产物m g,配成500mL溶液,用_______ (填“酸式”或“碱式”)滴定管 移取25.00 mL 样品溶液于250mL锥形瓶中。加入BaCl2溶液使Cr2O 完全沉淀,反应原理为2Ba2++Cr2O
完全沉淀,反应原理为2Ba2++Cr2O +H2O=2BaCrO4↓+2H+。若滴定管规格为50.00 mL,样品溶液起始读数为5.00 mL,此时滴定管中样品溶液的实际体积为
+H2O=2BaCrO4↓+2H+。若滴定管规格为50.00 mL,样品溶液起始读数为5.00 mL,此时滴定管中样品溶液的实际体积为_______ (填标号)。
A.5.00 mL B.45.00 mL C.大于45.00 mL D.小于5.00 mL
②向锥形瓶中加入足量的甲醛溶液,反应原理为4NH +6HCHO=3H++6H2O+(CH2)6N4H+[与NaOH反应时,1mol(CH2)6N4H+与1molH+相当]。摇匀、静置5min后,加入1~2滴酚酞试液,用cmol·L-1NaOH标准溶液滴定至终点,消耗NaOH标准溶液的体积为VmL。滴定终点的现象为
+6HCHO=3H++6H2O+(CH2)6N4H+[与NaOH反应时,1mol(CH2)6N4H+与1molH+相当]。摇匀、静置5min后,加入1~2滴酚酞试液,用cmol·L-1NaOH标准溶液滴定至终点,消耗NaOH标准溶液的体积为VmL。滴定终点的现象为_______ ;所得产物中(NH4)2Cr2O7(摩尔质量为Mg·mol-1)的质量分数为_______ %;若滴定终点时仰视读数,则测定的质量分数将_______ (填“偏大”“偏小”或“不变”)。

已知:Cr2O
 +H2O
+H2O 2CrO
2CrO +2H+。
+2H+。(1)仪器a的名称是
(2)利用甲醛法测定市售(NH4)2Cr2O7的质量分数(杂质不参与反应),实验步骤如下:
①称取产物m g,配成500mL溶液,用
 完全沉淀,反应原理为2Ba2++Cr2O
完全沉淀,反应原理为2Ba2++Cr2O +H2O=2BaCrO4↓+2H+。若滴定管规格为50.00 mL,样品溶液起始读数为5.00 mL,此时滴定管中样品溶液的实际体积为
+H2O=2BaCrO4↓+2H+。若滴定管规格为50.00 mL,样品溶液起始读数为5.00 mL,此时滴定管中样品溶液的实际体积为A.5.00 mL B.45.00 mL C.大于45.00 mL D.小于5.00 mL
②向锥形瓶中加入足量的甲醛溶液,反应原理为4NH
 +6HCHO=3H++6H2O+(CH2)6N4H+[与NaOH反应时,1mol(CH2)6N4H+与1molH+相当]。摇匀、静置5min后,加入1~2滴酚酞试液,用cmol·L-1NaOH标准溶液滴定至终点,消耗NaOH标准溶液的体积为VmL。滴定终点的现象为
+6HCHO=3H++6H2O+(CH2)6N4H+[与NaOH反应时,1mol(CH2)6N4H+与1molH+相当]。摇匀、静置5min后,加入1~2滴酚酞试液,用cmol·L-1NaOH标准溶液滴定至终点,消耗NaOH标准溶液的体积为VmL。滴定终点的现象为
更新时间:2022-01-13 19:14:00
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】I.某学生用已知物质的量浓度的NaOH标准溶液来测定未知物质的量浓度的盐酸时,选择甲基橙作指示剂。请回答下列问题:
(1)配制480mL0.1000mol•L-1NaOH标准溶液。配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、_____ 、_____ 等。
(2)若滴定开始和结束时,碱式滴定管中的液面如图所示,所用NaOH标准溶液的体积为____ mL。
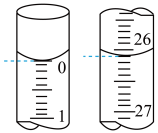
(3)下列有关本实验滴定说法不正确的是_____ 。

A.用酸式滴定管量取25.00mL稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水和几滴甲基橙试液后进行滴定
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液
E.碱式滴定管尖嘴部分有气泡,滴定后消失会造成测定结果偏高
F.根据突变范围指示剂最好选择甲基橙误差最小
(4)某学生根据3次实验分别记录有关数据如表所示:
依据表中数据计算,该盐酸溶液的物质的量浓度为_____ 。
II.氧化还原滴定实验与酸碱中和滴定类似。某学习小组用“间接硝量法”测定含有CuCl2•2H2O晶体试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应2Cu2++4I-=2CuI↓+I2。用0.1000mol/LNa2S2O3标准溶液滴定,I2+2S2O =S4O
=S4O +2I-,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
+2I-,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
(5)可选用_____ 作滴定指示剂,滴定终点的现象是_____ 。
(6)该试样中CuCl2•2H2O(M=171g/mol)的质量百分数为_____ 。
(1)配制480mL0.1000mol•L-1NaOH标准溶液。配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、
(2)若滴定开始和结束时,碱式滴定管中的液面如图所示,所用NaOH标准溶液的体积为

(3)下列有关本实验滴定说法不正确的是

A.用酸式滴定管量取25.00mL稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水和几滴甲基橙试液后进行滴定
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液
E.碱式滴定管尖嘴部分有气泡,滴定后消失会造成测定结果偏高
F.根据突变范围指示剂最好选择甲基橙误差最小
(4)某学生根据3次实验分别记录有关数据如表所示:
| 滴定次数 | 待测盐酸的体积/mL | 标准NaOH溶液体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 29.61 |
| 第三次 | 25.00 | 0.22 | 26.31 |
II.氧化还原滴定实验与酸碱中和滴定类似。某学习小组用“间接硝量法”测定含有CuCl2•2H2O晶体试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应2Cu2++4I-=2CuI↓+I2。用0.1000mol/LNa2S2O3标准溶液滴定,I2+2S2O
 =S4O
=S4O +2I-,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
+2I-,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。(5)可选用
(6)该试样中CuCl2•2H2O(M=171g/mol)的质量百分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
③向锥形瓶中滴入甲基橙作指示剂,进行滴定。到达滴定终点时测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
(1)滴定终点的判断方法是______________________________________________ 。
(2)有错误操作步骤有_______________ 。
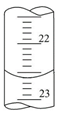
(3)如图,是某次滴定时的滴定管中的液面,其读数为___________ mL
(4)则待测烧碱溶液的浓度为___________ mol/L。
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
③向锥形瓶中滴入甲基橙作指示剂,进行滴定。到达滴定终点时测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
(1)滴定终点的判断方法是
(2)有错误操作步骤有
(3)如图,是某次滴定时的滴定管中的液面,其读数为

(4)则待测烧碱溶液的浓度为
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前度数(mL) | 滴定后度数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液。 用0.100mol/L硫酸滴定,写出该中和反应的热化学方程式_______ (中和热ΔH=-57.3 kJ/mol)。
(2)将该烧碱样品配成500mL待测溶液需要的玻璃仪器有_______ 。
(3)滴定过程中,眼睛应注视_______ ,若用酚酞作指示剂达到滴定终点颜色变化是_______ 。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是_______ mol/L,烧碱样品的纯度是_______ (保留小数点后两位)
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果_______ 。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果_______ 。
③酸式滴定管在装酸液前未用标准盐酸润洗2~3次_______ 。
④开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失_______ 。
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液。 用0.100mol/L硫酸滴定,写出该中和反应的热化学方程式
(2)将该烧碱样品配成500mL待测溶液需要的玻璃仪器有
(3)滴定过程中,眼睛应注视
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果
③酸式滴定管在装酸液前未用标准盐酸润洗2~3次
④开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】“烂板液”指的是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量Cl-、Fe3+)。某化学兴趣小组用“烂板液”制取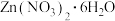 的过程如图:
的过程如图:
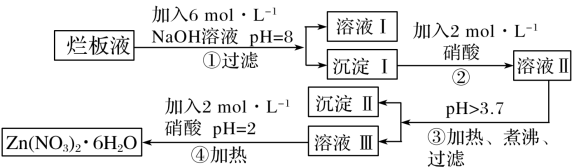
已知:Zn(NO3)2·6H2O是一种无色晶体,其水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂板液”中溶质的主要成分是_______ (填化学式)。
(2)在操作①中保持pH=8的目的是_______ 。
(3)沉淀I的主要成分是_______ (填化学式)。
(4)操作③中加热煮沸的目的是_______ 。
(5)操作④中加热所用的主要玻璃仪器有_______ 。
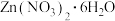 的过程如图:
的过程如图:
已知:Zn(NO3)2·6H2O是一种无色晶体,其水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂板液”中溶质的主要成分是
(2)在操作①中保持pH=8的目的是
(3)沉淀I的主要成分是
(4)操作③中加热煮沸的目的是
(5)操作④中加热所用的主要玻璃仪器有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】(CH3COO)2Mn·4H2O主要用于纺织染色催化剂和分析试剂,其制备过程如图。回答下列问题:
步骤一:以MnO2为原料制备MnSO4
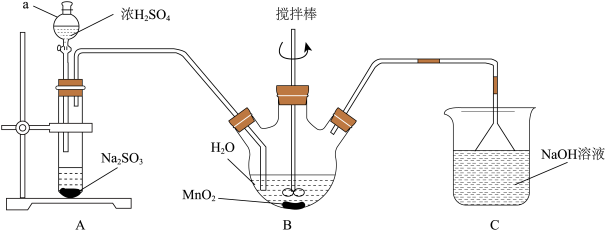
(1)仪器a的名称是___ ,C装置中NaOH溶液的作用是___________ 。
(2)B装置中发生反应的化学方程式是___________ 。
步骤二:制备MnCO3沉淀
充分反应后将B装置中的混合物过滤,向滤液中加入饱和NH4HCO3溶液,反应生成MnCO3沉淀。过滤,洗涤,干燥。
(3)①生成MnCO3的离子方程式_____________ 。
②判断沉淀已洗净的操作和现象是___________ 。
步骤三:制备(CH3COO)2Mn·4H2O固体
向11.5 g MnCO3固体中加入醋酸水溶液,反应一段时间后,过滤、洗涤,控制温度不超过55℃干燥,得(CH3COO)2Mn·4H2O固体。探究生成(CH3COO)2Mn·4H2O最佳实验条件的数据如下:
(4)产品干燥温度不宜超过55℃的原因可能是___________ 。
(5)上述实验探究了___________ 和___________ 对产品质量的影响,实验l中(CH3COO)2Mn·4H2O产率为___________ 。
步骤一:以MnO2为原料制备MnSO4

(1)仪器a的名称是
(2)B装置中发生反应的化学方程式是
步骤二:制备MnCO3沉淀
充分反应后将B装置中的混合物过滤,向滤液中加入饱和NH4HCO3溶液,反应生成MnCO3沉淀。过滤,洗涤,干燥。
(3)①生成MnCO3的离子方程式
②判断沉淀已洗净的操作和现象是
步骤三:制备(CH3COO)2Mn·4H2O固体
向11.5 g MnCO3固体中加入醋酸水溶液,反应一段时间后,过滤、洗涤,控制温度不超过55℃干燥,得(CH3COO)2Mn·4H2O固体。探究生成(CH3COO)2Mn·4H2O最佳实验条件的数据如下:
| 实验组别 | 醋酸质量分数 | 温度/℃ | 产品质量/g |
| 1 | 3% | 50 | 22.05 |
| 2 | 3% | 60 | 22.24 |
| 3 | 4% | 50 | 22.13 |
| 4 | 4$ | 60 | 23.27 |
(5)上述实验探究了
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】铋酸钠(NaBiO3)是分析化学中的重要试剂,在水中缓慢分解,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
I.制取铋酸钠。制取装置如图(加热和夹持仪器已略去),部分物质性质如下:

(1)装二氧化锰的仪器名称是_______ ,B装置的作用是_______ 。
(2)C中盛放Bi(OH)3与NaOH的混合物,与Cl2反应生成NaBiO3,反应的化学方程式为:_______ 。
(3)当观察到C中_______ (填现象)时,可以初步判断C中反应已经完成。
(4)拆除装置前必须先除去残留的Cl2,以免污染空气。除去烧瓶A中残留Cl2的操作是:关闭_______ ,打开_______ (填K1、 K2或K3)。
(5)反应结束后,为从装置C中获得尽可能多的产品,需要的操作是_______ 、过滤、 洗涤、干燥。
II.铋酸钠的应用——检验Mn2+
(6)往待检液中加入铋酸钠晶体,加硫酸酸化,生成Bi3+,且溶液变为紫红色,证明待检液中存在Mn2+,产生紫红色现象的离子方程式为_______ 。
III.产品纯度的测定
(7)取上述NaBiO3产品wg,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用a mol·L-1的H2C2O4标准溶液滴定生成的 (已知: 5H2C2O4+ 2
(已知: 5H2C2O4+ 2 + 6H+=10CO2 + 2Mn2+ +8H2O),当溶液紫红色恰好褪去时,消耗b mL标准溶液。该产品的纯度为
+ 6H+=10CO2 + 2Mn2+ +8H2O),当溶液紫红色恰好褪去时,消耗b mL标准溶液。该产品的纯度为_______ (已知NaBiO3摩尔质量为Mg/mol,用含w、a、 b、M的代数式表示)。
I.制取铋酸钠。制取装置如图(加热和夹持仪器已略去),部分物质性质如下:

| 物质 | NaBiO3 | Bi(OH)3 |
| 性质 | 不溶于冷水, 浅黄色 | 难溶于水,白色 |
(2)C中盛放Bi(OH)3与NaOH的混合物,与Cl2反应生成NaBiO3,反应的化学方程式为:
(3)当观察到C中
(4)拆除装置前必须先除去残留的Cl2,以免污染空气。除去烧瓶A中残留Cl2的操作是:关闭
(5)反应结束后,为从装置C中获得尽可能多的产品,需要的操作是
II.铋酸钠的应用——检验Mn2+
(6)往待检液中加入铋酸钠晶体,加硫酸酸化,生成Bi3+,且溶液变为紫红色,证明待检液中存在Mn2+,产生紫红色现象的离子方程式为
III.产品纯度的测定
(7)取上述NaBiO3产品wg,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用a mol·L-1的H2C2O4标准溶液滴定生成的
 (已知: 5H2C2O4+ 2
(已知: 5H2C2O4+ 2 + 6H+=10CO2 + 2Mn2+ +8H2O),当溶液紫红色恰好褪去时,消耗b mL标准溶液。该产品的纯度为
+ 6H+=10CO2 + 2Mn2+ +8H2O),当溶液紫红色恰好褪去时,消耗b mL标准溶液。该产品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】二氧化氯(ClO2)被联合国世界卫生组织列为A1级高效安全灭菌消毒剂。常温下ClO2为黄绿色气体,其熔点为-59℃,沸点为11.0℃,易溶于水,不与水反应。浓度过高时易发生分解,遇热不稳定易分解发生爆炸。工业上利用硫铁矿[主要成分为二硫化亚铁(FeS2)]还原氯酸钠(NaClO3)制取二氧化氯。某研究小组利用如图装置制备ClO2,向三颈烧瓶中加入NaClO3溶液、浓H2SO4),并通入空气,调节恒温器至60℃,通过固体加料器缓慢匀速加入硫铁矿粉末。请回答下列问题:
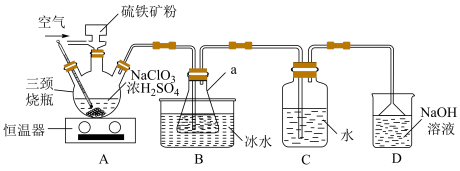
(1)FeS2中S价态___________ ,仪器a的名称___________ 。
(2)三颈烧瓶中的化学方程式为: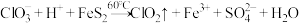 (未配平)
(未配平)
①请配平并写出以上反应方程式___________ 。
②被氧化的元素为___________ (写元素符号)
(3)通入空气的目的是(回答出一种即可)___________ 。
(4)装置D中倒置漏斗的作用___________ 。
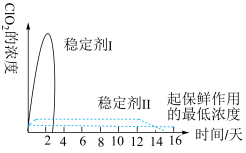
(5) 能被多种稳定剂吸收,若将其用于果蔬保鲜,你认为下图中效果较好的稳定剂是
能被多种稳定剂吸收,若将其用于果蔬保鲜,你认为下图中效果较好的稳定剂是___________ ,原因是___________ 。

(1)FeS2中S价态
(2)三颈烧瓶中的化学方程式为:
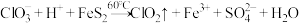 (未配平)
(未配平)①请配平并写出以上反应方程式
②被氧化的元素为
(3)通入空气的目的是(回答出一种即可)
(4)装置D中倒置漏斗的作用
(5)
 能被多种稳定剂吸收,若将其用于果蔬保鲜,你认为下图中效果较好的稳定剂是
能被多种稳定剂吸收,若将其用于果蔬保鲜,你认为下图中效果较好的稳定剂是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】六氟磷酸锂(LiPF6)具有良好的导电性与电化学稳定性能,常作锂离子电池的电解质。LiPF6极易溶于水,可溶于乙醇等有机溶剂,极易吸水潮解,热稳定性差。实验室制备LiPF6的实验装置如图:
i.在氮气保护的手套箱中,准确称取26.0g干燥LiF固体以及过量PCl5固体,均倒入聚四氟乙烯材质的反应器中,再往其中逐渐加入乙腈,至PCl5充分溶解。
ii.往装置中通一段时间N2,以排出其中空气,关闭K1,加热NaHF2,将生成的HF气体通入反应器中,同时搅拌混合其中的物料。
iii.通过往反应器所处的冷浴槽中调控0~10℃的低温。6~8h后终止反应,继续通N2再关闭加热炉保持通N2一段时间。
iv.打开反应器,对反应后的物料进行过滤,滤液用一个聚乙烯材质的塑料瓶接收,密封后拿出手套箱,置于-18~5℃环境中低温结晶。在氮气保护下,过滤出结晶,经40~50℃真空干燥,最终得到产品140.6g。
回答下列问题:
(1)反应装置选用聚四氟乙烯材质容器,不能用玻璃容器,原因是______ (用化学方程式表示)。
(2)NaHF2加热分解的化学方程式为______ 。
(3)干燥塔的作用为______ 。
(4)NaOH溶液的作用为______ 。
(5)已知合成LiPF6的反应为 ,则生成PF5的化学方程式为
,则生成PF5的化学方程式为______ 。
(6)反应结束后,通入氮气的目的是______ 。
(7)本实验所得六氟磷酸锂的产率为______ %(保留三位有效数字)。

i.在氮气保护的手套箱中,准确称取26.0g干燥LiF固体以及过量PCl5固体,均倒入聚四氟乙烯材质的反应器中,再往其中逐渐加入乙腈,至PCl5充分溶解。
ii.往装置中通一段时间N2,以排出其中空气,关闭K1,加热NaHF2,将生成的HF气体通入反应器中,同时搅拌混合其中的物料。
iii.通过往反应器所处的冷浴槽中调控0~10℃的低温。6~8h后终止反应,继续通N2再关闭加热炉保持通N2一段时间。
iv.打开反应器,对反应后的物料进行过滤,滤液用一个聚乙烯材质的塑料瓶接收,密封后拿出手套箱,置于-18~5℃环境中低温结晶。在氮气保护下,过滤出结晶,经40~50℃真空干燥,最终得到产品140.6g。
回答下列问题:
(1)反应装置选用聚四氟乙烯材质容器,不能用玻璃容器,原因是
(2)NaHF2加热分解的化学方程式为
(3)干燥塔的作用为
(4)NaOH溶液的作用为
(5)已知合成LiPF6的反应为
 ,则生成PF5的化学方程式为
,则生成PF5的化学方程式为(6)反应结束后,通入氮气的目的是
(7)本实验所得六氟磷酸锂的产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某化学小组在查阅文献及实验探究的基础上,深刻地认识了卤素的性质。
I.F2与C12的相似性。1971年N.H.Studier和E.H.Appelman从冰(-40℃)的氟化作用中首次发现F2、C12与水的反应相似。
(1)写出氟气与水发生上述反应的化学方程式_____________________________________ 。
II.次氯酸钠和氯酸钾的制备。按图装配仪器并检查装置的气密性。

第一步:在锥形瓶内放约3g MnO2粉末,安全漏斗深入试管底部;
第二步:在管6中放4mL 6mol·L-1KOH溶液(放热水浴中),管7中放4mL 2mol· L-1NaOH溶液(放冰水浴中)。打开控制夹3,关闭控制夹4;
第三步:由漏斗加入15mL 9mol·L-1HCl溶液,缓慢加热,控制氯气均匀产生。热水浴温度控制在323K~328K;
第四步:一段时间后,停止加热,……
(2)锥形瓶中用小试管的优点为_________________________________________________ 。
(3)停止加热后的操作是____________________________________ ,再将管6和管7拆下。
(4)查阅文献资料知道,将NaClO溶液加热,NaClO分解可生成NaClO3,据此推断若将KC1O3加热至673K,其分解的化学方程式为_____________________________________ 。
Ⅲ.C1-、Br-、I-的混合液中C1-的鉴定
已知:Ksp(AgC1)=1.8×10-10 Ksp(AgBr)=5.4×10-13 Ksp(AgI)=8.5×10-17
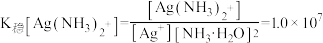
第一步:取2-3滴C1-、Br-、I-的混合液,加1滴6mol·L-1HNO3溶液酸化,滴加0.1mol·L-1AgNO3溶液至沉淀完全,加热2min,离心分离,弃去溶液:
第二步:在沉淀中加入5~10滴2mol·L-1NH3·H2O溶液,剧烈搅拌,并温热1min,离心沉降,移清液于另一支试管中。
(5)已知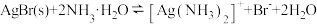 ,设平衡时[Ag(NH3)2]+浓度为0.1mol·L-1,则溶解AgBr沉淀所需氨水的最低浓度约为
,设平衡时[Ag(NH3)2]+浓度为0.1mol·L-1,则溶解AgBr沉淀所需氨水的最低浓度约为_______ mol·L-1( )。
)。
(6)根据上述计算,可推知清液中溶质主要成分的化学式为_________________________ 。
第三步:清液用6mol·L-1HNO3酸化,
(7)现象是_______________________________________________ ,证实C1-存在。反应的离子方程式为__________________________________________________ 。
I.F2与C12的相似性。1971年N.H.Studier和E.H.Appelman从冰(-40℃)的氟化作用中首次发现F2、C12与水的反应相似。
(1)写出氟气与水发生上述反应的化学方程式
II.次氯酸钠和氯酸钾的制备。按图装配仪器并检查装置的气密性。

第一步:在锥形瓶内放约3g MnO2粉末,安全漏斗深入试管底部;
第二步:在管6中放4mL 6mol·L-1KOH溶液(放热水浴中),管7中放4mL 2mol· L-1NaOH溶液(放冰水浴中)。打开控制夹3,关闭控制夹4;
第三步:由漏斗加入15mL 9mol·L-1HCl溶液,缓慢加热,控制氯气均匀产生。热水浴温度控制在323K~328K;
第四步:一段时间后,停止加热,……
(2)锥形瓶中用小试管的优点为
(3)停止加热后的操作是
(4)查阅文献资料知道,将NaClO溶液加热,NaClO分解可生成NaClO3,据此推断若将KC1O3加热至673K,其分解的化学方程式为
Ⅲ.C1-、Br-、I-的混合液中C1-的鉴定
已知:Ksp(AgC1)=1.8×10-10 Ksp(AgBr)=5.4×10-13 Ksp(AgI)=8.5×10-17
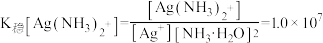
第一步:取2-3滴C1-、Br-、I-的混合液,加1滴6mol·L-1HNO3溶液酸化,滴加0.1mol·L-1AgNO3溶液至沉淀完全,加热2min,离心分离,弃去溶液:
第二步:在沉淀中加入5~10滴2mol·L-1NH3·H2O溶液,剧烈搅拌,并温热1min,离心沉降,移清液于另一支试管中。
(5)已知
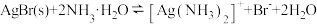 ,设平衡时[Ag(NH3)2]+浓度为0.1mol·L-1,则溶解AgBr沉淀所需氨水的最低浓度约为
,设平衡时[Ag(NH3)2]+浓度为0.1mol·L-1,则溶解AgBr沉淀所需氨水的最低浓度约为 )。
)。(6)根据上述计算,可推知清液中溶质主要成分的化学式为
第三步:清液用6mol·L-1HNO3酸化,
(7)现象是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】实验室用下图所示装置制备FeSO4,该物质应用广泛。
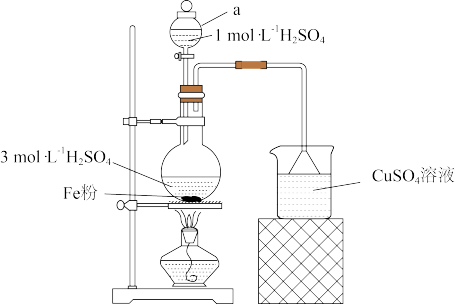
已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)实验装置
图中仪器a的名称为___________ 。反应过程中会产生少量PH3气体,需使用封闭装置,用CuSO4溶液吸收PH3时会生成H3PO4和Cu,该反应的化学方程式为________ 。
(2)药品用量
将2 g Fe粉、10 mL 3 mol·L-1 H2SO4溶液加入烧瓶中反应。采取铁粉过量的原料配比的主要原因是_________ 。
(3)制备FeSO4溶液
保持温度70~80℃,至反应无明显气泡产生,停止加热,过滤,除去残留固体,滤液经_________ 、_________ ,过滤、洗涤、干燥,得到FeSO4·7H2O[已知:FeSO4·7H2O的溶解度随着温度升高增加程度大]。
(4)用途
①制备(NH4)2Fe(SO4)2·6H2O
将FeSO4·7H2O溶于稀硫酸,向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80℃条件下溶解后,趁热倒入50 mL乙醇中,继而析出晶体。上述过程中,溶于稀硫酸的目的是_________ ,后续加入乙醇的作用为_________ 。
②絮凝剂——聚合硫酸铁
向稀硫酸酸化的FeSO4溶液中缓慢滴加H2O2,此时发生反应的离子方程式为__________ ,继续在加热条件下反应一段时间,制得红棕色的聚合硫酸铁。

已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)实验装置
图中仪器a的名称为
(2)药品用量
将2 g Fe粉、10 mL 3 mol·L-1 H2SO4溶液加入烧瓶中反应。采取铁粉过量的原料配比的主要原因是
(3)制备FeSO4溶液
保持温度70~80℃,至反应无明显气泡产生,停止加热,过滤,除去残留固体,滤液经
(4)用途
①制备(NH4)2Fe(SO4)2·6H2O
将FeSO4·7H2O溶于稀硫酸,向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80℃条件下溶解后,趁热倒入50 mL乙醇中,继而析出晶体。上述过程中,溶于稀硫酸的目的是
②絮凝剂——聚合硫酸铁
向稀硫酸酸化的FeSO4溶液中缓慢滴加H2O2,此时发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】纳米Fe3O4在生物医学和催化剂载体等领域应用前景光明。其制备流程如图:

已知:锌单质溶于强碱生成ZnO ;Zn(OH)2既能溶于强酸又能溶于强碱。
;Zn(OH)2既能溶于强酸又能溶于强碱。
请回答下列问题:
(1)用NaOH溶液处理废旧锌铁皮的作用有__ 。
A.去除油污 B.溶解镀锌层 C.去除铁锈 D.钝化
(2)步骤②生成Zn(OH)2沉淀,用离子方程式结合文字说明该步骤pH不能过小的原因__ 。调节pH的最佳方法是向溶液中通入__ (填化学式)。
(3)步骤④反应的离子方程式为__ ;为确保纳米Fe3O4粒子的纯度,应调整原溶液中Fe2+与所加H2O2的物质的量之比为__ 。
(4)步骤⑤制得Fe3O4纳米粒子的过程,需要在无氧环境下进行,说明理由__ 。
(5)步骤⑤不能用减压过滤(抽滤)得到纳米Fe3O4粒子,理由是__ 。

已知:锌单质溶于强碱生成ZnO
 ;Zn(OH)2既能溶于强酸又能溶于强碱。
;Zn(OH)2既能溶于强酸又能溶于强碱。请回答下列问题:
(1)用NaOH溶液处理废旧锌铁皮的作用有
A.去除油污 B.溶解镀锌层 C.去除铁锈 D.钝化
(2)步骤②生成Zn(OH)2沉淀,用离子方程式结合文字说明该步骤pH不能过小的原因
(3)步骤④反应的离子方程式为
(4)步骤⑤制得Fe3O4纳米粒子的过程,需要在无氧环境下进行,说明理由
(5)步骤⑤不能用减压过滤(抽滤)得到纳米Fe3O4粒子,理由是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】1841年美国学者Fremy首次合成了 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。资料:已知
,并探究其性质。资料:已知 时KCl的溶解度为37.4g,
时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。 为紫色固体,微溶于KOH溶液,热稳定性差,具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液,热稳定性差,具有强氧化性,在酸性或中性溶液中快速产生 。
。
(1)制备 (如图所示,夹持装置略)
(如图所示,夹持装置略)

①仪器B的作用为_________ 。如果没有该装置,会导致___________ 。
②反应时C控温 ,温度不能高于
,温度不能高于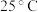 的主要原因是
的主要原因是_________ 。C中得到紫色固体和溶液,写出C中反应生成 的化学方程式:
的化学方程式:_________ 。
(2)在其他条件相同时,测得一定浓度的 稳定性(用
稳定性(用 浓度表示)与pH关系如图甲,其消毒效率与温度关系如图乙所示:
浓度表示)与pH关系如图甲,其消毒效率与温度关系如图乙所示:

①根据图甲得出的结论是_________ 。
②在相同条件下, 作消毒剂最佳温度是
作消毒剂最佳温度是________ 。
(3) 的纯度分析
的纯度分析
将1.98g样品与过量的KI溶液(硫酸酸化)充分反应(杂质不参与反应)后配成100mL溶液,每次取10.00mL用 的
的 标准溶液滴定,三次滴定消耗
标准溶液滴定,三次滴定消耗 标准溶液体积平均为19.20mL,则原样品中高铁酸钾的质量分数为
标准溶液体积平均为19.20mL,则原样品中高铁酸钾的质量分数为______ 。已知: 。
。
 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。资料:已知
,并探究其性质。资料:已知 时KCl的溶解度为37.4g,
时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。 为紫色固体,微溶于KOH溶液,热稳定性差,具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液,热稳定性差,具有强氧化性,在酸性或中性溶液中快速产生 。
。(1)制备
 (如图所示,夹持装置略)
(如图所示,夹持装置略)
①仪器B的作用为
②反应时C控温
 ,温度不能高于
,温度不能高于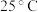 的主要原因是
的主要原因是 的化学方程式:
的化学方程式:(2)在其他条件相同时,测得一定浓度的
 稳定性(用
稳定性(用 浓度表示)与pH关系如图甲,其消毒效率与温度关系如图乙所示:
浓度表示)与pH关系如图甲,其消毒效率与温度关系如图乙所示:
①根据图甲得出的结论是
②在相同条件下,
 作消毒剂最佳温度是
作消毒剂最佳温度是(3)
 的纯度分析
的纯度分析将1.98g样品与过量的KI溶液(硫酸酸化)充分反应(杂质不参与反应)后配成100mL溶液,每次取10.00mL用
 的
的 标准溶液滴定,三次滴定消耗
标准溶液滴定,三次滴定消耗 标准溶液体积平均为19.20mL,则原样品中高铁酸钾的质量分数为
标准溶液体积平均为19.20mL,则原样品中高铁酸钾的质量分数为 。
。
您最近一年使用:0次



