硅烷SiH4可用于制造高纯硅。采用硅化镁法制备SiH4的化学方程式如下:Mg2Si+4NH4Cl+8NH3=SiH4+2MgCl2·6NH3
(1)硅在元素周期表中的位置是___________ ,基态硅原子占据的最高能级的符号是___________ 。
(2)①SiH4的电子式是___________ 。
②SiH4的沸点比CH4的___________ 。(填“高”或“低”),原因是___________ 。
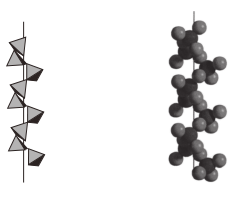
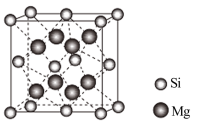
(3)Mg2Si可由Mg和SiO2反应制得。晶体SiO2属于___________ 晶体(填晶体类型),一种SiO2晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如图)。其中Si原子的杂化轨道类型是___________ 。___________ 个紧邻的Mg原子。已知Mg2Si的晶胞边长为acm,阿伏加德罗常数的值为NA,则Mg2Si晶体的密度为___________ g·cm-3。
(1)硅在元素周期表中的位置是
(2)①SiH4的电子式是
②SiH4的沸点比CH4的
(3)Mg2Si可由Mg和SiO2反应制得。晶体SiO2属于
21-22高三上·北京西城·期末 查看更多[8]
更新时间:2022-01-14 20:51:06
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】葡萄糖酸锌是一种常见的补锌药物,常用葡萄糖酸和ZnSO4反应制备。
(1)Zn2+基态核外电子排布式为_______ 。
(2)SO2的空间构型为_______ (用文字描述),键角:
_______  (填“>”“<”或“=”),理由:
(填“>”“<”或“=”),理由:_______ 。
(3)Zn2+与NH3能形成[Zn(NH3)4]2+,1mol[Zn(NH3)4]2+中含有的σ键的数目为_______ 。
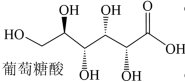
(4)葡萄糖酸的分子结构如下图所示,推测葡萄糖酸在水中的溶解性:_______ (填“难溶于水”或“易溶于水”)。_______ 。最近的两个Zn2+的距离为apm,阿伏加德罗常数为NA,则ZnS晶体的密度为_______ 。(列计算式)
(1)Zn2+基态核外电子排布式为
(2)SO2的空间构型为

 (填“>”“<”或“=”),理由:
(填“>”“<”或“=”),理由:(3)Zn2+与NH3能形成[Zn(NH3)4]2+,1mol[Zn(NH3)4]2+中含有的σ键的数目为
(4)葡萄糖酸的分子结构如下图所示,推测葡萄糖酸在水中的溶解性:

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】我国科学家制备的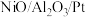 催化剂能实现氨硼烷(H3NBH3)高效制备氢气的目的,制氢原理:
催化剂能实现氨硼烷(H3NBH3)高效制备氢气的目的,制氢原理: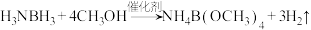
请回答下列问题:
(1)基态Al原子核外电子云轮廓图呈球形、哑铃形的能级上电子数之比为_______ 。
(2)已知几种元素的电负性如下表所示。
①上述制氢反应中,有_______ 种元素的原子采取 杂化。
杂化。
② 中键角∠HNH
中键角∠HNH_______ (填“大于”、“小于”或“等于”)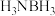 中键角∠HNH。
中键角∠HNH。
③B、C、N、O的电负性依次增大,其主要原因是_______ 。
④在氨硼烷中,H—B键中H带部分_______ (填“正”或“负”)电荷。
(3)某有机硼化合物的结构简式如图1所示,1mol该有机物中含_______ mol 键。组成该有机物的第二周期元素第一电离能由大到小的顺序为
键。组成该有机物的第二周期元素第一电离能由大到小的顺序为_______ (填元素符号)。

(4)磷化硼是一种新型无机非金属材料,晶胞结构如图2所示。以晶胞参数为单位长度建立坐标系,表示晶胞中各原子的位置,称为原子坐标。a点磷原子的坐标为(0,0,0),b点磷原子的坐标为(1,1,0),则c点硼原子的坐标为_______ 。

(5)四氢铝钠(NaAlH4)是有机合成中重要的还原剂,晶胞结构如图3所示。

① 的空间构型为
的空间构型为_______ , 的配位数为
的配位数为_______ 。
②已知NA为阿伏加德罗常数的值,晶体的密度为_______ (用含a、NA的代数式表示) 。
。
 催化剂能实现氨硼烷(H3NBH3)高效制备氢气的目的,制氢原理:
催化剂能实现氨硼烷(H3NBH3)高效制备氢气的目的,制氢原理: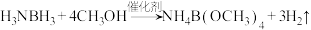
请回答下列问题:
(1)基态Al原子核外电子云轮廓图呈球形、哑铃形的能级上电子数之比为
(2)已知几种元素的电负性如下表所示。
| 元素 | H | B | C | N | O |
| 电负性 | 2.1 | 2.0 | 2.5 | 3.0 | 3.5 |
 杂化。
杂化。②
 中键角∠HNH
中键角∠HNH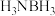 中键角∠HNH。
中键角∠HNH。③B、C、N、O的电负性依次增大,其主要原因是
④在氨硼烷中,H—B键中H带部分
(3)某有机硼化合物的结构简式如图1所示,1mol该有机物中含
 键。组成该有机物的第二周期元素第一电离能由大到小的顺序为
键。组成该有机物的第二周期元素第一电离能由大到小的顺序为
(4)磷化硼是一种新型无机非金属材料,晶胞结构如图2所示。以晶胞参数为单位长度建立坐标系,表示晶胞中各原子的位置,称为原子坐标。a点磷原子的坐标为(0,0,0),b点磷原子的坐标为(1,1,0),则c点硼原子的坐标为

(5)四氢铝钠(NaAlH4)是有机合成中重要的还原剂,晶胞结构如图3所示。

①
 的空间构型为
的空间构型为 的配位数为
的配位数为②已知NA为阿伏加德罗常数的值,晶体的密度为
 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】元素及其化合物因其结构的差异导致性质各异。请回答:
(1)某激发态磷原子的电子排布式为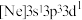 ,该磷原子中有
,该磷原子中有____ 种空间运动状态不同的电子。
(2)NCl3的空间结构为_____ ,和BCl3相比二者中沸点更高的物质是_____ ,第一电离能介于B、N之间的第二周期元素有_____ 种。
(3)M是氮杂氟硼二吡咯类物质,常用作光敏剂,其结构如图。 键,则虚线框中氮元素采用杂化方式为
键,则虚线框中氮元素采用杂化方式为____ ,M中存在的微粒间作用力有____ (填标号)。
A.共价键 B.离子键 C.氢键 D.配位键
(4)FeS2晶体的晶胞形状为立方体,边长为anm,结构如图。____ 个。
②FeS2的摩尔质量为120g∙mol-1,阿伏加德罗常数为NA.该晶体的密度为____ g∙cm-3。
(1)某激发态磷原子的电子排布式为
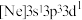 ,该磷原子中有
,该磷原子中有(2)NCl3的空间结构为
(3)M是氮杂氟硼二吡咯类物质,常用作光敏剂,其结构如图。
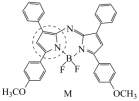
 键,则虚线框中氮元素采用杂化方式为
键,则虚线框中氮元素采用杂化方式为A.共价键 B.离子键 C.氢键 D.配位键
(4)FeS2晶体的晶胞形状为立方体,边长为anm,结构如图。

②FeS2的摩尔质量为120g∙mol-1,阿伏加德罗常数为NA.该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】碳及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态C原子中,核外存在_______ 对自旋方向相反的电子。
(2)丙酮( )分子中,中间碳原子的杂化方式为
)分子中,中间碳原子的杂化方式为______ ; 中
中 键和π键的数目之比为
键和π键的数目之比为__________________ .
(3)写出两个与CO2具有相同空间构型的分子或离子:_____________
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于_____ 晶体;Fe3+的核外电子排布式为__________________ 。
(5)已知第IIA族元素的碳酸盐MCO3热分解的主要过程为M2+结合碳酸根离子中的O2-,释放出CO2。则CaCO3的分解温度低于BaCO3的原因是_______________ 。分子中的大π键用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则CO32-中的大π键应表示为
),则CO32-中的大π键应表示为____________ 。
(6)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,一个六元环上的C原子数为__________________ 。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接_____ 个六元环,六元环中最多有_______ 个C原子在同一平面。
(1)在基态C原子中,核外存在
(2)丙酮(
 )分子中,中间碳原子的杂化方式为
)分子中,中间碳原子的杂化方式为 中
中 键和π键的数目之比为
键和π键的数目之比为(3)写出两个与CO2具有相同空间构型的分子或离子:
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于
(5)已知第IIA族元素的碳酸盐MCO3热分解的主要过程为M2+结合碳酸根离子中的O2-,释放出CO2。则CaCO3的分解温度低于BaCO3的原因是
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则CO32-中的大π键应表示为
),则CO32-中的大π键应表示为(6)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,一个六元环上的C原子数为
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】Ⅰ.有一应用前景广阔的纳米材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高。取材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一种含B元素的气体丙,丙能使湿润的红色石蕊试纸变蓝;乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解。
(1)甲的化学式为_________ ,其晶体属于________ 晶体
(2)乙的水溶液可以用来做__________________ (写出一种用途)
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。则丁的电子式为_____________ 。
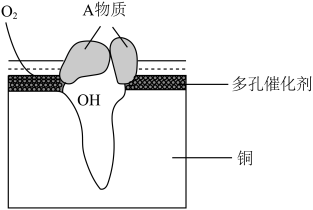
Ⅱ.某铜制品在潮湿环境中发生的电化学腐蚀过程可表示为如图,腐蚀后有A物质生成,某小组为分析A物质的组成,进行了如下实验:
实验①:取A样品,加过量稀硝酸完全溶解后,再加入AgNO3溶液,有白色沉淀生成。
实验②:另取A样品4.29g,加入含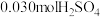 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
(1)该粉状锈中除了铜元素外还含有(写元素符号)_____ 元素.
(2)写出该粉状锈溶于稀硫酸反应的离子方程式____ 。
(3)加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为_____ 。
(1)甲的化学式为
(2)乙的水溶液可以用来做
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。则丁的电子式为
Ⅱ.某铜制品在潮湿环境中发生的电化学腐蚀过程可表示为如图,腐蚀后有A物质生成,某小组为分析A物质的组成,进行了如下实验:
实验①:取A样品,加过量稀硝酸完全溶解后,再加入AgNO3溶液,有白色沉淀生成。
实验②:另取A样品4.29g,加入含
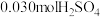 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
(1)该粉状锈中除了铜元素外还含有(写元素符号)
(2)写出该粉状锈溶于稀硫酸反应的离子方程式
(3)加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为_______ ;与硒同周期的p区元素中第一电离能大于硒的元素有_______ 种; 的空间构型是
的空间构型是_______ 。
(2)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是_______ 。硅与氢结合能形成一系列的二元化合物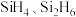 等,与氯、溴结合能形成
等,与氯、溴结合能形成 ,上述四种物质沸点由高到低顺序为
,上述四种物质沸点由高到低顺序为_______ ,丁硅烯 中
中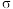 键与
键与 键个数之比为
键个数之比为_______ 。
(3)GaN、GaP、GaAs都是原子晶体,熔点如表所示,分析其熔点变化的原因_______ 。
(4)GaN晶胞结构如图甲所示。已知六棱柱底边边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。从GaN晶体中分割出的平行六面体如图乙,该平行六面体的高为
。从GaN晶体中分割出的平行六面体如图乙,该平行六面体的高为 ,GaN晶体的密度为
,GaN晶体的密度为_______  (用
(用 表示)。
表示)。
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为
 的空间构型是
的空间构型是(2)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是
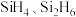 等,与氯、溴结合能形成
等,与氯、溴结合能形成 ,上述四种物质沸点由高到低顺序为
,上述四种物质沸点由高到低顺序为 中
中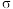 键与
键与 键个数之比为
键个数之比为(3)GaN、GaP、GaAs都是原子晶体,熔点如表所示,分析其熔点变化的原因
| GaN | GaP | GaAs | |
| 熔点 | 1700℃ | 1480℃ | 1238℃ |
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。从GaN晶体中分割出的平行六面体如图乙,该平行六面体的高为
。从GaN晶体中分割出的平行六面体如图乙,该平行六面体的高为 ,GaN晶体的密度为
,GaN晶体的密度为 (用
(用 表示)。
表示)。
您最近一年使用:0次
【推荐1】利用 光催化可以处理含有
光催化可以处理含有 的废水。
的废水。
(1) 的价层电子排布式:
的价层电子排布式:_______ ,下图为 的晶胞,其中●代表的元素是
的晶胞,其中●代表的元素是_______ 。

I.电解法制取
(2)利用铜和钛做电极,电解含有 和
和 的溶液时,
的溶液时, 浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是
浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是_______ 。
II.利用 光催化处理含
光催化处理含 的废水的研究。
的废水的研究。
(3)光照射到 光催化剂上产生光催化反应,
光催化剂上产生光催化反应, 和光照
和光照 分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出
分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出 转化
转化 的电极反应:
的电极反应:_______ 。

(4)研究中对 的作用提出两种假设:
的作用提出两种假设:
a. 作光催化剂;
作光催化剂;
b. 与
与 发生氧化还原反应。
发生氧化还原反应。
已知: 的添加量是
的添加量是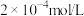 ,
, 的初始浓度是
的初始浓度是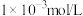 ,对比实验(
,对比实验( 且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是
且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是_______ ,依据是_______ 。

(5)溶液的 对
对 降解率的影响如图所示。
降解率的影响如图所示。

已知: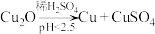 ;酸性越大,
;酸性越大, 被还原率越大。
被还原率越大。
① 分别为2、3、4时,
分别为2、3、4时, 的降解率最好的是
的降解率最好的是_______ ,其原因是_______ 。
②已知 时,会产生
时,会产生 沉淀,则
沉淀,则 时,
时, 的降解率低的原因是
的降解率低的原因是_______ 。
 光催化可以处理含有
光催化可以处理含有 的废水。
的废水。(1)
 的价层电子排布式:
的价层电子排布式: 的晶胞,其中●代表的元素是
的晶胞,其中●代表的元素是
I.电解法制取

(2)利用铜和钛做电极,电解含有
 和
和 的溶液时,
的溶液时, 浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是
浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是II.利用
 光催化处理含
光催化处理含 的废水的研究。
的废水的研究。(3)光照射到
 光催化剂上产生光催化反应,
光催化剂上产生光催化反应, 和光照
和光照 分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出
分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出 转化
转化 的电极反应:
的电极反应:
(4)研究中对
 的作用提出两种假设:
的作用提出两种假设:a.
 作光催化剂;
作光催化剂;b.
 与
与 发生氧化还原反应。
发生氧化还原反应。已知:
 的添加量是
的添加量是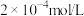 ,
, 的初始浓度是
的初始浓度是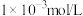 ,对比实验(
,对比实验( 且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是
且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是
(5)溶液的
 对
对 降解率的影响如图所示。
降解率的影响如图所示。
已知:
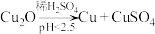 ;酸性越大,
;酸性越大, 被还原率越大。
被还原率越大。①
 分别为2、3、4时,
分别为2、3、4时, 的降解率最好的是
的降解率最好的是②已知
 时,会产生
时,会产生 沉淀,则
沉淀,则 时,
时, 的降解率低的原因是
的降解率低的原因是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】表中A、B、C、D、E、F为短周期主族元素,G为第四周期元素,它们的原子序数依次增大。
(1)C基态原子电子排布式为___ ,CA3中心原子的杂化方式为___ ,分子空间构型为___ 。B,C,D三种元素的第一电离能由大到小的顺序___ 。
(2)E的最高价氧化物的VSEPR模型名称为___ ,其属于___ (填“极性”或“非极性”)分子。
(3)A2D的沸点比A2E的沸点高,其主要原因是___ 。
(4)下列关于B2A4的说法中正确的是___ (填序号)。
(5)下列图象可表示两个F原子间成键后的电子云的图象是___ 。

(6)向G2+的硫酸盐溶液中滴加氨水直至过量,首先观察到生成蓝色沉淀,离子方程式为___ ,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,加入乙醇后有深蓝色晶体析出,写出该配离子的结构简式(标出配位键)___ 。
| A.元素周期表中原子半径最小的元素 |
| B.原子最外层电子数是内层电子数的2倍 |
| C.元素原子的核外p电子总数比s电子总数少1 |
| D.基态原子的价电子排布式为nsnnp2n |
| E.与D同主族,且原子序数为D的2倍 |
| F.元素的主族序数与周期数的差为4 |
| G.基态原子最外层电子排布为4s1,内层处于全充满状态 |
(2)E的最高价氧化物的VSEPR模型名称为
(3)A2D的沸点比A2E的沸点高,其主要原因是
(4)下列关于B2A4的说法中正确的是
| A.B2A4中的所有原子都满足8电子稳定结构 |
| B.B2A4分子中σ键和π键数目比为1∶1 |
| C.B2A4是由极性键和非极性键形成的非极性分子 |
| D.B2A4分子发生加成反应时σ键断裂 |

(6)向G2+的硫酸盐溶液中滴加氨水直至过量,首先观察到生成蓝色沉淀,离子方程式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】利用钛铁矿(主要成分为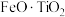 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备磷酸铁和锂离子电池正极材料(
等杂质)制备磷酸铁和锂离子电池正极材料( )的部分工业流程如图所示:
)的部分工业流程如图所示: (
(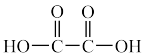 )、
)、 ,中C原子的杂化方式依次为
,中C原子的杂化方式依次为___________ 、___________ 。
(2) 、
、 的熔、沸点:
的熔、沸点: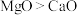 ,原因为
,原因为___________ 。
(3)已知 的配合物有多种,如
的配合物有多种,如 、
、 (
( )等。
)等。
① 的VSEPR模型名称为
的VSEPR模型名称为___________ 。
②从原子结构角度预测 具有较强的还原性,原因为
具有较强的还原性,原因为___________ 。
③配合物 (
( )与游离的
)与游离的 分子相比,配合物中的
分子相比,配合物中的 键角
键角___________ (填“>”“<”或“=”) 中的,原因是
中的,原因是___________ 。
(4)在一定条件下铁形成的晶体的基本结构单元如图所示,设铁原子的半径为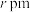 ,则
,则 原子的配位数为
原子的配位数为___________ ,该晶体的密度为___________ (列出计算式) 。
。
 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备磷酸铁和锂离子电池正极材料(
等杂质)制备磷酸铁和锂离子电池正极材料( )的部分工业流程如图所示:
)的部分工业流程如图所示: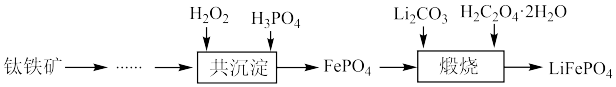
 (
(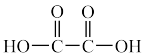 )、
)、 ,中C原子的杂化方式依次为
,中C原子的杂化方式依次为(2)
 、
、 的熔、沸点:
的熔、沸点: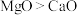 ,原因为
,原因为(3)已知
 的配合物有多种,如
的配合物有多种,如 、
、 (
( )等。
)等。①
 的VSEPR模型名称为
的VSEPR模型名称为②从原子结构角度预测
 具有较强的还原性,原因为
具有较强的还原性,原因为③配合物
 (
( )与游离的
)与游离的 分子相比,配合物中的
分子相比,配合物中的 键角
键角 中的,原因是
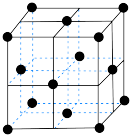
中的,原因是(4)在一定条件下铁形成的晶体的基本结构单元如图所示,设铁原子的半径为
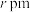 ,则
,则 原子的配位数为
原子的配位数为 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】I.非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种
(2) 、
、 、
、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为___________ 。
(3) 中
中 的杂化类型是
的杂化类型是___________ ; 分子的空间结构为
分子的空间结构为___________ 。
(4) 的熔、沸点
的熔、沸点___________ (填“高于”或“低于”) ,原因是
,原因是___________ 。
II.过渡金属元素铬()是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(5)对于基态 原子,下列叙述正确的是
原子,下列叙述正确的是___________ 。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B. 电子能量较高,总是在比
电子能量较高,总是在比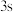 电子离核更远的地方运动
电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(1)基态
 原子核外电子的运动状态有
原子核外电子的运动状态有(2)
 、
、 、
、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)
 中
中 的杂化类型是
的杂化类型是 分子的空间结构为
分子的空间结构为(4)
 的熔、沸点
的熔、沸点 ,原因是
,原因是II.过渡金属元素铬()是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(5)对于基态
 原子,下列叙述正确的是
原子,下列叙述正确的是A.轨道处于半充满时体系总能量低,核外电子排布应为

B.
 电子能量较高,总是在比
电子能量较高,总是在比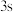 电子离核更远的地方运动
电子离核更远的地方运动C.电负性比钾高,原子对键合电子的吸引力比钾大
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】2023年8月1日起,我国对镓(Ga)、锗(Ge)相关物质实施出口管制。镓、锗元素及其化合物有许多用途。请回答:
(1)基态锗(Ge)原子简化的核外电子排布式为______ 。
(2)Ga属于ⅢA族元素,可形成GaX3、GaX(X代表卤素原子)两类卤化物和实验式为GaX2的化合物,相邻元素Ge常见卤化物为GeX4。
①金属镓(Ga)的几种卤化物熔点如下表:
GaF3熔点比GaCl3熔点高很多的原因是________ 。
②比较GaCl3、GeCl4的键角:Cl-Ga-Cl____ Cl-Ge-Cl(填“>”、“<”或“=”)。
③资料显示:Ga不存在+Ⅳ价,请用化学式表示实验式为GaCl2化合物可能的组成形态:________ [用罗马字符标明Ga在化合物中的价态:如Ga(Ⅲ)Cl3]。
(3)砷化镓是一种重要的半导体材料。砷化镓的晶胞如图1所示,Ga原子做面心立方密堆积,As原子填充在一半由Ga原子构成的四面体空隙中。沿晶胞对角线A→B方向观察得到的投影图如 2所示。请回答:______ pm(用含a、b的式子表示)。
②请在图2中将沿晶胞对角线A→B方向的As原子所在的位置涂黑________ 。
(1)基态锗(Ge)原子简化的核外电子排布式为
(2)Ga属于ⅢA族元素,可形成GaX3、GaX(X代表卤素原子)两类卤化物和实验式为GaX2的化合物,相邻元素Ge常见卤化物为GeX4。
①金属镓(Ga)的几种卤化物熔点如下表:
| GaF3 | GaCl3 | GaBr3 | |
| 熔点/℃ | >1000 | 77.8 | 122.3 |
②比较GaCl3、GeCl4的键角:Cl-Ga-Cl
③资料显示:Ga不存在+Ⅳ价,请用化学式表示实验式为GaCl2化合物可能的组成形态:
(3)砷化镓是一种重要的半导体材料。砷化镓的晶胞如图1所示,Ga原子做面心立方密堆积,As原子填充在一半由Ga原子构成的四面体空隙中。沿晶胞对角线A→B方向观察得到的投影图如 2所示。请回答:

②请在图2中将沿晶胞对角线A→B方向的As原子所在的位置涂黑
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】全球首次在350公里时速的奥运版复兴号高铁列车上依托5G技术打造的超高清直播演播室,实现了超高清信号的长时间稳定传输。请回答下列问题:
(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有_______ 种,若其电子排布式表示为[ Ne]3s2 违背了
违背了_______ 。
(2)高纯硅制备过程中会有SiHCl3、SiCl4等中间产物生成。沸点:SiHCl3_______ SiCl4(填“>”或“<”),与SiCl4互为等电子体的离子为_______ (任写1种即可)。已知电负性:H>Si,则SiHCl3充分水解的化学方程式为_______ 。
(3)复兴号高铁车体材质用到Mn、Co等元素。
①Mn的一种配合物化学式为[ Mn(CO)5( CH3CN)],下列说法正确的是_______ (填字母标号)。
A. CH3CN与Mn原子配位时,提供孤电子对的是C原子
B. Mn原子的配位数为6
C. CH3CN中C原子的杂化类型为sp2、sp3
D. CH3CN中σ键与π键数目之比为5:2
②已知r(Co2+) =65 pm,r(Mn2+) =67 pm,推测MnCO3比CoCO3的分解温度_______ (填“高”或“低”),解释原因_______ 。
(4)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图) ,晶胞参数(晶胞边长)为aD(1D= 10 -10m) ,其中阴离子( N3- )采用面心立方最密堆积方式,则r(Ti3+)为_______ D,该氮化钛的密度_______ g· cm-3(列出计算式即可)。

(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有
 违背了
违背了(2)高纯硅制备过程中会有SiHCl3、SiCl4等中间产物生成。沸点:SiHCl3
(3)复兴号高铁车体材质用到Mn、Co等元素。
①Mn的一种配合物化学式为[ Mn(CO)5( CH3CN)],下列说法正确的是
A. CH3CN与Mn原子配位时,提供孤电子对的是C原子
B. Mn原子的配位数为6
C. CH3CN中C原子的杂化类型为sp2、sp3
D. CH3CN中σ键与π键数目之比为5:2
②已知r(Co2+) =65 pm,r(Mn2+) =67 pm,推测MnCO3比CoCO3的分解温度
(4)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图) ,晶胞参数(晶胞边长)为aD(1D= 10 -10m) ,其中阴离子( N3- )采用面心立方最密堆积方式,则r(Ti3+)为

您最近一年使用:0次



