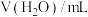化肥厂所产生的废水中,氮元素多以NH 和NH3·H2O的形式存在,直接排入水体中,不仅会引起水体富营养化,还会对人群及生物产生毒害作用。工业上,常用NaNO2来处理含NH
和NH3·H2O的形式存在,直接排入水体中,不仅会引起水体富营养化,还会对人群及生物产生毒害作用。工业上,常用NaNO2来处理含NH 或NH3·H2O的废水,其流程如图所示:
或NH3·H2O的废水,其流程如图所示:
已知:二价硫可表示为S(II);NaNO2易被空气中的氧气氧化,其与稀硫酸反应会生成易分解的亚硝酸。
(1)NaNO2中N的化合价为_______ 价。
(2)NaNO2的外观、味道均与食盐相似,但具有剧毒,被严禁作为食盐食用。误食后,能将血液中的Fe(II)_______ (填“氧化”或“还原”)为Fe(III);服用维生素C能缓解NaNO2中毒,维生素C作_______ (填“氧化剂”或“还原剂”)。
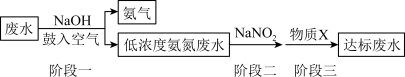
(3)在“阶段一”中,加入NaOH的作用为_______ (用离子方程式表示);鼓入空气的目的是_______ 。
(4)“阶段二”中NH 与NaNO2反应生成无污染的物质,该反应的离子方程式为
与NaNO2反应生成无污染的物质,该反应的离子方程式为_______ 。
(5)某化学兴趣小组设计如下实验探究NaNO2溶液与KI溶液的反应,步骤及现象如下。
①2mL注射器,吸取1mL浓度均为0.2mol·L-1NaNO2和KI的混合溶液,针头朝上排出空气。
②吸入少量稀硫酸并迅速将针头插入橡皮塞,观察到有无色气泡产生,溶液变黑,黑色固体析出附着在壁上,轻轻摇动将黑色固体洗到溶液中。
③摘去橡皮塞,轻轻拉动注射器活塞,吸入少量空气,观察到无色气体变成红棕色。
④将注射器中少量溶液挤入淀粉溶液中,观察到淀粉溶液变为蓝色。
步骤①中排出空气的目的是_______ ;步骤③中红棕色气体的化学式为_______ ;实验中NaNO2溶液与KI溶液发生反应的离子方程式为_______ 。
 和NH3·H2O的形式存在,直接排入水体中,不仅会引起水体富营养化,还会对人群及生物产生毒害作用。工业上,常用NaNO2来处理含NH
和NH3·H2O的形式存在,直接排入水体中,不仅会引起水体富营养化,还会对人群及生物产生毒害作用。工业上,常用NaNO2来处理含NH 或NH3·H2O的废水,其流程如图所示:
或NH3·H2O的废水,其流程如图所示:
已知:二价硫可表示为S(II);NaNO2易被空气中的氧气氧化,其与稀硫酸反应会生成易分解的亚硝酸。
(1)NaNO2中N的化合价为
(2)NaNO2的外观、味道均与食盐相似,但具有剧毒,被严禁作为食盐食用。误食后,能将血液中的Fe(II)
(3)在“阶段一”中,加入NaOH的作用为
(4)“阶段二”中NH
 与NaNO2反应生成无污染的物质,该反应的离子方程式为
与NaNO2反应生成无污染的物质,该反应的离子方程式为(5)某化学兴趣小组设计如下实验探究NaNO2溶液与KI溶液的反应,步骤及现象如下。
①2mL注射器,吸取1mL浓度均为0.2mol·L-1NaNO2和KI的混合溶液,针头朝上排出空气。
②吸入少量稀硫酸并迅速将针头插入橡皮塞,观察到有无色气泡产生,溶液变黑,黑色固体析出附着在壁上,轻轻摇动将黑色固体洗到溶液中。
③摘去橡皮塞,轻轻拉动注射器活塞,吸入少量空气,观察到无色气体变成红棕色。
④将注射器中少量溶液挤入淀粉溶液中,观察到淀粉溶液变为蓝色。
步骤①中排出空气的目的是
更新时间:2022-03-29 15:34:03
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】2021年10月16日神舟十三号载人飞船发射成功,肼是一种良好的火箭燃料,分子式N2H4,为无色油状液体,与水按任意比例互溶形成稳定的水合肼N2H4·H2O,沸点118℃,有强还原性。实验室先制备次氯酸钠,再与尿素[CO(NH2)2]反应制备水合肼,进一步脱水制得肼,实验装置如图所示(部分装置省略)。已知:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl。

(1)装置C中制备NaClO,反应过程中温度升高易产生副产物NaClO3,为提高NaClO产率实验中可采取的措施是___________ (写一条即可),该副反应的离子方程式为___________ 。反应完后关闭K1,装置B的作用是储存多余的Cl2,可用的试剂是___________
(2)将装置C中制备的溶液转移到装置D的___________ (填仪器名称)中,并缓缓滴入,原因是___________ 。
(3)装置D蒸馏获得水合肼粗品后,剩余溶液再进-步处理还可获得副产品NaCl和Na2CO3·10H2O,获得NaCl粗品的操作是___________ 。(NaCl和Na2CO3的溶解度曲线如图)。

(4)称取5.0g水合肼样品,加水配成500mL溶液,从中取出10.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,用0.200mol/L的I2溶液进行滴定,滴定终点的现象是___________ ,测得消耗I2溶液的体积为17.50mL,则样品中水合肼(N2H4·H2O)的质量百分数为___________ (保留3位有效数字)。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
(5)脱水制得的液态肼,在加热条件下可与新制的Cu(OH)2制备纳米级Cu2O,并产生无污染气体,写出该反应的化学方程式:___________ 。

(1)装置C中制备NaClO,反应过程中温度升高易产生副产物NaClO3,为提高NaClO产率实验中可采取的措施是
(2)将装置C中制备的溶液转移到装置D的
(3)装置D蒸馏获得水合肼粗品后,剩余溶液再进-步处理还可获得副产品NaCl和Na2CO3·10H2O,获得NaCl粗品的操作是

(4)称取5.0g水合肼样品,加水配成500mL溶液,从中取出10.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,用0.200mol/L的I2溶液进行滴定,滴定终点的现象是
(5)脱水制得的液态肼,在加热条件下可与新制的Cu(OH)2制备纳米级Cu2O,并产生无污染气体,写出该反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
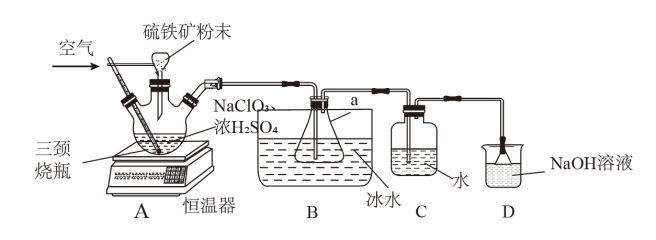
【推荐2】被世卫组织列为Al级新型高效安全消毒剂的二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,易溶于水,沸点为11℃,遇热不稳定易分解发生爆炸。工业上利用硫铁矿[主要成分为二硫化亚铁( )]还原氯酸钠(
)]还原氯酸钠( )制取二氧化氯。某研究小组利用如图装置制备
)制取二氧化氯。某研究小组利用如图装置制备 ,向三颈烧瓶中加入
,向三颈烧瓶中加入 溶液、浓
溶液、浓 通入空气,调节恒温器至60℃,通过固体加料器缓慢匀速加入硫铁矿粉末。请回答下列问题:
通入空气,调节恒温器至60℃,通过固体加料器缓慢匀速加入硫铁矿粉末。请回答下列问题:
(1) 中S元素的化合价为
中S元素的化合价为___________ 价;仪器a的名称是___________ 。
(2)三颈烧瓶中发生反应的离子方程式为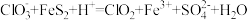 (未配平)。
(未配平)。
①该反应中被氧化的元素为___________ (填元素符号),还原产物为___________ (填化学式)。
②配平该离子方程式:___________ 。
(3)装置___________ (填“A”、“B”或“C”)为收集ClO2的装置;装置D中倒置漏斗的作用是___________ 。
(4)设计实验证明ClO2的氧化性比 的强:
的强:___________ 。
(5)将少量ClO2水溶液滴入盛有MnSO4溶液的试管中,振荡,有黑色沉淀生成,已知反应中氧化剂与还原剂的物质的量之比为2:5,则该反应的离子方程式为___________ 。
 )]还原氯酸钠(
)]还原氯酸钠( )制取二氧化氯。某研究小组利用如图装置制备
)制取二氧化氯。某研究小组利用如图装置制备 ,向三颈烧瓶中加入
,向三颈烧瓶中加入 溶液、浓
溶液、浓 通入空气,调节恒温器至60℃,通过固体加料器缓慢匀速加入硫铁矿粉末。请回答下列问题:
通入空气,调节恒温器至60℃,通过固体加料器缓慢匀速加入硫铁矿粉末。请回答下列问题:
(1)
 中S元素的化合价为
中S元素的化合价为(2)三颈烧瓶中发生反应的离子方程式为
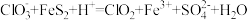 (未配平)。
(未配平)。①该反应中被氧化的元素为
②配平该离子方程式:
(3)装置
(4)设计实验证明ClO2的氧化性比
 的强:
的强:(5)将少量ClO2水溶液滴入盛有MnSO4溶液的试管中,振荡,有黑色沉淀生成,已知反应中氧化剂与还原剂的物质的量之比为2:5,则该反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】铜和三氧化二铁在工农业生产中用途广泛,用黄铜矿(主要成分为CuFeS2,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示
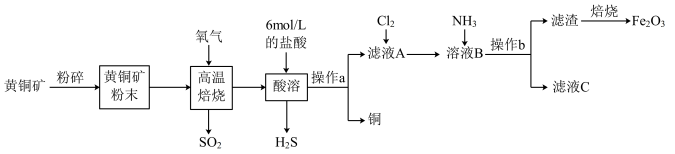
已知:FeS+2HCl=FeCl2+H2S↑、2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O
(1)高温焙烧时发生的反应是CuFeS2+O2 SO2+FeS+Cu,该反应中,氧化剂是
SO2+FeS+Cu,该反应中,氧化剂是_______ ;0.5molO2参加反应时,反应中转移电子_______ mol。
(2)Cl2具有较强的氧化性,Fe2+具有较强的还原性,写出向滤液A中通入氯气的离子方程式_______ 。
(3)向溶液B中通入NH3后发生反应的离子方程式为_______ 。
(4)操作b后检验滤渣已经洗涤干净的实验操作为_______ 。
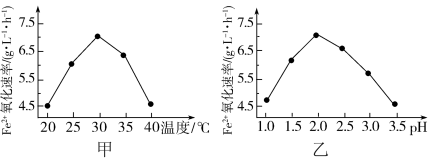
(5)工业上用生物法处理H2S的原理为(硫杆菌作催化剂):
H2S+Fe2(SO4)3 = S↓ + 2FeSO4 + H2SO4
4FeSO4+ O2+ 2H2SO4=2Fe2(SO4)3+2H2O
由图甲和图乙判断使用硫杆菌的最佳条件为_______ ,若反应温度过高,反应速率下降,其原因是_______ 。

已知:FeS+2HCl=FeCl2+H2S↑、2Fe(OH)3
 Fe2O3+3H2O
Fe2O3+3H2O(1)高温焙烧时发生的反应是CuFeS2+O2
 SO2+FeS+Cu,该反应中,氧化剂是
SO2+FeS+Cu,该反应中,氧化剂是(2)Cl2具有较强的氧化性,Fe2+具有较强的还原性,写出向滤液A中通入氯气的离子方程式
(3)向溶液B中通入NH3后发生反应的离子方程式为
(4)操作b后检验滤渣已经洗涤干净的实验操作为
(5)工业上用生物法处理H2S的原理为(硫杆菌作催化剂):
H2S+Fe2(SO4)3 = S↓ + 2FeSO4 + H2SO4
4FeSO4+ O2+ 2H2SO4=2Fe2(SO4)3+2H2O
由图甲和图乙判断使用硫杆菌的最佳条件为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】向硝酸酸化的2mL0.1mol•L-1AgNO3溶液(pH=2)中加入过量铁粉,振荡后静置,溶液先呈浅绿色,后逐渐呈棕黄色,试管底部仍存有黑色固体,过程中无气体生成。实验小组同学针对该实验现象进行如下探究。
Ⅰ.探究Fe2+产生的原因
(1)提出猜想:Fe2+可能是Fe与____ 或___ 反应的产物。
(2)实验探究:在两支试管中分别加入与上述实验等量的铁粉,再加入不同的液体试剂,5min后取上层清液,分别加入相同体积和浓度的铁氰化钾溶液
①2号试管中所用的试剂为____ 。
②资料显示:该温度下,0.1mol•L-1的AgNO3溶液可以将Fe氧化为Fe2+。但1号试管中未观察到蓝色沉淀的原因可能为____ 。
③小组同学继续进行实验,证明了2号试管得出的结论正确。实验如下:取100mL0.1mol•L-1硝酸酸化的AgNO3溶液(pH=2),加入铁粉井搅拌,分别插入pH传感器和NO3-传感器(传感器可检测离子浓度),得到如图图示,其中pH传感器测得的图示为___ (填“图甲”或“图乙”)。

④实验测得2号试管中有NH4+生成,则2号试管中发生反应的离子方程式为___ 。
Ⅱ.探究Fe3+产生的原因
查阅资料可知,反应中溶液逐渐变棕黄色是因为Fe2+被Ag+氧化。小组同学设计不同实验方案对此进行验证。
(3)方案一;取出少量黑色固体,洗涤后___ (填操作和现象),证明黑色固体中有Ag。
(4)方案二:按图连接装置,一段时间后取出左侧烧杯溶液,加入KSCN溶液,溶液变F红。该实验现象____ (填“能“或“不能“)证明Fe2+可被Ag+氧化,理由为__ 。

Ⅰ.探究Fe2+产生的原因
(1)提出猜想:Fe2+可能是Fe与
(2)实验探究:在两支试管中分别加入与上述实验等量的铁粉,再加入不同的液体试剂,5min后取上层清液,分别加入相同体积和浓度的铁氰化钾溶液
| 液体试剂 | 加入铁氰化钾溶液 | |
| 1号试管 | 2mL.0.1mol•L-1AgNO3溶液 | 无蓝色沉淀 |
| 2号试管 | ______ | 蓝色沉淀 |
②资料显示:该温度下,0.1mol•L-1的AgNO3溶液可以将Fe氧化为Fe2+。但1号试管中未观察到蓝色沉淀的原因可能为
③小组同学继续进行实验,证明了2号试管得出的结论正确。实验如下:取100mL0.1mol•L-1硝酸酸化的AgNO3溶液(pH=2),加入铁粉井搅拌,分别插入pH传感器和NO3-传感器(传感器可检测离子浓度),得到如图图示,其中pH传感器测得的图示为

④实验测得2号试管中有NH4+生成,则2号试管中发生反应的离子方程式为
Ⅱ.探究Fe3+产生的原因
查阅资料可知,反应中溶液逐渐变棕黄色是因为Fe2+被Ag+氧化。小组同学设计不同实验方案对此进行验证。
(3)方案一;取出少量黑色固体,洗涤后
(4)方案二:按图连接装置,一段时间后取出左侧烧杯溶液,加入KSCN溶液,溶液变F红。该实验现象

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中除含有硝酸锌外,还含有自来水带入的Cl-和Fe3+。在实验室里用“烂板液”制取ZnSO4·7H2O的过程如下:

(1)若稀硝酸腐蚀锌板时还原产物为NH4NO3,还原剂与氧化剂的物质的量之比是_________
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠,写出步骤①生成四羟基合锌酸钠的离子方程式___________________________
(3)若滤液E的pH=4,c(Zn2+)=2mol/L,c(Fe3+)=2.6×10-9mol/L能求得的溶度积是____ (填选项)
A.Ksp[Zn(OH)2]B.Ksp[Fe(OH)3]C.Ksp[Zn(OH)2]和Ksp[Fe(OH)3]
(4)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq)△H=akJ/mol
Fe3+(aq)+3OH-(aq)△H=akJ/mol
②H2O(l) H+(aq)+OH-(aq)△H=bkJ/mol
H+(aq)+OH-(aq)△H=bkJ/mol
请写出Fe3+发生水解反应的热化学方程式_____________________
(5)若常温下Fe(OH)3的溶度积常数为Ksp=4.0×10-38,H2O的离子积常数为Kw=10-14,Fe3+发生水解反应的平衡常数K=________ 。

(1)若稀硝酸腐蚀锌板时还原产物为NH4NO3,还原剂与氧化剂的物质的量之比是
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠,写出步骤①生成四羟基合锌酸钠的离子方程式
(3)若滤液E的pH=4,c(Zn2+)=2mol/L,c(Fe3+)=2.6×10-9mol/L能求得的溶度积是
A.Ksp[Zn(OH)2]B.Ksp[Fe(OH)3]C.Ksp[Zn(OH)2]和Ksp[Fe(OH)3]
(4)已知:①Fe(OH)3(s)
 Fe3+(aq)+3OH-(aq)△H=akJ/mol
Fe3+(aq)+3OH-(aq)△H=akJ/mol②H2O(l)
 H+(aq)+OH-(aq)△H=bkJ/mol
H+(aq)+OH-(aq)△H=bkJ/mol请写出Fe3+发生水解反应的热化学方程式
(5)若常温下Fe(OH)3的溶度积常数为Ksp=4.0×10-38,H2O的离子积常数为Kw=10-14,Fe3+发生水解反应的平衡常数K=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为 和
和 ,还有少量
,还有少量 、FeO、CaO、
、FeO、CaO、 和
和 等)为原料制备硼酸(
等)为原料制备硼酸( )的工艺流程如图所示:
)的工艺流程如图所示:
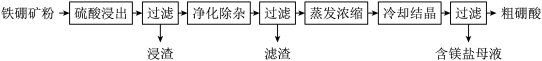
回答下列问题:
(1) 与硫酸反应产物为
与硫酸反应产物为 和硫酸镁,该反应的化学方程式为:
和硫酸镁,该反应的化学方程式为:_________ 。
(2)利用_________ (填化学式)的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是_________ (填化学式)。
(3)“净化除杂”需先加 溶液将
溶液将 氧化,该反应的离子方程式为:
氧化,该反应的离子方程式为:_________ ;然后再调节溶液的pH约为5,目的是_________ 。
(4)“粗硼酸”中的主要杂质是_________ (填化学式)。
 和
和 ,还有少量
,还有少量 、FeO、CaO、
、FeO、CaO、 和
和 等)为原料制备硼酸(
等)为原料制备硼酸( )的工艺流程如图所示:
)的工艺流程如图所示:
回答下列问题:
(1)
 与硫酸反应产物为
与硫酸反应产物为 和硫酸镁,该反应的化学方程式为:
和硫酸镁,该反应的化学方程式为:(2)利用
(3)“净化除杂”需先加
 溶液将
溶液将 氧化,该反应的离子方程式为:
氧化,该反应的离子方程式为:(4)“粗硼酸”中的主要杂质是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.64)
【推荐1】某液态卤代烃RX(R是烷基,X是某种卤素原子)的密度是ag/cm3.该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和HX.为了测定RX的相对分子质量,拟定的实验步骤如下:
①准确量取该卤代烷bmL,放入锥形瓶中.
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长导管的塞子,加热,发生反应.
③反应完成后,冷却溶液,加稀HNO3酸化,滴加过量AgNO3溶液得到白色沉淀.
④过滤、洗涤、干燥后称重,得到固体cg.
回答下列问题:
(1)装置中长导管的作用是________ .
(2)步骤④中,洗涤的目的是为了除去沉淀上吸附的________ 离子.
(3)该卤代烷中所含卤素的名称是________ ,判断的依据是____________________ .
(4)该卤代烷的相对分子质量是________ (列出算式即可).
(5)如果在步骤③中加的HNO3量不足,没有将溶液酸化,则步骤④中测得的c值________ (填下列选项代码).
①准确量取该卤代烷bmL,放入锥形瓶中.
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长导管的塞子,加热,发生反应.
③反应完成后,冷却溶液,加稀HNO3酸化,滴加过量AgNO3溶液得到白色沉淀.
④过滤、洗涤、干燥后称重,得到固体cg.
回答下列问题:
(1)装置中长导管的作用是
(2)步骤④中,洗涤的目的是为了除去沉淀上吸附的
(3)该卤代烷中所含卤素的名称是
(4)该卤代烷的相对分子质量是
(5)如果在步骤③中加的HNO3量不足,没有将溶液酸化,则步骤④中测得的c值
| A.偏大 | B.偏小 | C.不变 | D.大小不定 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】为更好地利用化学变化中的物质变化和能量变化,在化学研究和工业生产中还需要关注化学反应的快慢和进行程度等。实验发现,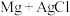 滤液反应比
滤液反应比 反应速率快,研究小组对此实验现象产生的原因进行了探究。
反应速率快,研究小组对此实验现象产生的原因进行了探究。
【提出猜想】
猜想一: 钻入
钻入 膜形成孔径,增大了Mg和
膜形成孔径,增大了Mg和 的接触面积,加快了
的接触面积,加快了 的反应速率,称作“离子钻入效应”;
的反应速率,称作“离子钻入效应”;
猜想二:在“离子钻入效应”基础上,Mg置换 形成许多微小的
形成许多微小的 原电池,使
原电池,使 反应速率进一步加快。
反应速率进一步加快。
【实验设计】
取表面积和质量相同的镁条(5cm),用浓度分别为1mol/LKCl、 、
、 溶液,按照下表进行系列实验,若有沉淀,先将沉淀过滤后,将滤液加入装Mg条的试管,观察Mg条表面实验现象。
溶液,按照下表进行系列实验,若有沉淀,先将沉淀过滤后,将滤液加入装Mg条的试管,观察Mg条表面实验现象。
(1)①根据表中信息,补充数据:a=__________ ,b=__________ 。
②由实验1和实验3对比可知: 有加快
有加快 反应速率的作用。
反应速率的作用。
③由实验__________ 和实验__________ 对比可知: 有加快
有加快 反应速率的作用。
反应速率的作用。
【实验结论1】猜想一和猜想二成立。
已知: 的水解离子方程式
的水解离子方程式
(2)为了进一步证明 原电池能加快
原电池能加快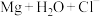 体系中
体系中 的反应速率,研究小组利用数字化实验进行了验证。
的反应速率,研究小组利用数字化实验进行了验证。
【实验设计】选取实验2和实验4两个实验方案,采集两个实验的pH-时间、温度-时间变化数据。实验数据如图所示:

④由初始pH数据可知,曲线__________ (填“a”或“b”)表示实验2的pH-时间变化曲线,请解释原因__________ 。
⑤在pH=11左右,两实验的pH变化都明显趋于平缓的原因__________ 。
⑥对“温度-时间”曲线分析,在相同反应时间内,__________ (填“实验2”或“实验4”)放热更多,因此速率更快。
【实验结论2】结合pH-时间、温度-时间曲线可知, 原电池能加快
原电池能加快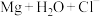 体系中
体系中 的反应速率。
的反应速率。
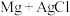 滤液反应比
滤液反应比 反应速率快,研究小组对此实验现象产生的原因进行了探究。
反应速率快,研究小组对此实验现象产生的原因进行了探究。【提出猜想】
猜想一:
 钻入
钻入 膜形成孔径,增大了Mg和
膜形成孔径,增大了Mg和 的接触面积,加快了
的接触面积,加快了 的反应速率,称作“离子钻入效应”;
的反应速率,称作“离子钻入效应”;猜想二:在“离子钻入效应”基础上,Mg置换
 形成许多微小的
形成许多微小的 原电池,使
原电池,使 反应速率进一步加快。
反应速率进一步加快。【实验设计】
取表面积和质量相同的镁条(5cm),用浓度分别为1mol/LKCl、
 、
、 溶液,按照下表进行系列实验,若有沉淀,先将沉淀过滤后,将滤液加入装Mg条的试管,观察Mg条表面实验现象。
溶液,按照下表进行系列实验,若有沉淀,先将沉淀过滤后,将滤液加入装Mg条的试管,观察Mg条表面实验现象。实验序号 |
|
|
|
|
| 实验现象 |
1 | / | / | / | 5.00 | 微小气泡附着 | |
2 | 4.50 | 0.50 | / | / | 大量气泡放出 | |
3 | 4.50 | / | / | 0.50 | 少量气泡放出 | |
4 | a | / | b | / | 少量气泡放出 |
②由实验1和实验3对比可知:
 有加快
有加快 反应速率的作用。
反应速率的作用。③由实验
 有加快
有加快 反应速率的作用。
反应速率的作用。【实验结论1】猜想一和猜想二成立。
已知:
 的水解离子方程式
的水解离子方程式
(2)为了进一步证明
 原电池能加快
原电池能加快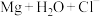 体系中
体系中 的反应速率,研究小组利用数字化实验进行了验证。
的反应速率,研究小组利用数字化实验进行了验证。【实验设计】选取实验2和实验4两个实验方案,采集两个实验的pH-时间、温度-时间变化数据。实验数据如图所示:

④由初始pH数据可知,曲线
⑤在pH=11左右,两实验的pH变化都明显趋于平缓的原因
⑥对“温度-时间”曲线分析,在相同反应时间内,
【实验结论2】结合pH-时间、温度-时间曲线可知,
 原电池能加快
原电池能加快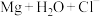 体系中
体系中 的反应速率。
的反应速率。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某校化学实验兴趣小组同学设计了如图所示的实验装置,利用如下原理探究氯气的某些性质反应原理: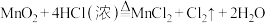 。
。
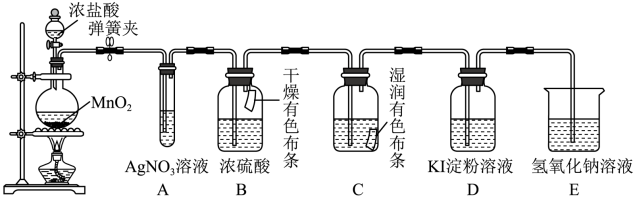
(1)A中产生现象是_______ ,甲同学认为是Cl2与水反应产生某新物质的结果,乙同学则认为A中的现象不足以说明白色沉淀是Cl2与水反应产生新物质的结果,理由是_______ 。
(2)B和C中出现的不同现象可得出的结论是_______ 。
(3)装置D中产生的现象是_______ ,该反应的基本反应类型是_______ 。
(4)E是尾气吸收装置,写出其中发生反应的离子方程式:_______ ,丙同学将充分吸收了尾气之后的吸收液拿来做实验,向吸收液中滴加盐酸,产生了有刺激性气味的气体,写出该反应的离子方程式_______ 。
(5)工业上用氯气和石灰乳反应可制漂白粉,漂白粉需要密闭保存,原因是(用化学方程式表示)_______ 。
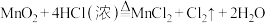 。
。
(1)A中产生现象是
(2)B和C中出现的不同现象可得出的结论是
(3)装置D中产生的现象是
(4)E是尾气吸收装置,写出其中发生反应的离子方程式:
(5)工业上用氯气和石灰乳反应可制漂白粉,漂白粉需要密闭保存,原因是(用化学方程式表示)
您最近一年使用:0次