完成下列填空
(1)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=−534 kJ∙mol−1
H2O2(l)=H2O(l)+ O2(g) ΔH=−98 kJ∙mol−1
O2(g) ΔH=−98 kJ∙mol−1
H2O(l)=H2O(g) ΔH=44 kJ∙mol−1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式:_______ 。
(2)反应的自发性由焓变和熵变两个因素决定。N2(g)+O2(g)=2NO(g),已知N≡N的键能为946 kJ∙mol−1,O=O键的键能为498 kJ∙mol−1,N≡O的键能为630 kJ∙mol−1;该反应的ΔH=_______ ,其反应自发的原因是_______ 。
(3)以纯铜作阴极,以石墨作阳极,电解某浓度的硫酸铜溶液,阴极产物均附在电极上,通电一段时间后,关闭电源,迅速撤去电极(设阴极产物没有损耗),若在电解后的溶液中加入16.0gCuO固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体体积为(标准状况)_______ L。
(4)科学家设计利用电化学原理回收CO2达到减排的目的,实验装置如图所示。
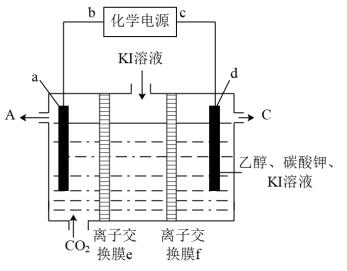
已知在碱性条件下,卤素单质可以和乙醇反应。假设理想状态下,该装置能将a电极的CO2全部转化成HCOO-。
①则b为_______ 极(填“正”或“负”),a电极的电极反应式为_______ 。
②标准状况下,当有4mol电子转移时,回收的 CO2为_______ L。
(1)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=−534 kJ∙mol−1
H2O2(l)=H2O(l)+
 O2(g) ΔH=−98 kJ∙mol−1
O2(g) ΔH=−98 kJ∙mol−1H2O(l)=H2O(g) ΔH=44 kJ∙mol−1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式:
(2)反应的自发性由焓变和熵变两个因素决定。N2(g)+O2(g)=2NO(g),已知N≡N的键能为946 kJ∙mol−1,O=O键的键能为498 kJ∙mol−1,N≡O的键能为630 kJ∙mol−1;该反应的ΔH=
(3)以纯铜作阴极,以石墨作阳极,电解某浓度的硫酸铜溶液,阴极产物均附在电极上,通电一段时间后,关闭电源,迅速撤去电极(设阴极产物没有损耗),若在电解后的溶液中加入16.0gCuO固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体体积为(标准状况)
(4)科学家设计利用电化学原理回收CO2达到减排的目的,实验装置如图所示。

已知在碱性条件下,卤素单质可以和乙醇反应。假设理想状态下,该装置能将a电极的CO2全部转化成HCOO-。
①则b为
②标准状况下,当有4mol电子转移时,回收的 CO2为
更新时间:2022-04-02 07:59:32
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________ (填“吸热”或“放热”)反应。
②已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________ 。
(2)N2H4和H2O2混合可作火箭推进剂,已知:16g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6kJ的热量;2H2O2(l) O2(g)+2H2O(l)ΔH=-196.4kJ·mol-1。反应N2H4(l)+O2(g)
O2(g)+2H2O(l)ΔH=-196.4kJ·mol-1。反应N2H4(l)+O2(g) N2(g)+2H2O(l)的ΔH=
N2(g)+2H2O(l)的ΔH=____ kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为_______________
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为________
(4)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)ΔH=-akJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g)ΔH=+bkJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)ΔH=-ckJ/mol
2H2(g)+O2(g)=2H2O(l)ΔH=-dkJ/mol(a、b、c、d均为正值)
判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量________ (填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为
②已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
(2)N2H4和H2O2混合可作火箭推进剂,已知:16g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6kJ的热量;2H2O2(l)
 O2(g)+2H2O(l)ΔH=-196.4kJ·mol-1。反应N2H4(l)+O2(g)
O2(g)+2H2O(l)ΔH=-196.4kJ·mol-1。反应N2H4(l)+O2(g) N2(g)+2H2O(l)的ΔH=
N2(g)+2H2O(l)的ΔH=(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为
(4)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)ΔH=-akJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g)ΔH=+bkJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)ΔH=-ckJ/mol
2H2(g)+O2(g)=2H2O(l)ΔH=-dkJ/mol(a、b、c、d均为正值)
判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】一定条件下 参加反应的热化学方程式如下:
参加反应的热化学方程式如下:
ⅰ.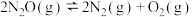
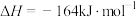 ;
;
ⅱ.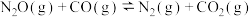
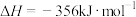 。
。
回答下列问题:
(1)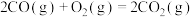

_______  。
。
(2)若在恒容绝热密闭容器中进行反应ⅱ,下列说法一定正确的是_______ (填字母)。
a.加入催化剂,可以提高 的平衡产率
的平衡产率
b.体系温度不再发生变化时,反应达到化学平衡状态
c.平衡体系中, 和CO的物质的量之比为1∶1
和CO的物质的量之比为1∶1
d.其他条件不变,增大CO的浓度,能提高 的平衡转化率
的平衡转化率
(3)将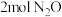 充入一恒容密闭容器中,发生反应ⅰ,测得平衡时
充入一恒容密闭容器中,发生反应ⅰ,测得平衡时 的体积分数与温度和压强的关系如图所示。
的体积分数与温度和压强的关系如图所示。

①压强
_______ (填“>”“<”或“=”) ,判断依据是
,判断依据是_______ 。
②若b点纵坐标为20,压强为10atm,该温度下平衡常数
_______ atm。
③已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数,R>0)。活化能越大,温度对速率常数的影响越
为活化能,k为速率常数,R和C为常数,R>0)。活化能越大,温度对速率常数的影响越_______ (填“大”或“小”),根据该公式,温度升高,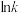
_______ (填“变大”“变小”或“不变”)。
 参加反应的热化学方程式如下:
参加反应的热化学方程式如下:ⅰ.
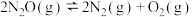
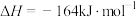 ;
;ⅱ.
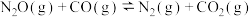
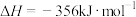 。
。回答下列问题:
(1)
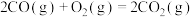

 。
。(2)若在恒容绝热密闭容器中进行反应ⅱ,下列说法一定正确的是
a.加入催化剂,可以提高
 的平衡产率
的平衡产率b.体系温度不再发生变化时,反应达到化学平衡状态
c.平衡体系中,
 和CO的物质的量之比为1∶1
和CO的物质的量之比为1∶1d.其他条件不变,增大CO的浓度,能提高
 的平衡转化率
的平衡转化率(3)将
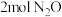 充入一恒容密闭容器中,发生反应ⅰ,测得平衡时
充入一恒容密闭容器中,发生反应ⅰ,测得平衡时 的体积分数与温度和压强的关系如图所示。
的体积分数与温度和压强的关系如图所示。
①压强

 ,判断依据是
,判断依据是②若b点纵坐标为20,压强为10atm,该温度下平衡常数

③已知Arrhenius经验公式为
 (
( 为活化能,k为速率常数,R和C为常数,R>0)。活化能越大,温度对速率常数的影响越
为活化能,k为速率常数,R和C为常数,R>0)。活化能越大,温度对速率常数的影响越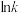
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】
(1)氨的合成是最重要的化工生产之一,工业上合成氨用的H2有多种制取的方法。用天然气跟水蒸气反应:CH4(g)+H2O(g)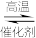 CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________ 。

(2)已知通常状况下,每充分燃烧1gCO并恢复到原状态,会释放10KJ的热量。请写出表示CO燃烧热的热化学反应方程式:________________________________ 。
(3)一种甲烷燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接通入甲烷,同时向一个电极通入空气。此电池的负极电极反应式是_______________ 。
(4)利用右图装置可以模拟铁的电化学防护。

① 若X为碳棒,为减缓铁的腐蚀,开关K应置于______ 处。假设海水中只有NaCl溶质,写出此时总离子反应方程式:__________________________________________ 。
② 若X为锌,开关K置于M处,该电化学防护法称为_________ 。写出铁电极处的电极反应式:_____________________________ 。
(1)氨的合成是最重要的化工生产之一,工业上合成氨用的H2有多种制取的方法。用天然气跟水蒸气反应:CH4(g)+H2O(g)
 CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=
(2)已知通常状况下,每充分燃烧1gCO并恢复到原状态,会释放10KJ的热量。请写出表示CO燃烧热的热化学反应方程式:
(3)一种甲烷燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接通入甲烷,同时向一个电极通入空气。此电池的负极电极反应式是
(4)利用右图装置可以模拟铁的电化学防护。

① 若X为碳棒,为减缓铁的腐蚀,开关K应置于
② 若X为锌,开关K置于M处,该电化学防护法称为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】“绿水青山就是金山银山”,研究并消除氮氧化物污染对建设美丽家乡,打造宜居环境有重要意义。
(1)已知: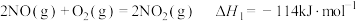
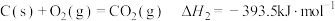
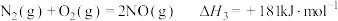
若某反应的平衡常数表达式为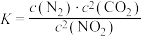 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式_______ 。
(2) 时,存在如下平衡:
时,存在如下平衡: 。该反应正逆反应速率与
。该反应正逆反应速率与 、
、 的浓度关系为:
的浓度关系为: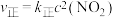 ,
,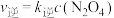 (
( 、
、 是速率常数),且
是速率常数),且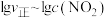 与
与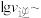
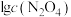 的关系如图所示。
的关系如图所示。
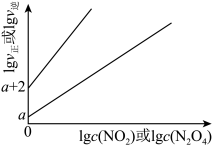
① 时,该反应的平衡常数
时,该反应的平衡常数
_______ 。
② 时,往刚性容器中充入一定量
时,往刚性容器中充入一定量 ,平衡后测得
,平衡后测得 为
为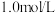 ,则平衡时
,则平衡时 的物质的量分数为
的物质的量分数为_______ (以分数表示)。
(3)用活性炭还原法处理氮氧化物的有关反应为: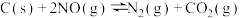 。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在
。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在 时刻改变某一条件,其反应过程如图所示。
时刻改变某一条件,其反应过程如图所示。
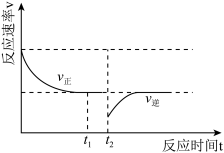
①则 时刻改变的条件为
时刻改变的条件为_______ 。
② 时刻的
时刻的
_______  时刻的
时刻的 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)在恒容密闭容器中发生反应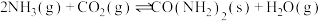
 。下列说法正确的是_______。
。下列说法正确的是_______。
(1)已知:
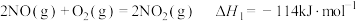
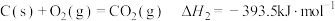
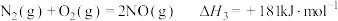
若某反应的平衡常数表达式为
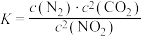 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(2)
 时,存在如下平衡:
时,存在如下平衡: 。该反应正逆反应速率与
。该反应正逆反应速率与 、
、 的浓度关系为:
的浓度关系为: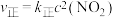 ,
,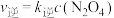 (
( 、
、 是速率常数),且
是速率常数),且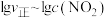 与
与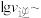
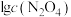 的关系如图所示。
的关系如图所示。
①
 时,该反应的平衡常数
时,该反应的平衡常数
②
 时,往刚性容器中充入一定量
时,往刚性容器中充入一定量 ,平衡后测得
,平衡后测得 为
为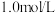 ,则平衡时
,则平衡时 的物质的量分数为
的物质的量分数为(3)用活性炭还原法处理氮氧化物的有关反应为:
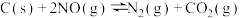 。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在
。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在 时刻改变某一条件,其反应过程如图所示。
时刻改变某一条件,其反应过程如图所示。
①则
 时刻改变的条件为
时刻改变的条件为②
 时刻的
时刻的
 时刻的
时刻的 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)在恒容密闭容器中发生反应
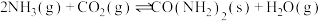
 。下列说法正确的是_______。
。下列说法正确的是_______。A.及时分离出生成的尿素,有利于 的转化率增大 的转化率增大 |
| B.反应达到平衡后,混合气体的密度不再发生改变 |
| C.反应在任何温度下都能自发进行 |
| D.当尿素的质量不变时,说明反应达到平衡 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】(1)已知下列热化学方程式:
a.H2(g)+ O2(g)═H2O(l);△H=-285.8kJ•mol-1
O2(g)═H2O(l);△H=-285.8kJ•mol-1
b.H2(g)+ O2(g)═H2O(g);△H=-241.8kJ•mol-1
O2(g)═H2O(g);△H=-241.8kJ•mol-1
c.CO(g)═C(s)+ O2(g);△H=+110.5kJ•mol-1
O2(g);△H=+110.5kJ•mol-1
d.C(s)+O2(g)═CO2(g);△H=-393.5kJ•mol-1
回答下列问题:
①上述反应中属于吸热反应的是________
②CO的燃烧热△H=________ 。表示CO燃烧热的热化学方程式为________ 。
③燃烧10g H2生成液态水,放出的热量为________ 。
(2)可以用反应的△H和△S的正、负来判断该反应自发进行的可能性和自发进行的条件。函数△G就是一个判断的依据:△G=△H-T△S式中T为反应的温度(开尔文温度,没有负值)。
①当一个反应的△G___________ 0(填“>”、“<”或“=”)时,反应一定能自发进行。
②当△H<0,△S<0,温度___________ (填“较高”或“较低”)时能自发反应。
a.H2(g)+
 O2(g)═H2O(l);△H=-285.8kJ•mol-1
O2(g)═H2O(l);△H=-285.8kJ•mol-1b.H2(g)+
 O2(g)═H2O(g);△H=-241.8kJ•mol-1
O2(g)═H2O(g);△H=-241.8kJ•mol-1c.CO(g)═C(s)+
 O2(g);△H=+110.5kJ•mol-1
O2(g);△H=+110.5kJ•mol-1d.C(s)+O2(g)═CO2(g);△H=-393.5kJ•mol-1
回答下列问题:
①上述反应中属于吸热反应的是
②CO的燃烧热△H=
③燃烧10g H2生成液态水,放出的热量为
(2)可以用反应的△H和△S的正、负来判断该反应自发进行的可能性和自发进行的条件。函数△G就是一个判断的依据:△G=△H-T△S式中T为反应的温度(开尔文温度,没有负值)。
①当一个反应的△G
②当△H<0,△S<0,温度
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】钛被称为继铁、铝之后的第三金属,性能优越,广泛用于航天航空等领域,有人说“21世纪将是钛的世纪”。冶炼金属钛的主要原料为钛铁矿(主要成分 ,含FeO、
,含FeO、 等杂质),其冶炼过程如图所示,除了得到金属钛,还可以得到副产物绿矾(
等杂质),其冶炼过程如图所示,除了得到金属钛,还可以得到副产物绿矾( )。
)。
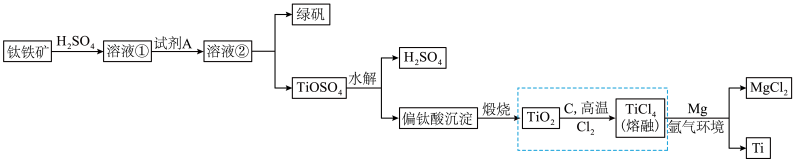
(1)Ti在元素周期表中的位置为___________ , 的键角
的键角___________  分子的键角(填“>”“<”或“=”)。
分子的键角(填“>”“<”或“=”)。
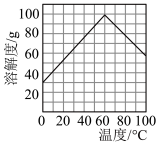
(2)试剂A为___________ 。已知绿矾的溶解度随温度变化的曲线如下图所示,获得从溶液②绿矾的操作方法为___________ ,过滤、洗涤、干燥。
(3)已知常温下,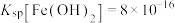 ,若溶液②中
,若溶液②中 ,为防止生成
,为防止生成 沉淀,溶液的pH不超过
沉淀,溶液的pH不超过___________ ( )。
)。
(4) 水解生成偏钛酸(
水解生成偏钛酸( )沉淀的化学方程式为
)沉淀的化学方程式为___________ 。虚线框内的流程是经过大量科学研究后得到的方法,科学家原来的设想为
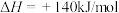 ,但无法实现,试从反应自发性角度来解释该设想无法实现的原因
,但无法实现,试从反应自发性角度来解释该设想无法实现的原因___________ 。
(5) 的水解程度很大,可以利用其稀溶液制备纳米级
的水解程度很大,可以利用其稀溶液制备纳米级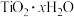 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
 ,含FeO、
,含FeO、 等杂质),其冶炼过程如图所示,除了得到金属钛,还可以得到副产物绿矾(
等杂质),其冶炼过程如图所示,除了得到金属钛,还可以得到副产物绿矾( )。
)。
(1)Ti在元素周期表中的位置为
 的键角
的键角 分子的键角(填“>”“<”或“=”)。
分子的键角(填“>”“<”或“=”)。(2)试剂A为

(3)已知常温下,
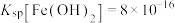 ,若溶液②中
,若溶液②中 ,为防止生成
,为防止生成 沉淀,溶液的pH不超过
沉淀,溶液的pH不超过 )。
)。(4)
 水解生成偏钛酸(
水解生成偏钛酸( )沉淀的化学方程式为
)沉淀的化学方程式为
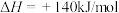 ,但无法实现,试从反应自发性角度来解释该设想无法实现的原因
,但无法实现,试从反应自发性角度来解释该设想无法实现的原因(5)
 的水解程度很大,可以利用其稀溶液制备纳米级
的水解程度很大,可以利用其稀溶液制备纳米级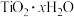 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】1909年,化学家哈伯用N2和H2在高温高压条件下首次合成了氨气,反应原理为N2(g)+3H2(g) 2NH3(g),该反应的能量变化如图1所示(a、b均大于零),回答下列问题:
2NH3(g),该反应的能量变化如图1所示(a、b均大于零),回答下列问题:

(1)根据图1写出生成2molNH3时的热化学方程式:___________ 。
(2)在500°C、30MPa下,断裂1 molH—H键、1molN—H键、1 molN≡N键需要吸收的能量分别为436 kJ、391kJ、946kJ。
①每消耗0.5molN2该反应放出的热量为___________ 。
②向某一密闭容器中充入1.5molH2(g)和0.5molN2(g),在催化剂条件下进行上述反应,此时断裂的H—H键吸收的热量___________ (填“>”,“<”或“=”)436×1.5=654(kJ)。
(3)一种用电化学法合成氨的原理装置如图2所示:

①电极B的名称是___________ (填“阴极”或“阳极”)。
②图2中阳极的电极反应式为___________ 。
③若图2中支持电解质改为质子导体陶瓷膜,则阴极的电极反应式为___________
 2NH3(g),该反应的能量变化如图1所示(a、b均大于零),回答下列问题:
2NH3(g),该反应的能量变化如图1所示(a、b均大于零),回答下列问题:
(1)根据图1写出生成2molNH3时的热化学方程式:
(2)在500°C、30MPa下,断裂1 molH—H键、1molN—H键、1 molN≡N键需要吸收的能量分别为436 kJ、391kJ、946kJ。
①每消耗0.5molN2该反应放出的热量为
②向某一密闭容器中充入1.5molH2(g)和0.5molN2(g),在催化剂条件下进行上述反应,此时断裂的H—H键吸收的热量
(3)一种用电化学法合成氨的原理装置如图2所示:

①电极B的名称是
②图2中阳极的电极反应式为
③若图2中支持电解质改为质子导体陶瓷膜,则阴极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
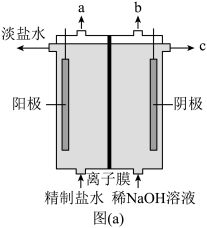
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许_______ 离子通过(填离子符号),氯气的逸出口是_______ (填标号)。
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=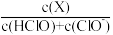 ,X为HClO或ClO-]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO-]与pH的关系如图(b)所示。HClO的电离常数Ka值为_______ 。

(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为_______ 。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。产生“气泡”的化学方程式为_______ 。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是_______ (用离子方程式表示)。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=
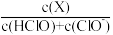 ,X为HClO或ClO-]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO-]与pH的关系如图(b)所示。HClO的电离常数Ka值为
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。产生“气泡”的化学方程式为
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
【推荐3】在庆祝祖国成立70周年的大阅兵上,我国航空领域的发展成就得到了充分展示,钼及其合金在冶金和航空等方面有着广泛的应用。请回答下列有关问题:
Ⅰ.已知: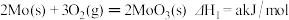

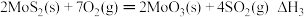
则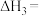
________ (用含 、
、 的代数式表示)。
的代数式表示)。
Ⅱ.用氢气还原辉钼矿制取钼的原理为:
 。
。

(1)一定温度下,在容积固定的密闭容器中进行该反应,下列能说明反应已达到平衡状态的是________ (填序号)。
A.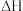 不再发生变化 B.气体密度不再发生变化 C.
不再发生变化 B.气体密度不再发生变化 C.
D. 的体积分数保持不变 E.混合气体的平均相对分子质量不再发生变化
的体积分数保持不变 E.混合气体的平均相对分子质量不再发生变化
(2)在密闭容器中进行该反应,实验测得正、逆反应的平衡常数 与温度
与温度 的关系变化曲线如图1所示,则温度为
的关系变化曲线如图1所示,则温度为 时,该反应的平衡常数
时,该反应的平衡常数
________ 。
(3)在密闭容器中进行该反应,不同压强下,氢气的平衡转化率与温度的关系如图2所示。
① 点的正反应速率
点的正反应速率________  点的逆反应速率(填“>”、“=”或“<”);理由是
点的逆反应速率(填“>”、“=”或“<”);理由是_________ 。
② 点对应的平衡常数
点对应的平衡常数
_________ 。(用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数)
Ⅲ.电氧化法提纯钼的原理为:将已经浆化的辉钼矿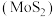 加入到装有氯化钠溶液的电解槽中,在电氧化过程中,阳极产物
加入到装有氯化钠溶液的电解槽中,在电氧化过程中,阳极产物 又与水反应,生成次氯酸根,次氯酸根再把
又与水反应,生成次氯酸根,次氯酸根再把 氧化为
氧化为 和
和 形态进入溶液中。
形态进入溶液中。
(1)辉钼矿应放入电解槽的_________ (填“阴极区”或“阳极区”)。
(2)写出 被氧化的离子方程式
被氧化的离子方程式_________ 。
Ⅰ.已知:
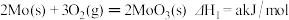

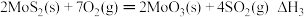
则
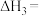
 、
、 的代数式表示)。
的代数式表示)。Ⅱ.用氢气还原辉钼矿制取钼的原理为:
 。
。
(1)一定温度下,在容积固定的密闭容器中进行该反应,下列能说明反应已达到平衡状态的是
A.
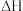 不再发生变化 B.气体密度不再发生变化 C.
不再发生变化 B.气体密度不再发生变化 C.
D.
 的体积分数保持不变 E.混合气体的平均相对分子质量不再发生变化
的体积分数保持不变 E.混合气体的平均相对分子质量不再发生变化(2)在密闭容器中进行该反应,实验测得正、逆反应的平衡常数
 与温度
与温度 的关系变化曲线如图1所示,则温度为
的关系变化曲线如图1所示,则温度为 时,该反应的平衡常数
时,该反应的平衡常数
(3)在密闭容器中进行该反应,不同压强下,氢气的平衡转化率与温度的关系如图2所示。
①
 点的正反应速率
点的正反应速率 点的逆反应速率(填“>”、“=”或“<”);理由是
点的逆反应速率(填“>”、“=”或“<”);理由是②
 点对应的平衡常数
点对应的平衡常数
Ⅲ.电氧化法提纯钼的原理为:将已经浆化的辉钼矿
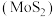 加入到装有氯化钠溶液的电解槽中,在电氧化过程中,阳极产物
加入到装有氯化钠溶液的电解槽中,在电氧化过程中,阳极产物 又与水反应,生成次氯酸根,次氯酸根再把
又与水反应,生成次氯酸根,次氯酸根再把 氧化为
氧化为 和
和 形态进入溶液中。
形态进入溶液中。(1)辉钼矿应放入电解槽的
(2)写出
 被氧化的离子方程式
被氧化的离子方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:
(1)在一定温度下,向体积固定 的密闭容器中加入足量的C(s)和1molH2O(g),起始压强为0.2MPa时,发生下列反应生成水煤气:
Ⅰ、C(s)+H2O(g) CO(g)+H2(g) △H1=+131.4kJ/mol
CO(g)+H2(g) △H1=+131.4kJ/mol
Ⅱ、CO(g)+H2O(g) CO2(g)+H2(g) △H2=-41.1kJ/mol
CO2(g)+H2(g) △H2=-41.1kJ/mol
①上述反应达平衡后,若升高温度,则CO的平衡体积分数___________ (填“增大”、“减小”或“不变”),其理由是___________ ;
②下列说法正确的是___________ ;
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.加入合适催化剂,可以提高H2O(g)的平衡转化率
D.将炭块粉碎,可加快反应速率
③反应Ⅰ、Ⅱ均达平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1mol。求反应Ⅰ的平衡常数Kp=___________ MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)工业上常用电解法制备物质,回答下列问题:
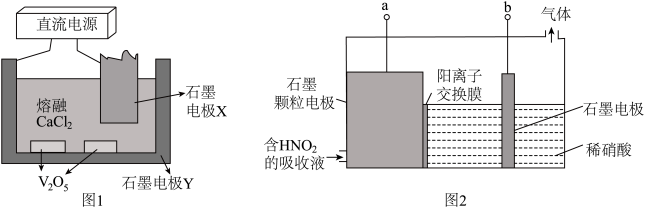
①电解V2O5制备金属钒的装置如图1所示,熔融CaCl2可传导O2-。则石墨电极Y接直流电源___________ (填“正极”或“负极”),阴极电极反应式为___________ 。
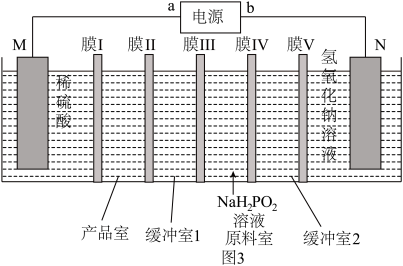
②工业上脱硝常用6%的稀硝酸吸收NOx生成HNO2(提示:HNO2为弱酸),再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图2所示。
i、当电路中有0.4mol电子转移时,有___________ molH+需要通过阳离子交换膜发生移动。
ii、阳极电极反应式为___________ 。
③用金属钴和不锈钢作电极材料,通过电渗析法制取Co(H2PO2)2的原理如图3所示。N的电极材料是___________ (填“金属钴”或“不锈钢”),M极的电极反应式为___________ ,膜Ⅱ为___________ (填“阴”或“阳”)离子变换膜。
(1)在一定温度下,向
Ⅰ、C(s)+H2O(g)
 CO(g)+H2(g) △H1=+131.4kJ/mol
CO(g)+H2(g) △H1=+131.4kJ/molⅡ、CO(g)+H2O(g)
 CO2(g)+H2(g) △H2=-41.1kJ/mol
CO2(g)+H2(g) △H2=-41.1kJ/mol①上述反应达平衡后,若升高温度,则CO的平衡体积分数
②下列说法正确的是
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.加入合适催化剂,可以提高H2O(g)的平衡转化率
D.将炭块粉碎,可加快反应速率
③反应Ⅰ、Ⅱ均达平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1mol。求反应Ⅰ的平衡常数Kp=
(2)工业上常用电解法制备物质,回答下列问题:
①电解V2O5制备金属钒的装置如图1所示,熔融CaCl2可传导O2-。则石墨电极Y接直流电源

②工业上脱硝常用6%的稀硝酸吸收NOx生成HNO2(提示:HNO2为弱酸),再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图2所示。
i、当电路中有0.4mol电子转移时,有
ii、阳极电极反应式为
③用金属钴和不锈钢作电极材料,通过电渗析法制取Co(H2PO2)2的原理如图3所示。N的电极材料是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】2019年诺贝尔化学奖颁给了三位为锂离子电池发展做出巨大贡献的科学家,锂离子电池广泛应用于手机、笔记本电脑等。
(1)锂元素核外电子排布式:_________________ 。
(2)氧化锂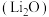 是制备锂离子电池的重要原料,氧化锂的电子式为
是制备锂离子电池的重要原料,氧化锂的电子式为_____________ 。
(3)近日华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出了石墨烯电池,电池反应式为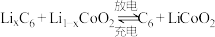 ,其工作原理如图。
,其工作原理如图。
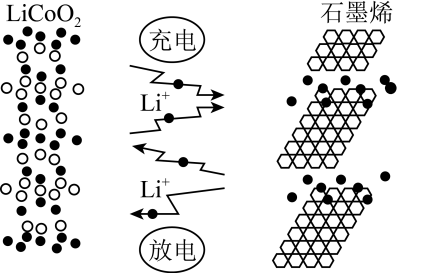
①石墨烯的优点是提高电池的能量密度,石墨烯为层状结构,层与层之间存在的作用力是__________ 。
②锂离子电池不能用水溶液做离子导体的原因是__________ (用离子方程式表示)。
③锂离子电池放电时正极的电极反应式为_______________ 。
④用该锂离子电池电解500mL的 溶液,通电一段时间后,某电极质量增加0.64g(设电解时无
溶液,通电一段时间后,某电极质量增加0.64g(设电解时无 放出,且不考虑水解和溶液体积变化)。如果此时要恢复原来溶液的成分和浓度需要加入
放出,且不考虑水解和溶液体积变化)。如果此时要恢复原来溶液的成分和浓度需要加入______ ,加入的质量为______ g。
(1)锂元素核外电子排布式:
(2)氧化锂
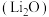 是制备锂离子电池的重要原料,氧化锂的电子式为
是制备锂离子电池的重要原料,氧化锂的电子式为(3)近日华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出了石墨烯电池,电池反应式为
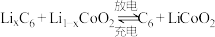 ,其工作原理如图。
,其工作原理如图。
①石墨烯的优点是提高电池的能量密度,石墨烯为层状结构,层与层之间存在的作用力是
②锂离子电池不能用水溶液做离子导体的原因是
③锂离子电池放电时正极的电极反应式为
④用该锂离子电池电解500mL的
 溶液,通电一段时间后,某电极质量增加0.64g(设电解时无
溶液,通电一段时间后,某电极质量增加0.64g(设电解时无 放出,且不考虑水解和溶液体积变化)。如果此时要恢复原来溶液的成分和浓度需要加入
放出,且不考虑水解和溶液体积变化)。如果此时要恢复原来溶液的成分和浓度需要加入
您最近一年使用:0次
【推荐3】化学能与电能之间的相互转化与人类的生活实际密切相关,在生产、生活中有重要的应用,同时也是学生形成化学学科核心素养的重要组成部分。
(1)熔融状态下,钠的单质和氯化亚铁能组成可充电电池,工作原理如图所示,反应原理为 ,该电池放电时,正极反应式为
,该电池放电时,正极反应式为___________ ;充电时,___________ (写物质名称)电极接电源的负极;该电池的电解质为___________ 。

(2)某同学用铜片、石墨作电极电解一定浓度的硫酸铜溶液,工作原理如图所示,一段时间后停止通电取出电极。若在电解后的溶液中加入0.98g氢氧化铜粉末恰好完全溶解,经测定所得的溶液与电解前完全相同。请回答下列问题:
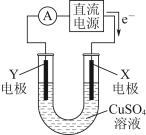
①Y电极材料是___________ 。
②电解过程中X电极上发生的电极反应是___________ 。
③如在电解后的溶液中加入足量的小苏打,充分反应后产生的气体在标准状况下所占的体积是___________ 。
(1)熔融状态下,钠的单质和氯化亚铁能组成可充电电池,工作原理如图所示,反应原理为
 ,该电池放电时,正极反应式为
,该电池放电时,正极反应式为
(2)某同学用铜片、石墨作电极电解一定浓度的硫酸铜溶液,工作原理如图所示,一段时间后停止通电取出电极。若在电解后的溶液中加入0.98g氢氧化铜粉末恰好完全溶解,经测定所得的溶液与电解前完全相同。请回答下列问题:

①Y电极材料是
②电解过程中X电极上发生的电极反应是
③如在电解后的溶液中加入足量的小苏打,充分反应后产生的气体在标准状况下所占的体积是
您最近一年使用:0次



