金属钼在工业和国防建设中有重要的作用。钼(Mo)的常见化合价为+6、+5、+4。由钼精矿(主要成分是MoS2)可制备单质钼和钼酸钠晶体(Na2MoO4•2H2O),部分流程如图所示:
已知:钼酸微溶于水,可溶于碱液和氨水。
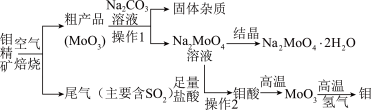
回答下列问题:
(1)氧化焙烧时产生烧结现象,故用Na2CO3溶液浸取前需进行粉碎处理、其目的是____ 。
(2)焙烧炉中也会发生MoS2与MoO3生成MoO2和SO2的反应,写出该反应的化学方程式:____ 。
(3)在强碱性条件下NaClO将MoS2氧化为Na2MoO4和Na2SO4,该反应的离子方程式为:____ 。
(4)锂和二硫化钼形成的二次电池的总反应为xLi+nMoS2 Lix(MoS2)n,则电池放电时正极的电极反应式为
Lix(MoS2)n,则电池放电时正极的电极反应式为____ 。
已知:钼酸微溶于水,可溶于碱液和氨水。

回答下列问题:
(1)氧化焙烧时产生烧结现象,故用Na2CO3溶液浸取前需进行粉碎处理、其目的是
(2)焙烧炉中也会发生MoS2与MoO3生成MoO2和SO2的反应,写出该反应的化学方程式:
(3)在强碱性条件下NaClO将MoS2氧化为Na2MoO4和Na2SO4,该反应的离子方程式为:
(4)锂和二硫化钼形成的二次电池的总反应为xLi+nMoS2
 Lix(MoS2)n,则电池放电时正极的电极反应式为
Lix(MoS2)n,则电池放电时正极的电极反应式为
2021·新疆·二模 查看更多[2]
更新时间:2022-04-15 19:48:54
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】二氧化铈是一种应用广泛的稀土氧化物,以氟碳铈矿(含 、
、 、
、 、
、 等)为原料制备二氧化铈并回收锰,其工艺流程如下图:
等)为原料制备二氧化铈并回收锰,其工艺流程如下图:

已知:①“还原脱锰”步骤中 未参与反应。
未参与反应。
②还原性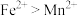 ,
, 能与
能与 反应生成黑色
反应生成黑色 。
。
③ 与
与 结合生成
结合生成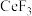 沉淀。
沉淀。
回答下列问题:
(1) 中
中 元素的化合价为
元素的化合价为___________ ;已知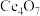 中
中 元素的化合价有+3、+4两种价态,则两者的比例为
元素的化合价有+3、+4两种价态,则两者的比例为___________ 。
(2)“还原脱锰”步骤的还原产物有___________ ,“氧化焙烧”步骤发生的氧化还原反应的化学方程式为___________ 。
(3)写出“沉锰”步骤的离子反应方程式:___________ 。
(4)若不进行“水浸”步骤,直接将“氧化焙烧”产物进行“酸浸”,可能造成的后果是_____ 。
(5)工业上常采用EDTA滴定法测定水浸液中 含量。向锥形瓶中加入
含量。向锥形瓶中加入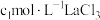 标准溶液
标准溶液 ,再加入
,再加入 水浸液,用
水浸液,用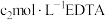 标准溶液进行滴定,消耗标准溶液
标准溶液进行滴定,消耗标准溶液 ,则水浸液中
,则水浸液中 浓度为
浓度为_______  。(反应原理为
。(反应原理为 ,
, 与EDTA按物质的量之比
与EDTA按物质的量之比 反应)
反应)
 、
、 、
、 、
、 等)为原料制备二氧化铈并回收锰,其工艺流程如下图:
等)为原料制备二氧化铈并回收锰,其工艺流程如下图:
已知:①“还原脱锰”步骤中
 未参与反应。
未参与反应。②还原性
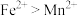 ,
, 能与
能与 反应生成黑色
反应生成黑色 。
。③
 与
与 结合生成
结合生成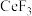 沉淀。
沉淀。回答下列问题:
(1)
 中
中 元素的化合价为
元素的化合价为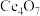 中
中 元素的化合价有+3、+4两种价态,则两者的比例为
元素的化合价有+3、+4两种价态,则两者的比例为(2)“还原脱锰”步骤的还原产物有
(3)写出“沉锰”步骤的离子反应方程式:
(4)若不进行“水浸”步骤,直接将“氧化焙烧”产物进行“酸浸”,可能造成的后果是
(5)工业上常采用EDTA滴定法测定水浸液中
 含量。向锥形瓶中加入
含量。向锥形瓶中加入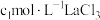 标准溶液
标准溶液 ,再加入
,再加入 水浸液,用
水浸液,用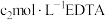 标准溶液进行滴定,消耗标准溶液
标准溶液进行滴定,消耗标准溶液 ,则水浸液中
,则水浸液中 浓度为
浓度为 。(反应原理为
。(反应原理为 ,
, 与EDTA按物质的量之比
与EDTA按物质的量之比 反应)
反应)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】浩瀚的海洋里蕴藏着丰富的资源,可以从海水中获得镁和溴等物质。从海水中提取镁和溴的步骤如下:
(1)以牡蛎壳为原料的优点是_______ 。
(2)“操作1”名称是_______ 。
(3)加入试剂a发生反应的离子方程式为_______ 。
(4)下列说法正确的是_______ (填字母)。
A.利用蒸馏法实现海水淡化,发生了化学变化
B.“酸化”的目的之一是与滤液中的碱反应
C.能用热空气吹出 ,是利用了
,是利用了 的挥发性
的挥发性
(5)上述海水提溴的过程经过2次“ ”转化,目的是
”转化,目的是_______ 。
(6)试剂b可以选用_______ (填名称)。
(7)工业上电解冶炼金属镁,以 为原料而不用
为原料而不用 的原因是
的原因是_______ 。
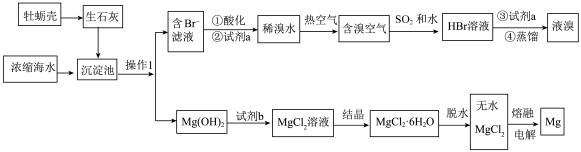
| 物质 |  |  |
熔点/ | 2852 | 714 |
(2)“操作1”名称是
(3)加入试剂a发生反应的离子方程式为
(4)下列说法正确的是
A.利用蒸馏法实现海水淡化,发生了化学变化
B.“酸化”的目的之一是与滤液中的碱反应
C.能用热空气吹出
 ,是利用了
,是利用了 的挥发性
的挥发性(5)上述海水提溴的过程经过2次“
 ”转化,目的是
”转化,目的是(6)试剂b可以选用
(7)工业上电解冶炼金属镁,以
 为原料而不用
为原料而不用 的原因是
的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】焦亚硫酸钠(Na2S2O5)是一种可溶于水的白色或淡黄色小晶体,食品级焦亚硫酸钠可作为贮存水果的保鲜剂等。某化学研究兴趣小组欲自制焦亚硫酸钠并探究其部分化学性质等

(1)制备Na2S2O5,如图(夹持及加热装置略)
可用试剂:饱和Na2SO3溶液、浓NaOH溶液、浓H2SO4、苯、Na2SO3固体(试剂不重复使用)。
焦亚硫酸钠的析出原理:NaHSO3(饱和溶液) Na2S2O5(晶体)+H2O(l)
Na2S2O5(晶体)+H2O(l)
①F中盛装的试剂是________ ,作用是________
②通入N2的作用是____________________________________
③Na2S2O5晶体在________ (填“A”“D”或“F”)中得到,再经离心分离,干燥后可得纯净的样品
④若撤去E,则可能发生________
(2)设计实验探究Na2S2O5的性质,完成表中填空:
①____________________________ (提供:pH试纸、蒸馏水及实验必需的玻璃仪器)
②探究二中反应的离子方程式为_____________ (KMnO4 Mn2+)
Mn2+)

(1)制备Na2S2O5,如图(夹持及加热装置略)
可用试剂:饱和Na2SO3溶液、浓NaOH溶液、浓H2SO4、苯、Na2SO3固体(试剂不重复使用)。
焦亚硫酸钠的析出原理:NaHSO3(饱和溶液)
 Na2S2O5(晶体)+H2O(l)
Na2S2O5(晶体)+H2O(l)①F中盛装的试剂是
②通入N2的作用是
③Na2S2O5晶体在
④若撤去E,则可能发生
(2)设计实验探究Na2S2O5的性质,完成表中填空:
预测Na2S2O5的性质 | 探究Na2S2O5性质的操作及现象 | |
探究一 | Na2S2O5的溶液呈酸性 | ① |
探究二 | Na2S2O5晶体具有还原性 | 取少量Na2S2O5晶体于试管中,滴加1 mL 2 mol·L-1酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去 |
②探究二中反应的离子方程式为
 Mn2+)
Mn2+)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】空气污染问题日益引起全民关注。
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm =103 nm)的颗粒物。下列说法不正确 的是______ (填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1 ~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)北京科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2。
①硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式依次为__________________ 、_________________ 。
②CaSO4可以调节水泥的硬化时间。尾气中SO2与石灰乳反应生成CaSO4的化学方程式为_________ 。
③Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式_______________ 。
(3)工业上利用NO电解制备NH4NO3,其工作原理如下图所示,阳极的电极反应为________________ ,阴极的电极反应为__________________________ ,为使电解产物全部转化为NH4NO3,需补充物质A,A可以是______ 。
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm =103 nm)的颗粒物。下列说法
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1 ~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)北京科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2。

①硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式依次为
②CaSO4可以调节水泥的硬化时间。尾气中SO2与石灰乳反应生成CaSO4的化学方程式为
③Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式
(3)工业上利用NO电解制备NH4NO3,其工作原理如下图所示,阳极的电极反应为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】亚硝酰硫酸(NOSO4H)是一种浅黄色或蓝紫色液体,遇水分解,溶于浓硫酸不分解,主要用于染料、医药领域的重氮化反应中取代亚硝酸钠,有效降低硫酸使用量,增加反应的流动性,不产生无机盐,从而可以降低成本,提高产品质量,使染料成品色泽鲜艳、固色能力强,并减少污水。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。

(1)导管a的作用是________ 。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20 ℃,采取的措施除了加快搅拌速度外,还可以将三颈烧瓶置于________ 中。
②开始时,反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其原因是________ 。
③该实验装置存在可能导致NOSO4H产量降低的缺陷是________ 。
④装置C的作用是________ 。
⑤已知亚硝酸不稳定,易分解,发生反应2HNO2=NO2↑+NO↑+H2O。请写出NOSO4H遇水分解时发生反应的化学方程式________ 。
(3)测定亚硝酰硫酸NOSO4H的纯度。
准确称取1.380 g产品放入250 mL的碘量瓶中,加入60.00 mL0.1000 mol·L-1KMnO4标准溶液和10 mL 25%的H2SO4溶液,然后摇匀(过程中无气体产生)。用0.2500 mol·L-1的草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00 mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4。
①在上述反应中NOSO4H体现了________ (填“氧化”或“还原”)性。
②亚硝酰硫酸的纯度为________ 。[M(NOSO4H)=127 g·mol-1]

(1)导管a的作用是
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20 ℃,采取的措施除了加快搅拌速度外,还可以将三颈烧瓶置于
②开始时,反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其原因是
③该实验装置存在可能导致NOSO4H产量降低的缺陷是
④装置C的作用是
⑤已知亚硝酸不稳定,易分解,发生反应2HNO2=NO2↑+NO↑+H2O。请写出NOSO4H遇水分解时发生反应的化学方程式
(3)测定亚硝酰硫酸NOSO4H的纯度。
准确称取1.380 g产品放入250 mL的碘量瓶中,加入60.00 mL0.1000 mol·L-1KMnO4标准溶液和10 mL 25%的H2SO4溶液,然后摇匀(过程中无气体产生)。用0.2500 mol·L-1的草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00 mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4。
①在上述反应中NOSO4H体现了
②亚硝酰硫酸的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857℃。
(1)工业上以铬铁矿[主要成分是 ]为原料冶炼铬的流程如图所示:
]为原料冶炼铬的流程如图所示:

已知: 是一种难溶于水的沉淀
是一种难溶于水的沉淀
① 中各元素化合价均为整数,则铬为
中各元素化合价均为整数,则铬为_______ 价。
②高温氧化时生成产物除 外还产生一种红棕色物质与一种无色无味的气体,则该反应的化学方程式为
外还产生一种红棕色物质与一种无色无味的气体,则该反应的化学方程式为_______ 。
③操作a由两种均发生了化学反应的过程构成,其内容分别是_______ 、铝与铬的氧化物反应。
(2) 是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应的离子方程式
是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应的离子方程式_______ 、_______ 。
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体( ):先向含
):先向含 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分 )并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
①写出 在酸性条件下被
在酸性条件下被 还原为
还原为 的离子方程式:
的离子方程式:_______ 。
②若处理含1mol (不考虑其他含铬微粒)的污水时恰好消耗10mol
(不考虑其他含铬微粒)的污水时恰好消耗10mol ,则当铁铬氧体中
,则当铁铬氧体中 时,铁铬氧体的化学式为
时,铁铬氧体的化学式为_______ 。
(1)工业上以铬铁矿[主要成分是
 ]为原料冶炼铬的流程如图所示:
]为原料冶炼铬的流程如图所示:
已知:
 是一种难溶于水的沉淀
是一种难溶于水的沉淀①
 中各元素化合价均为整数,则铬为
中各元素化合价均为整数,则铬为②高温氧化时生成产物除
 外还产生一种红棕色物质与一种无色无味的气体,则该反应的化学方程式为
外还产生一种红棕色物质与一种无色无味的气体,则该反应的化学方程式为③操作a由两种均发生了化学反应的过程构成,其内容分别是
(2)
 是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应的离子方程式
是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应的离子方程式(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(
 ):先向含
):先向含 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分 )并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。①写出
 在酸性条件下被
在酸性条件下被 还原为
还原为 的离子方程式:
的离子方程式:②若处理含1mol
 (不考虑其他含铬微粒)的污水时恰好消耗10mol
(不考虑其他含铬微粒)的污水时恰好消耗10mol ,则当铁铬氧体中
,则当铁铬氧体中 时,铁铬氧体的化学式为
时,铁铬氧体的化学式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验.结果如表:
请分析上表信息,回答下列问题.
(1)实验1、2表明____________ 对反应速率有影响,其规律是_______________________ .
(2)仅表明反应物浓度对反应速率产生影响的实验有_____ (填实验序号).
(3)该探究实验中,影响反应速率的因素还有_______________ ,体现该影响因素的实验有_______________________ (填实验序号)
| 实验 序号 | 铁的质量/g | 铁的 形态 | V(H2SO4) /mL | c(H2SO4) /mol•L-1 | 反应前溶液 的温度/℃ | 金属完全消 失的时间/s |
| 1 | 0.10 | 片状 | 50 | 0.8 | 20 | 200 |
| 2 | 0.10 | 粉状 | 50 | 0.8 | 20 | 25 |
| 3 | 0.10 | 片状 | 50 | 1.0 | 20 | 125 |
| 4 | 0.10 | 片状 | 50 | 1.0 | 35 | 50 |
请分析上表信息,回答下列问题.
(1)实验1、2表明
(2)仅表明反应物浓度对反应速率产生影响的实验有
(3)该探究实验中,影响反应速率的因素还有
您最近一年使用:0次
【推荐2】大力发展电动汽车,可以有效控制空气污染。目前机动车常使用的电池有铅蓄电池、锂电池等。
I.铅蓄电池充放电的总反应为:PbO2+Pb+2H2SO4 2PbSO4+2H2O。锂硫电池充放电的总反应为:2Li+S
2PbSO4+2H2O。锂硫电池充放电的总反应为:2Li+S Li2S。
Li2S。
(1)铅蓄电池的负极材料为________________________ 。
(2)当消耗等质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的___________ 倍。(保留三位有效数字)
II.由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如下:

(3)步骤①酸溶时,为提高酸溶速率,可采取的措施是____________ (任写一条)。
(4)已知 25℃时,Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。若步骤②沉铅后的滤液中c(Pb2+)=1.82×10-6 mol·L-1,则此时c( )=
)=_____________ mol·L-1。
(5)步骤③向PbSO4中加Na2CO3溶液会发生:PbSO4(s)+ (aq)=PbCO3(s)+
(aq)=PbCO3(s)+ (aq)。列式并计算该反应此温度下的平衡常数K=
(aq)。列式并计算该反应此温度下的平衡常数K=______________ (写出K的表达式、代入数据、算出结果、保留三位有效数字)
(6)以石墨为电极电解Pb(NO3)2溶液也可以制得PbO2。PbO2将在__________ 极生成(填“阴”或“阳”);而另一极存在电极反应Pb2++2e-=Pb,故Pb元素的利用率较低。若在Pb(NO3)2溶液中加入适量Cu(NO3)2则可有效利用Pb2+,其理由是_____________________________________________________ 。
I.铅蓄电池充放电的总反应为:PbO2+Pb+2H2SO4
 2PbSO4+2H2O。锂硫电池充放电的总反应为:2Li+S
2PbSO4+2H2O。锂硫电池充放电的总反应为:2Li+S Li2S。
Li2S。(1)铅蓄电池的负极材料为
(2)当消耗等质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的
II.由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如下:

(3)步骤①酸溶时,为提高酸溶速率,可采取的措施是
(4)已知 25℃时,Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。若步骤②沉铅后的滤液中c(Pb2+)=1.82×10-6 mol·L-1,则此时c(
 )=
)=(5)步骤③向PbSO4中加Na2CO3溶液会发生:PbSO4(s)+
 (aq)=PbCO3(s)+
(aq)=PbCO3(s)+ (aq)。列式并计算该反应此温度下的平衡常数K=
(aq)。列式并计算该反应此温度下的平衡常数K=(6)以石墨为电极电解Pb(NO3)2溶液也可以制得PbO2。PbO2将在
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇。
该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) △H1=‒116 kJ/mol
(1)已知:CO(g)+ O2(g)=CO2(g) △H2= ‒283 kJ/mol
O2(g)=CO2(g) △H2= ‒283 kJ/mol
H2(g)+ O2(g)=H2O(g) △H3= ‒242kJ/mol
O2(g)=H2O(g) △H3= ‒242kJ/mol
则表示l mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为:_______________ 。
(2)下列措施中有利于增大该反应的反应速率的是_______ (填字母代号)。
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
(3)在容积为1 L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为l mol)与CO平衡转化率的关系。

请回答:
①在上述三种温度中,曲线Z对应的温度是_________ ;
②利用图中a点对应的数据,计算出曲线Z在对应温度下,反应CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=__________ 。
(4)一氧化碳可将金属氧化物还原为金属单质和二氧化碳。四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时,lg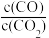 与温度(T)的关系如图。700℃时,其中最难被还原的金属氧化物是
与温度(T)的关系如图。700℃时,其中最难被还原的金属氧化物是________ (填化学式)。

(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为______________ mol/L。
该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) △H1=‒116 kJ/mol
(1)已知:CO(g)+
 O2(g)=CO2(g) △H2= ‒283 kJ/mol
O2(g)=CO2(g) △H2= ‒283 kJ/molH2(g)+
 O2(g)=H2O(g) △H3= ‒242kJ/mol
O2(g)=H2O(g) △H3= ‒242kJ/mol则表示l mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为:
(2)下列措施中有利于增大该反应的反应速率的是
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
(3)在容积为1 L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为l mol)与CO平衡转化率的关系。

请回答:
①在上述三种温度中,曲线Z对应的温度是
②利用图中a点对应的数据,计算出曲线Z在对应温度下,反应CO(g)+2H2(g)
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(4)一氧化碳可将金属氧化物还原为金属单质和二氧化碳。四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时,lg
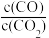 与温度(T)的关系如图。700℃时,其中最难被还原的金属氧化物是
与温度(T)的关系如图。700℃时,其中最难被还原的金属氧化物是
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】近年来,随着汽车保有量的提高,机动车尾气排放问题越来越引起人们的重视,如何节能减排是汽车工业发展的重要因素,请回答下列问题:
(1)已知物质的键能:
汽车内燃机工作时引发反应:N2(g)+O2(g)=2NO(g),是导致汽车尾气中含有NO的原因之一、该反应是_____ 反应(填“放热”或“吸热”);汽车尾气中的NO与CO理论上可以转换成无害物质排出,写出这步反应的化学方程式_____ 。
(2)铅蓄电池是最早使用的充电电池。目前汽车上使用的电瓶大多数仍是铅蓄电池,其电池反应为:Pb+PbO2+2H2SO4 2PbSO4+2H2O,请回答下列问题:正极的电极反应式
2PbSO4+2H2O,请回答下列问题:正极的电极反应式_____ ,当电路中转移0.2mol电子时,负极材料增重_____ g。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计如图为CH4燃料电池示意图,工作时电子流向如图所示。_____ ,电极A附近pH如何变化_____ ?(填“变大”或“变小”)。
(1)已知物质的键能:
| 物质 | N2 | O2 | NO |
| 键能 | 946kJ•mol-1 | 498kJ•mol-1 | 632kJ•mol-1 |
(2)铅蓄电池是最早使用的充电电池。目前汽车上使用的电瓶大多数仍是铅蓄电池,其电池反应为:Pb+PbO2+2H2SO4
 2PbSO4+2H2O,请回答下列问题:正极的电极反应式
2PbSO4+2H2O,请回答下列问题:正极的电极反应式(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计如图为CH4燃料电池示意图,工作时电子流向如图所示。

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】钾离子电池以其优异的性能成为替代理离子电池的一种选择,该电池的负极是由钾嵌入石墨中构成,正极主要含K2NiFeO4、铝箔、醚类有机物等。从某废旧钾离子电池中回收部分材料的流程如图:
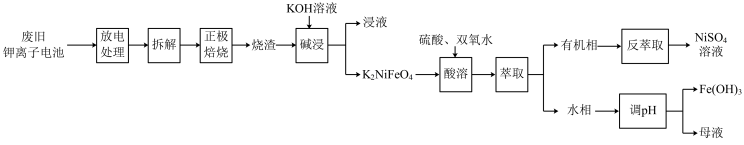
已知:I.放电时负极的电极反应式为KxC6-xe-=C6+xK+;
Ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38,当溶液中某离子浓度低于1×10-5mol•L-1时,认为该离子已沉淀完全。
回答下列问题:
(1)废旧电池放电处理的原因为_____ 。
(2)“碱浸”时发生的化学反应方程式为______ 。
(3)已知K2NiFeO4中的铁为+3价,则“酸溶”时主要反应的离子方程式为_____ ;该工序中温度需控制在40℃的原因为_____ 。
(4)若最终调节pH=3,则所得母液中的Fe3+______ (填“已”或“未”)沉淀完全。
(5)实验室中从“反萃取”所得混合液中分离出NiSO4溶液的操作名称为______ 。

已知:I.放电时负极的电极反应式为KxC6-xe-=C6+xK+;
Ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38,当溶液中某离子浓度低于1×10-5mol•L-1时,认为该离子已沉淀完全。
回答下列问题:
(1)废旧电池放电处理的原因为
(2)“碱浸”时发生的化学反应方程式为
(3)已知K2NiFeO4中的铁为+3价,则“酸溶”时主要反应的离子方程式为
(4)若最终调节pH=3,则所得母液中的Fe3+
(5)实验室中从“反萃取”所得混合液中分离出NiSO4溶液的操作名称为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)氢气、丙烷是重要的燃料,计算等质量的氢气完全燃烧产生的热量是丙烷完全燃烧产生的热量的___________ 倍(精确到小数点后二位)。(已知:氢气、丙烷的燃烧热分别为: ,
,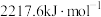 )
)
(2)铅蓄电池是典型的可充电型电池,电池总反应式为: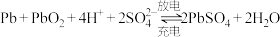 。放电时,负极的电极反应式是
。放电时,负极的电极反应式是___________ ;充电时,当外电路通过1mol电子时,理论上正极板的质量减少___________ g。
(3)一种甲醇燃料电池采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
①此电池负极发生的电极反应式是___________ 。
②电解液中的H+向___________ 极移动 (填“正极”或“负极”下同) ,向外电路释放电子的电极是___________ 。
(1)氢气、丙烷是重要的燃料,计算等质量的氢气完全燃烧产生的热量是丙烷完全燃烧产生的热量的
 ,
,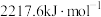 )
)(2)铅蓄电池是典型的可充电型电池,电池总反应式为:
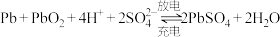 。放电时,负极的电极反应式是
。放电时,负极的电极反应式是(3)一种甲醇燃料电池采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
①此电池负极发生的电极反应式是
②电解液中的H+向
您最近一年使用:0次



