国内外学者近年来对金属-有机框架(MOFs)作为催化剂光解制氢和还原CO2等方面的研究取得了丰硕的成果。其中Masaya 等人利用Ti- MOF-NH2、H2PtCl6、 DMF 等原料制备了催化剂Pt/Ti- MOF-NH2,回答下列问题:
(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是_______ ,处于_______ 区,未成对电子数是_______ 。
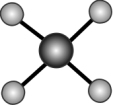
(2)PtCl 的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是_______ , 中心原子采用的杂化类型可能是_______ (填 “dsp2”“sp3”“sp2”或“sp3d2”)。
(3)DMF的结构是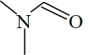 ,σ键与π键的数目比是
,σ键与π键的数目比是_______ ,其中N原子的杂化方式是_______ 。
(4)已知pKa=-lgKa,CCl3CH2OH 的pKa小于CBr3CH2OH,从分子组成与性质之间的关系解释原因_______ 。
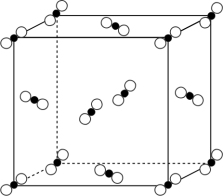
(5)一定条件下, CO2分子可形成干冰晶体,干冰的晶胞模型如图所示。若阿伏加德罗常数为NA, 干冰的密度为ρg·cm-3, 则晶胞体对角线长度是_______ cm。
(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是
(2)PtCl
 的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
(3)DMF的结构是
 ,σ键与π键的数目比是
,σ键与π键的数目比是(4)已知pKa=-lgKa,CCl3CH2OH 的pKa小于CBr3CH2OH,从分子组成与性质之间的关系解释原因
(5)一定条件下, CO2分子可形成干冰晶体,干冰的晶胞模型如图所示。若阿伏加德罗常数为NA, 干冰的密度为ρg·cm-3, 则晶胞体对角线长度是

2022·福建龙岩·一模 查看更多[5]
福建省龙岩第一中学2022届高三下学期第一次模拟考试化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷01(福建卷)(已下线)专题18 物质结构与性质(综合题)-三年(2020-2022)高考真题分项汇编江西省重点校联盟2022-2023学年高三上学期9月联考化学试题
更新时间:2022-04-18 21:19:53
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】K、Fe、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素周期表的_____ 区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级有______ 个。
(2)KCl 和NaCl 均为重要的化学试剂,KCl 的熔点低于NaCl的原因为___________ 。
(3)从原子结构角度分析,Fe3+比Fe2+更稳定的原因是__________ 。
(4)NiSO4 溶于氨水形成[Ni (NH3)6]SO4。
①写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________ 。
②1mol[Ni(NH3)6]SO4中含有σ键的数目为___________ 。
③NH3 的VSEPR模型为_____ ;中心原子的杂化形式为_____ ,其杂化轨道的作用为__________ 。
(5)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏伽德罗常数的值,该晶体的密度ρ=______ g/cm3(用代数式表示)。

(1)K元素处于元素周期表的
(2)KCl 和NaCl 均为重要的化学试剂,KCl 的熔点低于NaCl的原因为
(3)从原子结构角度分析,Fe3+比Fe2+更稳定的原因是
(4)NiSO4 溶于氨水形成[Ni (NH3)6]SO4。
①写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式
②1mol[Ni(NH3)6]SO4中含有σ键的数目为
③NH3 的VSEPR模型为
(5)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏伽德罗常数的值,该晶体的密度ρ=

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】三乙酸锰可作单电子氧化剂,用如下反应可以制取三乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH。
(1)基态锰原子的价层电子排布式为___ 。
(2)CH3COOH中碳原子的杂化形式为___ 。
(3)NO3-的空间构型是___ ,与NO3-互为等电子体的分子的化学式为___ (任写一种)。
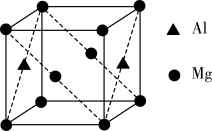
(4)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为anm,晶体中每个镁原子周围距离最近的铝原子数目为___ ,该晶体的密度为___ g/cm3(阿伏加 德罗常数的数值用NA表示)。
(1)基态锰原子的价层电子排布式为
(2)CH3COOH中碳原子的杂化形式为
(3)NO3-的空间构型是
(4)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为anm,晶体中每个镁原子周围距离最近的铝原子数目为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe2+的简化电子排布式为______________________ 。
(2)FeCl3的熔点为306℃,沸点为315℃,FeCl3的晶体类型是_________ 。FeSO4常作净水剂和补铁剂, 的立体构型是
的立体构型是_____ 。
(3)实验室用KSCN溶液、苯酚( )检验Fe3+。N、O、S三种元素的第一电离能由大到小的顺序为
)检验Fe3+。N、O、S三种元素的第一电离能由大到小的顺序为________ (用元素符号表示),苯酚中碳原子的杂化轨道类型为_______ 。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中_______ molσ键,与CO互为等电子体的离子是________ (填化学式,写一种)。
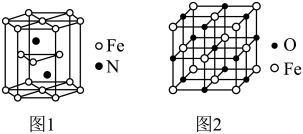
(5)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为________ 。
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为________ ;Fe2+与O2-最短核间距为_________ cm。
(1)基态Fe2+的简化电子排布式为
(2)FeCl3的熔点为306℃,沸点为315℃,FeCl3的晶体类型是
 的立体构型是
的立体构型是(3)实验室用KSCN溶液、苯酚(
 )检验Fe3+。N、O、S三种元素的第一电离能由大到小的顺序为
)检验Fe3+。N、O、S三种元素的第一电离能由大到小的顺序为(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中
(5)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】锌的合金及化合物应用广泛。碳酸酐酶是一种含锌金属酶,人体内碳酸酐酶可以大大加快 水合和脱水的反应速率。碳酸酐酶的结构片段如图所示,请回答下列问题:
水合和脱水的反应速率。碳酸酐酶的结构片段如图所示,请回答下列问题:
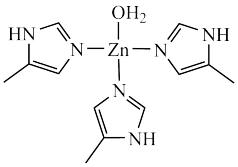
(1) 位于元素周期表的
位于元素周期表的__________ 区。
(2)碳酸酐酶的结构片段中, 的配位数为
的配位数为__________ , 碳酸酐酶结构片段中含有的
碳酸酐酶结构片段中含有的 键数目为
键数目为__________  。
。
(3)金属 能溶于氨水,生成以氨为配体且配位数为4的配离子,
能溶于氨水,生成以氨为配体且配位数为4的配离子, 与氨水反应的离子方程式为
与氨水反应的离子方程式为__________ ; 的键角大于
的键角大于 的,原因为
的,原因为__________ 。
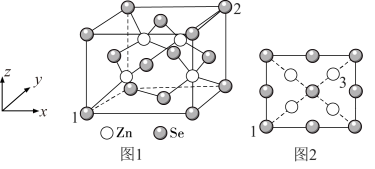
(4)硒化锌是一种重要的半导体材料,其晶胞结构如图1所示,晶胞边长为 。
。
①与 原子距离最近且等距离的
原子距离最近且等距离的 的个数为
的个数为__________ 。
②1号原子的坐标为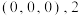 号原子的坐标为
号原子的坐标为 ,图2是
,图2是 晶胞沿
晶胞沿 轴的投影图,3号原子的坐标为
轴的投影图,3号原子的坐标为__________ 。
③设 为阿伏加德罗常数的值,该晶体密度为
为阿伏加德罗常数的值,该晶体密度为__________  。
。
 水合和脱水的反应速率。碳酸酐酶的结构片段如图所示,请回答下列问题:
水合和脱水的反应速率。碳酸酐酶的结构片段如图所示,请回答下列问题:
(1)
 位于元素周期表的
位于元素周期表的(2)碳酸酐酶的结构片段中,
 的配位数为
的配位数为 碳酸酐酶结构片段中含有的
碳酸酐酶结构片段中含有的 键数目为
键数目为 。
。(3)金属
 能溶于氨水,生成以氨为配体且配位数为4的配离子,
能溶于氨水,生成以氨为配体且配位数为4的配离子, 与氨水反应的离子方程式为
与氨水反应的离子方程式为 的键角大于
的键角大于 的,原因为
的,原因为(4)硒化锌是一种重要的半导体材料,其晶胞结构如图1所示,晶胞边长为
 。
。①与
 原子距离最近且等距离的
原子距离最近且等距离的 的个数为
的个数为②1号原子的坐标为
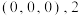 号原子的坐标为
号原子的坐标为 ,图2是
,图2是 晶胞沿
晶胞沿 轴的投影图,3号原子的坐标为
轴的投影图,3号原子的坐标为③设
 为阿伏加德罗常数的值,该晶体密度为
为阿伏加德罗常数的值,该晶体密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】Ni元素在生产、生活中有着广泛的应用。 回答下列问题:
(1)基态Ni原子价层电子的排布式为____ 。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行_____ 。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是____ ;(SCN)2分子中,硫原子的杂化方式是____ ,σ键和π键数目之比为_____ 。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为____ (填标号)。
a.离子键 b.金属键 c.配位键 d.氢键
(5)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。 该合金储氢后,含1molLa的合金可吸附H2的数目为_____ 。
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的___ (填“八面体空隙”或“四面体空隙”)。 若晶体的密度为dg/cm3,Mg2NiH4的摩尔质量为Mg/mol,则Mg2+和Ni原子的最短距离为 ___ nm(用含d、M、NA的代数式表示)。

(1)基态Ni原子价层电子的排布式为
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为
a.离子键 b.金属键 c.配位键 d.氢键
(5)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。 该合金储氢后,含1molLa的合金可吸附H2的数目为
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的

您最近一年使用:0次
【推荐3】我国2060年将实现“碳中和”目标,将工业产生的 转化为有机物是重要的途径。回答下列问题:
转化为有机物是重要的途径。回答下列问题:
(1)2021年,我国科学家实现将 转化为淀粉,实现“惊天大逆转”。该转化的第一步是利用光伏等可再生电源分解水提供氢气,在化学反应器中进行二氧化碳高效还原,反应如下:
转化为淀粉,实现“惊天大逆转”。该转化的第一步是利用光伏等可再生电源分解水提供氢气,在化学反应器中进行二氧化碳高效还原,反应如下: ,相关数据如下表:
,相关数据如下表:
则该反应的
_______ 。
(2)将 和
和 充入密闭容器中,发生反应
充入密闭容器中,发生反应 。下列措施,能提高
。下列措施,能提高 的反应速率的是_______(填序号)。
的反应速率的是_______(填序号)。
(3)反应达平衡时,平衡体系中 的转化率与反应温度和压强的关系如图所示,则
的转化率与反应温度和压强的关系如图所示,则
_______  ,
,
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 、
、 时,列式表示该反应的压强平衡常数为
时,列式表示该反应的压强平衡常数为_______ (压强平衡常数是以气体分压强来表示反应的平衡常数)。

(4)利用 和甲醇可以继续反应生成二甲酯(DMC),催化机理如图1所示,其中反应
和甲醇可以继续反应生成二甲酯(DMC),催化机理如图1所示,其中反应_______ (填“ⅰ”“ⅱ”或“ⅲ”)中发生 键的断裂。二甲酯(DMC)中C原子的杂化方式是
键的断裂。二甲酯(DMC)中C原子的杂化方式是_______ 。每生成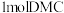 ,需要
,需要
_______ mol。干冰的晶体结构如图2所示,则晶胞中与一个 分子等距最近的
分子等距最近的 分子有
分子有_______ 个。已知晶胞边长为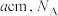 表示阿伏加德罗常数的值,则干冰的密度为
表示阿伏加德罗常数的值,则干冰的密度为_______  。
。

 转化为有机物是重要的途径。回答下列问题:
转化为有机物是重要的途径。回答下列问题:(1)2021年,我国科学家实现将
 转化为淀粉,实现“惊天大逆转”。该转化的第一步是利用光伏等可再生电源分解水提供氢气,在化学反应器中进行二氧化碳高效还原,反应如下:
转化为淀粉,实现“惊天大逆转”。该转化的第一步是利用光伏等可再生电源分解水提供氢气,在化学反应器中进行二氧化碳高效还原,反应如下: ,相关数据如下表:
,相关数据如下表:| 化学键 |  |  |  |  |  |
| 键能 | 803 | 436 | 414 | 326 | 464 |

(2)将
 和
和 充入密闭容器中,发生反应
充入密闭容器中,发生反应 。下列措施,能提高
。下列措施,能提高 的反应速率的是_______(填序号)。
的反应速率的是_______(填序号)。| A.降低反应温度 | B.提高 的浓度 的浓度 |
| C.增加反应的压强 | D.降低 的浓度 的浓度 |
 的转化率与反应温度和压强的关系如图所示,则
的转化率与反应温度和压强的关系如图所示,则
 ,
,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 、
、 时,列式表示该反应的压强平衡常数为
时,列式表示该反应的压强平衡常数为
(4)利用
 和甲醇可以继续反应生成二甲酯(DMC),催化机理如图1所示,其中反应
和甲醇可以继续反应生成二甲酯(DMC),催化机理如图1所示,其中反应 键的断裂。二甲酯(DMC)中C原子的杂化方式是
键的断裂。二甲酯(DMC)中C原子的杂化方式是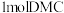 ,需要
,需要
 分子等距最近的
分子等距最近的 分子有
分子有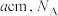 表示阿伏加德罗常数的值,则干冰的密度为
表示阿伏加德罗常数的值,则干冰的密度为 。
。
您最近一年使用:0次



