某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)实验室中现有Na2SO3、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是_______ ;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中: V9=_______ ;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______ 。
(3)一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓硫酸
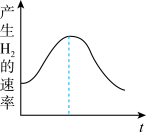
(4)把锌片投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示,刚开始反应速率增大的原因是_______ ,后反应速率又减小的原因是_______ 。(填正确选项前的序号)
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
(1)实验室中现有Na2SO3、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验/混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
(3)一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓硫酸
| A.①②④ | B.①③⑤ | C.③④⑤ | D.①③④ |
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度

更新时间:2022-04-30 09:30:17
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】(1)某课外兴趣小组对过氧化氢的分解速率做了如下实验探究,下表是该小组研究影响过氧化氢分解速率的因素时采集的一组数据:
①上述实验结果体现了________ 、________ 、_______ 等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对化学反应速率的影响:_______________________________________________ 。
(2)某温度时,在一个2 L的密闭容器中,M、N、W三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
①该反应的化学方程式为__________________________ 。
②从反应开始至4 min,N的平均反应速率为________ ,4 min末M的转化率为_______ (保留3位有效数字)。
用10 mL H2O2制取150 mL O2所需时间(s)
| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360 | 480 | 540 | 720 |
MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
①上述实验结果体现了
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对化学反应速率的影响:
(2)某温度时,在一个2 L的密闭容器中,M、N、W三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
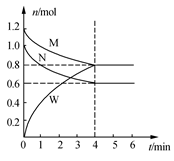
①该反应的化学方程式为
②从反应开始至4 min,N的平均反应速率为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】如图表示298K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线图,据图回答下列问题:

(1)若反应中生成2mol氨,则反应____ (填“吸热”或“放热”)____ kJ。
(2)图中曲线____ (填“a”或“b”)表示加入铁触媒的能量变化曲线,铁触媒能加快反应速率的原理是_____ 。
(3)合成氨反应中平衡混合物中氨的体积分数与压强、温度的关系如图所示。若曲线a对应的温度为500℃,则曲线b对应的温度可能是_____ (填字母)。


(1)若反应中生成2mol氨,则反应
(2)图中曲线
(3)合成氨反应中平衡混合物中氨的体积分数与压强、温度的关系如图所示。若曲线a对应的温度为500℃,则曲线b对应的温度可能是

| A.600℃ | B.550℃ | C.500℃ | D.450℃ |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】I.(1)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
Na2SO3+ KIO3+ H2SO4—— Na2SO4+ K2SO4+ I2+ H2O
①配平上面的氧化还原反应方程式,____________
②其中氧化剂是____________________________ ,若反应中有5 mol电子转移,则生成的碘是 ________________________ mol。
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,乙硼烷燃烧热的热化学方程式为_________________________________________________________________________________________________ 。
II.含氰化物(有CN -)的废水危害大,CN-的含量为0.01mol/L~0.04mol/L就能毒 杀鱼类。其处理方法是用氧化法使其转化为低毒的氰酸钾(KCNO),氧化剂常用次氯酸盐;而生成的CNO-可进一步降解为能直接排放到空气中的无毒气体。近期研究将把某些导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应。但小粒的质量和性质不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物等有毒废物。
(1)二氧化钛在上述反应中的作用是______________________________________________________________ 。
(2)CNO -经进一步处理后产生的两种无毒气体应该是_____________________ 和 ____________________ 。
(3)若用NaClO溶液处理NaCN的废液,产生另外两种盐,其化学方程式为________________________________
Na2SO3+ KIO3+ H2SO4—— Na2SO4+ K2SO4+ I2+ H2O
①配平上面的氧化还原反应方程式,
②其中氧化剂是
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,乙硼烷燃烧热的热化学方程式为
II.含氰化物(有CN -)的废水危害大,CN-的含量为0.01mol/L~0.04mol/L就能毒 杀鱼类。其处理方法是用氧化法使其转化为低毒的氰酸钾(KCNO),氧化剂常用次氯酸盐;而生成的CNO-可进一步降解为能直接排放到空气中的无毒气体。近期研究将把某些导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应。但小粒的质量和性质不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物等有毒废物。
(1)二氧化钛在上述反应中的作用是
(2)CNO -经进一步处理后产生的两种无毒气体应该是
(3)若用NaClO溶液处理NaCN的废液,产生另外两种盐,其化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】现有反应:
A.CaCO3 CaO+CO2↑ B.Zn+H2SO4=ZnSO4+H2↑
CaO+CO2↑ B.Zn+H2SO4=ZnSO4+H2↑
C.C+CO2 2CO D.2KOH+H2SO4=K2SO4+2H2O
2CO D.2KOH+H2SO4=K2SO4+2H2O
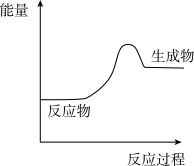
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合如图的是_______ (填反应序号)。
(2)在常温下,上述四个反应中可用于设计原电池的是_______ (填反应序号),根据该原电池回答下列问题:
①负极发生_______ (填“氧化”或“还原”)反应;正极的电极反应式为_______ 。
②当导线中有1 mol电子通过时,理论上发生的变化是_______ (填序号)。
a.溶液增重32.5 g b.溶液增重31.5 g c.析出1g H2 d.析出11.2LH2
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图所示。
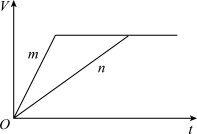
反应速率变快的原因是_______(填序号)。
A.CaCO3
 CaO+CO2↑ B.Zn+H2SO4=ZnSO4+H2↑
CaO+CO2↑ B.Zn+H2SO4=ZnSO4+H2↑C.C+CO2
 2CO D.2KOH+H2SO4=K2SO4+2H2O
2CO D.2KOH+H2SO4=K2SO4+2H2O(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合如图的是

(2)在常温下,上述四个反应中可用于设计原电池的是
①负极发生
②当导线中有1 mol电子通过时,理论上发生的变化是
a.溶液增重32.5 g b.溶液增重31.5 g c.析出1g H2 d.析出11.2LH2
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图所示。

反应速率变快的原因是_______(填序号)。
| A.CuSO4作催化剂 |
B.加入硫酸铜溶液增大了c( ) ) |
| C.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池 |
| D.加入硫酸铜溶液增大了溶液体积 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】一定量的盐酸和过量的锌粒反应产生氢气,为了减慢反应速率,又不影响产生的氢气的总量,下列措施可行的是________ ①加入NaOH固体 ②加入一定量的水 ③加入少量硫酸钠溶液 ④加入少量硫酸铜溶液 ⑤加入CH3COONa固体 ⑥加入KNO3溶液
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】漂白液、漂白粉和漂粉精既可作漂白棉、麻、纸张的漂白剂,又可用作游泳池及环境的消毒剂。
(1)在常温下,将氯气通入NaOH溶液中制取漂白液的化学方程式为:______ 。
(2)漂白粉或漂粉精的有效成分是______ ,使用漂白粉或漂粉精时通常要加入少量的水并通入CO2,此操作方法的目的是:______ 。
(1)在常温下,将氯气通入NaOH溶液中制取漂白液的化学方程式为:
(2)漂白粉或漂粉精的有效成分是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】某研究性学习小组对二氧化硫的制备、性质以及含量测定进行探究。
Ⅰ.制备二氧化硫
用70%的浓硫酸与 固体反应制备
固体反应制备 气体。
气体。
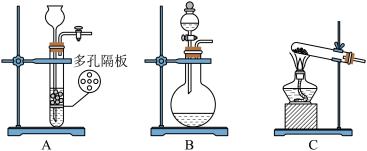
(1)制备 气体最合适的发生装置是
气体最合适的发生装置是___________ (填写字母),反应的化学方程式为___________ 。
Ⅱ.探究 的性质
的性质
在下图装置中先后三次加入相同浓度、相同体积、不同条件下的钡盐溶液,控制食用油油层厚度一致、打开开关K,通入 流速一致。三次实验现象如下表:
流速一致。三次实验现象如下表:

三次实验分别得到如下 图:
图:
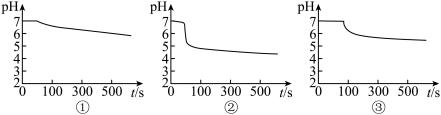
(2)A装置中覆盖食用油的目的是___________ 。
(3) 图中,曲线①呈缓慢下降趋势,这是因为
图中,曲线①呈缓慢下降趋势,这是因为___________ ;曲线②出现骤降,这是因为 与
与 溶液中溶解的
溶液中溶解的___________ 发生了氧化还原反应生成了 ;写出实验③中反应的离子方程式为
;写出实验③中反应的离子方程式为___________ 。
Ⅲ.测定空气中二氧化硫含量。
(4)将空气样品经过管道通入密闭容器中的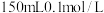 的酸性
的酸性 溶液,若管道中空气流量为
溶液,若管道中空气流量为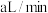 ,经过
,经过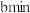 溶液恰好褪色,假设样品中的
溶液恰好褪色,假设样品中的 可被溶液充分吸收。则该空气样品中
可被溶液充分吸收。则该空气样品中 的含量为
的含量为___________ 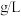 。
。
Ⅰ.制备二氧化硫
用70%的浓硫酸与
 固体反应制备
固体反应制备 气体。
气体。(1)制备
 气体最合适的发生装置是
气体最合适的发生装置是
Ⅱ.探究
 的性质
的性质在下图装置中先后三次加入相同浓度、相同体积、不同条件下的钡盐溶液,控制食用油油层厚度一致、打开开关K,通入
 流速一致。三次实验现象如下表:
流速一致。三次实验现象如下表:| ① | ② | ③ |
已煮沸的 溶液 溶液 | 未煮沸的 溶液 溶液 | 己煮沸的 溶液 溶液 |
| 无白色沉淀生成 | 有白色沉淀生成 | 有白色沉淀生成 |

三次实验分别得到如下
 图:
图:
(2)A装置中覆盖食用油的目的是
(3)
 图中,曲线①呈缓慢下降趋势,这是因为
图中,曲线①呈缓慢下降趋势,这是因为 与
与 溶液中溶解的
溶液中溶解的 ;写出实验③中反应的离子方程式为
;写出实验③中反应的离子方程式为Ⅲ.测定空气中二氧化硫含量。
(4)将空气样品经过管道通入密闭容器中的
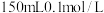 的酸性
的酸性 溶液,若管道中空气流量为
溶液,若管道中空气流量为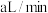 ,经过
,经过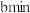 溶液恰好褪色,假设样品中的
溶液恰好褪色,假设样品中的 可被溶液充分吸收。则该空气样品中
可被溶液充分吸收。则该空气样品中 的含量为
的含量为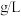 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝。为进一步研究有关因素对反应速率的影响,探究如下:
(1)查阅资料知:NaHSO3与过量KIO3反应分为两步进行,第一步反应的离子方程式为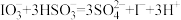 ,第二步反应的离子方程式为
,第二步反应的离子方程式为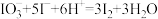 ;分两步进行的反应,其反应速率主要由慢反应决定,所以NaHSO3与过量KIO3反应中,慢反应是
;分两步进行的反应,其反应速率主要由慢反应决定,所以NaHSO3与过量KIO3反应中,慢反应是___________ (填“第一步”或“第二步”)反应。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响记录如表:
实验①②是探究___________ 对反应速率的影响,表中t1___________ (填“>”、“=”或“<”)t2;实验②③是探究温度对反应速率的影响,表中a=___________ ,b=___________ 。
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的SO 对反应起催化作用,故设计实验验证,试完成表中的内容。
对反应起催化作用,故设计实验验证,试完成表中的内容。
(1)查阅资料知:NaHSO3与过量KIO3反应分为两步进行,第一步反应的离子方程式为
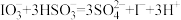 ,第二步反应的离子方程式为
,第二步反应的离子方程式为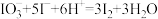 ;分两步进行的反应,其反应速率主要由慢反应决定,所以NaHSO3与过量KIO3反应中,慢反应是
;分两步进行的反应,其反应速率主要由慢反应决定,所以NaHSO3与过量KIO3反应中,慢反应是(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响记录如表:
| 编号 | 0.01mol·L-1 溶液/mL 溶液/mL | 0.01mol·L-1KIO3溶液/mL | H2O/mL | 反应温度/℃ | 液变蓝所用时间t/s |
| ① | 4.0 | 14.0 | 2.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的SO
 对反应起催化作用,故设计实验验证,试完成表中的内容。
对反应起催化作用,故设计实验验证,试完成表中的内容。| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| Ⅰ.在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) Ⅱ.在烧杯乙中先加入少量 | 若v(甲) 若v(甲) |
您最近一年使用:0次