许多过渡金属离子对多种配体有很强结合力,能形成种类繁多的配合物,下列说法正确的是
| A.1mol配合物[TiCl(H2O)5]Cl2·H2O不能与AgNO3溶液反应产生白色沉淀 |
| B.1mol配合物Ni(CO)4中共有8mol σ键 |
C.配合物[Cu(NH3)4]SO4·H2O的配体为NH3和SO |
| D.配合物[Ag(NH3)2]OH的配位数为6 |
更新时间:2022-05-06 20:05:48
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】利用Witting试剂以化合物M合成化合物N的原理如下(其中-Ph表示 ):
):

A.M中C原子的杂化方式为 、 、 |
B.M、N均可使酸性 溶液褪色 溶液褪色 |
| C.N存在顺反异构 |
D.1molN最多可与 加成 加成 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】氯的含氧酸根离子有ClO-、ClO 、ClO
、ClO 、ClO
、ClO 等,关于,它们的说法中不正确的是( )
等,关于,它们的说法中不正确的是( )
 、ClO
、ClO 、ClO
、ClO 等,关于,它们的说法中不正确的是( )
等,关于,它们的说法中不正确的是( )| A.ClO-中Cl显+1价 | B.ClO 的空间构型为直线形 的空间构型为直线形 |
C.ClO 的空间构型为三角锥形 的空间构型为三角锥形 | D.ClO 是SO 是SO 的等电子体 的等电子体 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】碱性溶液中, 可与缩二脲形成下图所示的紫色配离子。有关说法正确的是
可与缩二脲形成下图所示的紫色配离子。有关说法正确的是

 可与缩二脲形成下图所示的紫色配离子。有关说法正确的是
可与缩二脲形成下图所示的紫色配离子。有关说法正确的是
| A.该离子中,只有C、N和O原子可以和水分子形成氢键 |
B.基态Cu原子的价电子排布式是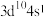 ,该配离子中 ,该配离子中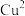 的配位数为4 的配位数为4 |
| C.该离子涉及的元素的电负性顺序为Cu<C<H<N<O |
| D.已知铜氨配离子为平面正方形结构,则图中离子也是平面型结构(均不考虑H原子) |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】某物质的实验式为PtCl4•2NH3,其水溶液不导电。加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是
| A.配合物中中心原子的电荷数为6 | B.该配合物可能是平面正方形结构 |
| C.Cl﹣和NH3分子均与Pt4+形成配位 | D.该配合物的配体只有NH3 |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】某种含二价铜微粒 的催化剂可用于汽车尾气脱硝,催化机理如图所示。下列说法错误的是
的催化剂可用于汽车尾气脱硝,催化机理如图所示。下列说法错误的是
 的催化剂可用于汽车尾气脱硝,催化机理如图所示。下列说法错误的是
的催化剂可用于汽车尾气脱硝,催化机理如图所示。下列说法错误的是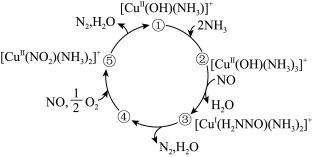
A.状态①到状态②, 的配位数发生了改变 的配位数发生了改变 |
| B.状态②到状态③,有极性键的断裂和生成 |
| C.状态④到状态⑤,原子利用率为100% |
D.该脱硝过程的总反应式为 |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1mol[Cu(NH3)4]2+中σ键的数目为12NA |
| B.46gCH3CH2OH中采用sp3杂化的原子数为2NA |
| C.0.5molSF6中S的价层电子对数为3NA |
| D.12g石墨中含有C-C键的数目为2NA |
您最近半年使用:0次

 +8H+=3Fe2++2NO↑+4H2O
+8H+=3Fe2++2NO↑+4H2O +2SO
+2SO +6H+=4SO2↑+3H2O
+6H+=4SO2↑+3H2O


