高锰酸钾(KMnO4)在工业中广泛用作为氧化剂,工业上常用软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。制备高锰酸钾分两个阶段进行。
阶段一:制备锰酸钾(K2MnO4),工艺流程流程如下:
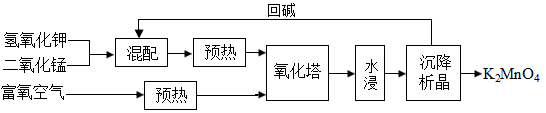
(1)原料加入氧化塔前必须粉碎、预热,目的是_______ 。
(2)在氧化塔,反应分两步进行:
第一步反应生成K3MnO4,反应方程式为_______ 。
第二步反应方程式为4K3MnO4+O2+2H2O 4K2MnO4+4KOH
4K2MnO4+4KOH
阶段二:制备高锰酸钾(KMnO4)
工业中,用锰酸钾制备高锰酸钾有两种方法。
(3)方法一:电解法
工业上采用惰性电极电解锰酸钾溶液,电解反应的化学方程式为2K2MnO4+2H2O 2KMnO4+H2↑+2KOH,阴极上电极反应为
2KMnO4+H2↑+2KOH,阴极上电极反应为_______ 。
(4)方法二:歧化法
相关资料:锰酸钾在强碱性溶液中稳定,在酸性、中性和弱碱性环境下, 会发生歧化反应。20℃时下列各物质溶解度如下表。
会发生歧化反应。20℃时下列各物质溶解度如下表。
工业中常用CO2歧化法制备高锰酸钾,工艺流程如下:
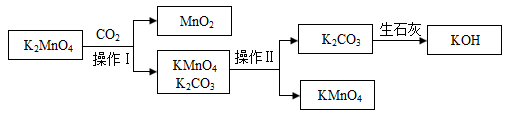
①在该制备过程可循环使用的物质有_______ 、_______ (写化学式)
②操作Ⅱ是将混合液_______ 、_______ 、过滤。
③在酸性条件下,锰酸钾发生歧化反应,工业中用歧化法制高锰酸钾时,用CO2进行酸化,而不用硫酸或盐酸酸化的原因是_______ 。
(5)高锰酸钾是实验室重要试剂,可用于硫酸亚铁样品纯度的测定。取1.000克硫酸亚铁样品溶于蒸馏水,用容量瓶配成100毫升溶液,取出其中20.00mL溶液注入锥形瓶中,加入适量的稀硫酸酸化,用0.0100mol/L的KMnO4标准液进行滴定,当溶液变为微红色且半分钟不褪色时,消耗KMnO4标准液20.00mL,则样品中硫酸亚铁的纯度为_______ 。
阶段一:制备锰酸钾(K2MnO4),工艺流程流程如下:

(1)原料加入氧化塔前必须粉碎、预热,目的是
(2)在氧化塔,反应分两步进行:
第一步反应生成K3MnO4,反应方程式为
第二步反应方程式为4K3MnO4+O2+2H2O
 4K2MnO4+4KOH
4K2MnO4+4KOH阶段二:制备高锰酸钾(KMnO4)
工业中,用锰酸钾制备高锰酸钾有两种方法。
(3)方法一:电解法
工业上采用惰性电极电解锰酸钾溶液,电解反应的化学方程式为2K2MnO4+2H2O
 2KMnO4+H2↑+2KOH,阴极上电极反应为
2KMnO4+H2↑+2KOH,阴极上电极反应为(4)方法二:歧化法
相关资料:锰酸钾在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,
 会发生歧化反应。20℃时下列各物质溶解度如下表。
会发生歧化反应。20℃时下列各物质溶解度如下表。| 物质 | KMnO4 | K2CO3 | K2SO4 |
| 溶解度 | 6.38 | 111 | 11.1 |
工业中常用CO2歧化法制备高锰酸钾,工艺流程如下:

①在该制备过程可循环使用的物质有
②操作Ⅱ是将混合液
③在酸性条件下,锰酸钾发生歧化反应,工业中用歧化法制高锰酸钾时,用CO2进行酸化,而不用硫酸或盐酸酸化的原因是
(5)高锰酸钾是实验室重要试剂,可用于硫酸亚铁样品纯度的测定。取1.000克硫酸亚铁样品溶于蒸馏水,用容量瓶配成100毫升溶液,取出其中20.00mL溶液注入锥形瓶中,加入适量的稀硫酸酸化,用0.0100mol/L的KMnO4标准液进行滴定,当溶液变为微红色且半分钟不褪色时,消耗KMnO4标准液20.00mL,则样品中硫酸亚铁的纯度为
2022·广东·模拟预测 查看更多[1]
(已下线)化学-2022年高考考前押题密卷(广东卷)
更新时间:2022-05-20 18:58:51
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如下图所示。

已知:I 在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
Ⅱ相关金属离子形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(l)滤渣②的主要成分为____ (填化学式)。
(2)写出“氧化”步骤中反应的化学方程式____ 。
(3)“加热”操作的目的是____ 。
(4)“酸化”过程中发生反应2CrO42-+2H+ Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=
Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
(5)“结晶”后得到K2Cr2O7(M=294g.mol-1)产品0.5000 g,将其溶解后用稀H2SO4酸化,再用浓度为1.0000 mol.L-l (NH4)2Fe(SO4)2标准溶液滴定,滴定终点消耗标准溶液的体积为9.00 mL,则产品的纯度为____ 。[滴定反应为:K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如下图所示。
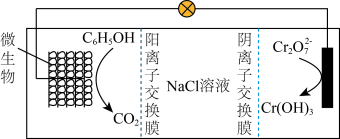
①负极的电极反应式为____ ;
②一段时间后,中间室中NaCl溶液的浓度____ (填“增大”、“减小”或“不变”)。

已知:I 在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
Ⅱ相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Cr3+ | 4.9 | 6.8 |
| Fe3+ | 1.5 | 2.8 |
(l)滤渣②的主要成分为
(2)写出“氧化”步骤中反应的化学方程式
(3)“加热”操作的目的是
(4)“酸化”过程中发生反应2CrO42-+2H+
 Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=
Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=(5)“结晶”后得到K2Cr2O7(M=294g.mol-1)产品0.5000 g,将其溶解后用稀H2SO4酸化,再用浓度为1.0000 mol.L-l (NH4)2Fe(SO4)2标准溶液滴定,滴定终点消耗标准溶液的体积为9.00 mL,则产品的纯度为
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如下图所示。

①负极的电极反应式为
②一段时间后,中间室中NaCl溶液的浓度
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】某废镍渣中主要含 (
( 为+2价)、
为+2价)、 、
、 、
、 。利用废镍渣经过一系列转化可以制得
。利用废镍渣经过一系列转化可以制得 和
和 。回答下列问题:
。回答下列问题:
(1)碱浸:将废镍渣用 溶液浸取,浸取后取所得固体,用水洗涤。碱浸过程中发生反应的离子方程式为
溶液浸取,浸取后取所得固体,用水洗涤。碱浸过程中发生反应的离子方程式为_______ 。
(2)焙烧:将碱浸洗涤后所得固体与 固体充分混合,在600℃条件下焙烧。焙烧后所得固体有
固体充分混合,在600℃条件下焙烧。焙烧后所得固体有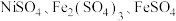 ,同时还有
,同时还有 生成。焙烧时
生成。焙烧时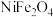 与
与 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)溶解:将焙烧后所得固体用95℃以上的热水进行溶解,溶獬后过滤,得到滤液和红褐色沉淀。产生红褐色沉淀的原因是_______ 。
(4)萃取、反萃取:向溶解、过滤后所得滤液中加入萃取剂,萃取后分液,获得有机层和水层。萃取时发生的反应为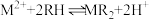 (M表示
(M表示 或
或 ,
,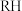 表示萃取剂)。萃取剂体积
表示萃取剂)。萃取剂体积 与溶液体积
与溶液体积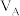 的比值
的比值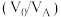 对溶液中
对溶液中 和
和 的萃取率的影响如图所示。最后将分液后获得的有机层通过反萃取可获得
的萃取率的影响如图所示。最后将分液后获得的有机层通过反萃取可获得 溶液并回收萃取剂。
溶液并回收萃取剂。
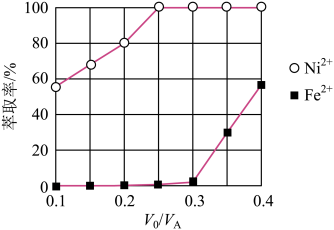
①萃取时应控制 的比值为
的比值为_______ 。
②反萃取获得 溶液的实验操作是
溶液的实验操作是_______ 。
(5)制取 ,并测定
,并测定 样品的质量分数。向
样品的质量分数。向 溶液中加入
溶液中加入 溶液和
溶液和 溶液,可以制得用作镍镉电池正极材料的
溶液,可以制得用作镍镉电池正极材料的 。为测定所得
。为测定所得 样品的质量分数,现进行如下实验:在稀硫酸中加入
样品的质量分数,现进行如下实验:在稀硫酸中加入 样品,待样品完全溶解后加入足量
样品,待样品完全溶解后加入足量 溶液,充分反应府,调节溶液的
溶液,充分反应府,调节溶液的 ,滴入几滴淀粉溶液,用
,滴入几滴淀粉溶液,用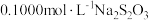 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液 。实验过程中先后发生反应
。实验过程中先后发生反应 和
和 。样品中
。样品中 的质量分数为
的质量分数为_______ 。
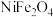 (
( 为+2价)、
为+2价)、 、
、 、
、 。利用废镍渣经过一系列转化可以制得
。利用废镍渣经过一系列转化可以制得 和
和 。回答下列问题:
。回答下列问题:(1)碱浸:将废镍渣用
 溶液浸取,浸取后取所得固体,用水洗涤。碱浸过程中发生反应的离子方程式为
溶液浸取,浸取后取所得固体,用水洗涤。碱浸过程中发生反应的离子方程式为(2)焙烧:将碱浸洗涤后所得固体与
 固体充分混合,在600℃条件下焙烧。焙烧后所得固体有
固体充分混合,在600℃条件下焙烧。焙烧后所得固体有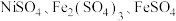 ,同时还有
,同时还有 生成。焙烧时
生成。焙烧时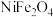 与
与 发生反应的化学方程式为
发生反应的化学方程式为(3)溶解:将焙烧后所得固体用95℃以上的热水进行溶解,溶獬后过滤,得到滤液和红褐色沉淀。产生红褐色沉淀的原因是
(4)萃取、反萃取:向溶解、过滤后所得滤液中加入萃取剂,萃取后分液,获得有机层和水层。萃取时发生的反应为
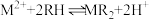 (M表示
(M表示 或
或 ,
,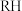 表示萃取剂)。萃取剂体积
表示萃取剂)。萃取剂体积 与溶液体积
与溶液体积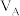 的比值
的比值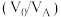 对溶液中
对溶液中 和
和 的萃取率的影响如图所示。最后将分液后获得的有机层通过反萃取可获得
的萃取率的影响如图所示。最后将分液后获得的有机层通过反萃取可获得 溶液并回收萃取剂。
溶液并回收萃取剂。
①萃取时应控制
 的比值为
的比值为②反萃取获得
 溶液的实验操作是
溶液的实验操作是(5)制取
 ,并测定
,并测定 样品的质量分数。向
样品的质量分数。向 溶液中加入
溶液中加入 溶液和
溶液和 溶液,可以制得用作镍镉电池正极材料的
溶液,可以制得用作镍镉电池正极材料的 。为测定所得
。为测定所得 样品的质量分数,现进行如下实验:在稀硫酸中加入
样品的质量分数,现进行如下实验:在稀硫酸中加入 样品,待样品完全溶解后加入足量
样品,待样品完全溶解后加入足量 溶液,充分反应府,调节溶液的
溶液,充分反应府,调节溶液的 ,滴入几滴淀粉溶液,用
,滴入几滴淀粉溶液,用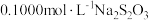 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液 。实验过程中先后发生反应
。实验过程中先后发生反应 和
和 。样品中
。样品中 的质量分数为
的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。某化学兴趣小组在实验室中模拟侯氏制碱法得到产品 和
和 (含少量
(含少量 ),过程如下:
),过程如下:
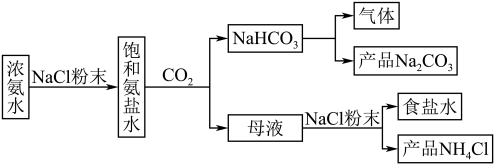
步骤Ⅰ. 的制备
的制备
步骤Ⅱ.产品 中
中 含量测定
含量测定
①称取产品2.500 g,用蒸馏水溶解,定容于250 mL容量瓶中;
②移取25.00 mL。上述溶液于锥形瓶,加入2滴指示剂M,用0.1000 mol·L 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸 mL;
mL;
③在上述锥形瓶中再加入2滴指示剂N,继续用0.1000 mol/L盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸 mL;
mL;
④平行测定三次, 平均值为22.26,
平均值为22.26, 平均值为23.51。
平均值为23.51。
回答下列问题:
(1)生成 的总反应的化学方程式为
的总反应的化学方程式为_______ 。
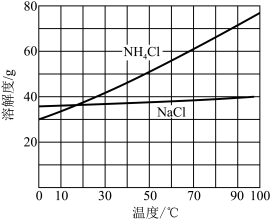
(2)向母液中加入NaCl粉末,存在 过程。为使
过程。为使 沉淀充分析出并分离,根据NaCl和
沉淀充分析出并分离,根据NaCl和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为_______ 、_______ 、过滤、洗涤、干燥。
(3)步骤Ⅱ中的②移取25.00 mL上述溶液于锥形瓶,应选用_______ (填“酸式”或“碱式”)滴定管。
(4)指示剂N为_______ ,当达到第二滴定终点时,某同学仰视读数,其他操作均正确,则 质量分数的计算结果
质量分数的计算结果_______ (填“偏大”“偏小”或“无影响”)。
(5)产品中 的质量分数为
的质量分数为_______ 。
(6) 用途广泛,请写出其中一种用途
用途广泛,请写出其中一种用途_______ 。
 和
和 (含少量
(含少量 ),过程如下:
),过程如下:步骤Ⅰ.
 的制备
的制备
步骤Ⅱ.产品
 中
中 含量测定
含量测定①称取产品2.500 g,用蒸馏水溶解,定容于250 mL容量瓶中;
②移取25.00 mL。上述溶液于锥形瓶,加入2滴指示剂M,用0.1000 mol·L
 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸 mL;
mL;③在上述锥形瓶中再加入2滴指示剂N,继续用0.1000 mol/L盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
 mL;
mL;④平行测定三次,
 平均值为22.26,
平均值为22.26, 平均值为23.51。
平均值为23.51。回答下列问题:
(1)生成
 的总反应的化学方程式为
的总反应的化学方程式为(2)向母液中加入NaCl粉末,存在
 过程。为使
过程。为使 沉淀充分析出并分离,根据NaCl和
沉淀充分析出并分离,根据NaCl和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为
(3)步骤Ⅱ中的②移取25.00 mL上述溶液于锥形瓶,应选用
(4)指示剂N为
 质量分数的计算结果
质量分数的计算结果(5)产品中
 的质量分数为
的质量分数为(6)
 用途广泛,请写出其中一种用途
用途广泛,请写出其中一种用途
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
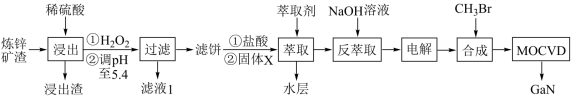
【推荐1】金属镓有“电子工业脊梁”的美誉,广泛应用于电子、航空航天、光学等领域。综合利用炼锌矿渣[主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4]获得3种金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图。
②MOCVD是一种金属有机物化学气相淀积技术。
③常温下,浸出液中各离子形成氢氧化物沉淀的pH见下表。
④金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见下表。
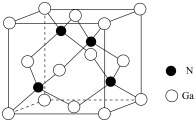
(1)GaN作为第三代半导体材料,具有耐高温、耐高电压等特性,GaN属于___________ 晶体;GaN晶体的一种立方晶胞如图所示,Ga的配位数为___________ 。___________ 。
(3)萃取前加入固体X的目的是___________ 。
(4)电解过程包括电解反萃取液制粗镓和粗镓精炼两个步骤。精炼时,以粗镓为阳极,纯镓为阴极,NaOH水溶液为电解质溶液。通电时,粗镓溶解以___________ (填离子符号)形式进入电解质溶液,并在阴极放电析出高纯镓,则阴极的电极反应方程式为___________ 。精炼时,若外电路通过0.25 mol e-时,阴极得到3.5 g的镓。则该电解装置的电解效率η=___________ (η=生成目标产物转移的电子数/转移的电子总数)。
(5)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以合成的三甲基镓[Ga(CH3)3]为原料,使其与NH3发生反应得到GaN,该过程的化学方程式为___________ 。
②MOCVD是一种金属有机物化学气相淀积技术。
③常温下,浸出液中各离子形成氢氧化物沉淀的pH见下表。
| 金属离子 |  |  |  |  |
| 开始沉淀pH | 8.0 | 1.7 | 5.5 | 3.0 |
| 沉淀完全pH | 9.6 | 3.2 | 8.0 | 4.9 |
| 金属离子 |  |  |  |  |
| 萃取率(%) | 0 | 99 | 0 | 97~98.5 |
(1)GaN作为第三代半导体材料,具有耐高温、耐高电压等特性,GaN属于
(3)萃取前加入固体X的目的是
(4)电解过程包括电解反萃取液制粗镓和粗镓精炼两个步骤。精炼时,以粗镓为阳极,纯镓为阴极,NaOH水溶液为电解质溶液。通电时,粗镓溶解以
(5)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以合成的三甲基镓[Ga(CH3)3]为原料,使其与NH3发生反应得到GaN,该过程的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】为验证不同化合价铁的氧化还原能力,利用图中电池装置进行实验。
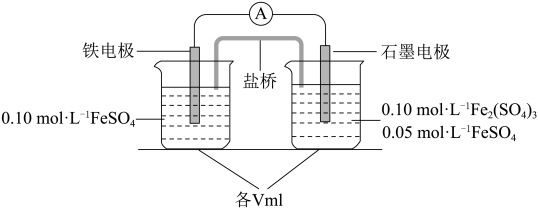
回答下列问题:
(1)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据表中数据,图中盐桥中应选择_______ 作为电解质。
(2)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入_______ (填写“铁”或“石墨”)电极溶液中。
(3)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=_______ 。
(4)根据(2)、(3)实验结果,可知石墨电极的电极反应式为_______ ,铁电极的电极反应式为_______ 。因此,验证了氧化性_______ >_______ ,还原性_______ >_______ 。
(5)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的操作是_______ 。

回答下列问题:
(1)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据表中数据,图中盐桥中应选择
| 阳离子 | u∞×108/(m2·s-1·V-1) | 阴离子 | u∞×108/(m2·s-1·V-1) |
| Li+ | 4.07 |  | 4.61 |
| Na+ | 5.19 |  | 7.40 |
| Ca2+ | 6.59 | Cl- | 7.91 |
| K+ | 7.62 |  | 8.27 |
(2)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入
(3)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=
(4)根据(2)、(3)实验结果,可知石墨电极的电极反应式为
(5)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的操作是
您最近一年使用:0次
【推荐3】对CO2进行综合利用可以节约能源,减少碳排放,对于环保有重要意义。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
则估算该反应的△H=________ kJ/mol(用a、b、c、d的代数式表示)。
②一定条件下,向2 L密闭容器中通入CO2和CH4各4 mol,发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)。当反应达平衡时测得CO的体积分数为20%,则平衡时CO2的浓度为
2CO(g)+2H2(g)。当反应达平衡时测得CO的体积分数为20%,则平衡时CO2的浓度为________ mol/L。
(2)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,反应方程式为CH4+CO2 CH3COOH。
CH3COOH。
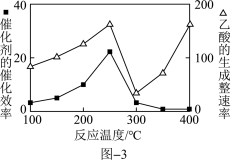
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图3所示。在制备乙酸时,可选择的适宜温度为________ 。
②为了提高该反应中CH4的转化率,可以采取的措施是________ (写出一种)。
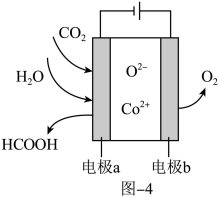
(3)CO2在新型钴基电催化剂作用下转化为清洁燃料——甲酸,其工作原理如图4所示。该装置是________ (填“原电池”或“电解池),电极 的电极反应式为
的电极反应式为________ 。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)
 2CO(g)+2H2(g)
2CO(g)+2H2(g) ①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | 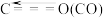 |
| 键能/(kJ/mol) | a | b | c | d |
②一定条件下,向2 L密闭容器中通入CO2和CH4各4 mol,发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。当反应达平衡时测得CO的体积分数为20%,则平衡时CO2的浓度为
2CO(g)+2H2(g)。当反应达平衡时测得CO的体积分数为20%,则平衡时CO2的浓度为(2)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,反应方程式为CH4+CO2
 CH3COOH。
CH3COOH。
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图3所示。在制备乙酸时,可选择的适宜温度为
②为了提高该反应中CH4的转化率,可以采取的措施是
(3)CO2在新型钴基电催化剂作用下转化为清洁燃料——甲酸,其工作原理如图4所示。该装置是
 的电极反应式为
的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】CIGS靶材是一种主要含铜、镓(Ga)、铟(In)、硒(Se)的合金,由于其良好的电学传导和光学透明性能,被广泛运用在薄膜太阳能电池领域。实验室设计从废弃CIGS中回收稀散金属铟和镓的氯化物(性质类似于AlCl3)的流程图:
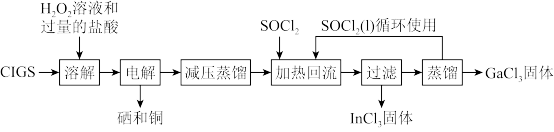
已知:
I.“溶解”步骤所得溶液中含有Cu2+、In3+、Ga3+和H2SeO3。
II.“减压蒸馏”步骤中得到InCl3·xH2O和GaCl3·yH2O固体混合物。
回答下列问题:
(1)镓位于元素周期表第四周期IIIA族,则其原子结构示意图为______ 。
(2)“溶解”过程中生成Ga3+的离子方程式为______ 和2Ga+6H+=2Ga3++3H2↑;利用王水也能溶解CIGS,试分析以王水代替HCl和H2O2的缺点是______ (答出一点即可)。
(3)“电解”步骤中采用不同的电压可在极______ (填“阴”或“阳”)上先后生成硒和铜,其中生成硒的电极反应式为______ 。
(4)SOCl2与水反应能产生两种气体,其中一种气体能使品红溶液褪色,则“加热回流”步骤中加入SOCl2的目的除了脱水外,还有______ 。
(5)取m g CIGS靶材(其中镓的质量分数为a%),按上述流程进行实验,最终得到纯度为b%的GaCl3固体n g,则镓元素的回收率为______ 。(用含m、n、a、b的代数式表示)。

已知:
I.“溶解”步骤所得溶液中含有Cu2+、In3+、Ga3+和H2SeO3。
II.“减压蒸馏”步骤中得到InCl3·xH2O和GaCl3·yH2O固体混合物。
回答下列问题:
(1)镓位于元素周期表第四周期IIIA族,则其原子结构示意图为
(2)“溶解”过程中生成Ga3+的离子方程式为
(3)“电解”步骤中采用不同的电压可在极
(4)SOCl2与水反应能产生两种气体,其中一种气体能使品红溶液褪色,则“加热回流”步骤中加入SOCl2的目的除了脱水外,还有
(5)取m g CIGS靶材(其中镓的质量分数为a%),按上述流程进行实验,最终得到纯度为b%的GaCl3固体n g,则镓元素的回收率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】四水合磷酸锌[Zn3(PO4)2•4H2O,难溶于水]是一种性能优良的绿色环保防锈颜料.实验室以锌灰(含ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2•4H2O的流程如图,回答下列问题:
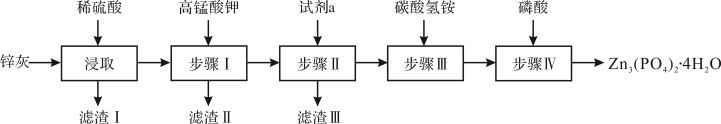
(1)基态Zn2+的价电子排布式为_____ 。
(2)滤渣I的主要成分为____ 。
(3)步骤I除铁操作中,需先将溶液的pH调至5.1,再滴加KMnO4溶液(还原产物是MnO2,该反应的离子方程式为____ 。
(4)已知:步骤IV发生的反应为3[2ZnCO3•3Zn(OH)2•2H2O]+10H3PO4=5[Zn3(PO4)2•4H2O]+6CO2↑+10H2O,步骤III加入NH4HCO3发生反应的化学方程式为____ 。
(5)步骤IV反应结束后,得到Zn3(PO4)2•4H2O的操作包括____ 和干燥。
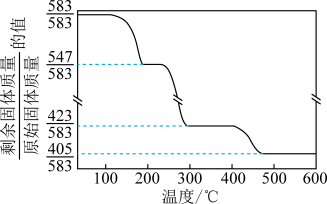
(6)2ZnCO3•3Zn(OH)2•2H2O加热升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体中含有____ 。(填化学式)

(1)基态Zn2+的价电子排布式为
(2)滤渣I的主要成分为
(3)步骤I除铁操作中,需先将溶液的pH调至5.1,再滴加KMnO4溶液(还原产物是MnO2,该反应的离子方程式为
(4)已知:步骤IV发生的反应为3[2ZnCO3•3Zn(OH)2•2H2O]+10H3PO4=5[Zn3(PO4)2•4H2O]+6CO2↑+10H2O,步骤III加入NH4HCO3发生反应的化学方程式为
(5)步骤IV反应结束后,得到Zn3(PO4)2•4H2O的操作包括
(6)2ZnCO3•3Zn(OH)2•2H2O加热升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体中含有

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】以硫铁矿(主要成分为FeS2) 为原料制备氯化铁晶体(FeCl·6H2O) 的工艺流程如下:
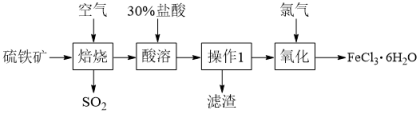
请回答下列问题:
(1)硫铁矿“焙烧”中反应的化学方程式为3FeS2+8O2 X+6SO4,则X的化学式为:
X+6SO4,则X的化学式为:___________ ;
(2)“酸溶”中反应的化学方程式为___________ ;
(3)操作1的名称为___________ ;
(4)“氧化”中反应的离子方程式为___________ ;此反应中的氧化剂为___________ ,检验“氧化”后溶液中的主要阳离子的操作为:取少量“氧化”后的溶液于试管中,加入少量___________ 溶液,若溶液呈红色,说明溶液中含有该阳离子:
(5)从绿色化学的角度谈谈,该工艺流程中还应考虑哪些问题(任写一点即可):___________ 。

请回答下列问题:
(1)硫铁矿“焙烧”中反应的化学方程式为3FeS2+8O2
 X+6SO4,则X的化学式为:
X+6SO4,则X的化学式为:(2)“酸溶”中反应的化学方程式为
(3)操作1的名称为
(4)“氧化”中反应的离子方程式为
(5)从绿色化学的角度谈谈,该工艺流程中还应考虑哪些问题(任写一点即可):
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】氯化铜晶体(CuCl2·2H2O)含有FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下列操作步骤进行提纯:
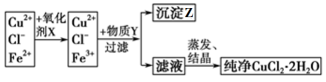
①先加入氧化剂X,再加入物质Y,过滤得沉淀Z。
②将滤液蒸发结晶得纯CuCl2·2H2O晶体。
已知:三种离子在溶液中完全变成氢氧化物沉淀所需pH值如下表。
试回答下列问题:
(1)加入氧化剂X的目的是______________________________________ 。
(2)下列物质都可以作为氧化剂,其中最适宜于本实验的是_________ 。
A.H2O2 B.KMnO4 C.NaClO D.K2Cr2O7
此过程发生反应的离子方程式为_____________________________________ 。
(3)物质Y可以用______________ (填一种物质),沉淀Z是____________ 。
(4)为分离出沉淀Z采取的实验操作是_________________ 。
(5)步骤②所用的仪器有铁架台(含铁圈)、酒精灯、玻璃棒和_________ ,如要获得无水CuCl2,应采取的操作是____________________________________________ 。

①先加入氧化剂X,再加入物质Y,过滤得沉淀Z。
②将滤液蒸发结晶得纯CuCl2·2H2O晶体。
已知:三种离子在溶液中完全变成氢氧化物沉淀所需pH值如下表。
| 离子 | Fe3+ | Cu2+ | Fe2+ |
| pH | 3.7 | 6.4 | 6.4 |
(1)加入氧化剂X的目的是
(2)下列物质都可以作为氧化剂,其中最适宜于本实验的是
A.H2O2 B.KMnO4 C.NaClO D.K2Cr2O7
此过程发生反应的离子方程式为
(3)物质Y可以用
(4)为分离出沉淀Z采取的实验操作是
(5)步骤②所用的仪器有铁架台(含铁圈)、酒精灯、玻璃棒和
您最近一年使用:0次
【推荐2】硫酸亚铁铵晶体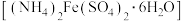 又称摩尔盐,
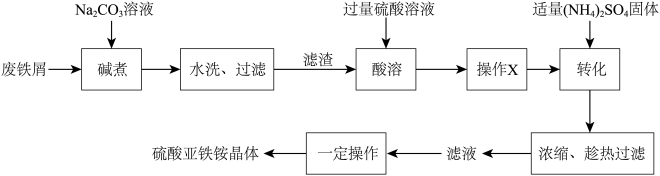
又称摩尔盐,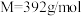 ,浅绿色能溶于水,在空气中不易被氧化。实验室以废铁屑(含少量硫化物、
,浅绿色能溶于水,在空气中不易被氧化。实验室以废铁屑(含少量硫化物、 、油污等杂质)为料制备硫酸亚铁铵晶体的流程如下:
、油污等杂质)为料制备硫酸亚铁铵晶体的流程如下:
回答下列问题:
(1)“碱煮”的目的是___________ 。
(2)“酸溶”在如图所示装置中完成(部分装置省略)。仪器 的名称是
的名称是______ ,反应过程中有臭鸡蛋气味气体产生,则装置 的作用是
的作用是_____________________ 。
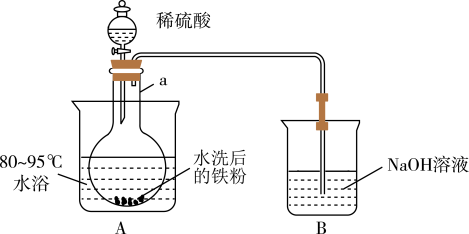
(3)欲检测“酸溶”所得溶液中是否含有 ,可选用试剂为
,可选用试剂为_____________ ,结果表明溶液中不含 ,原因是
,原因是______________________ 。“操作 ”是加入铁粉,指出该操作的主要目的是
”是加入铁粉,指出该操作的主要目的是________________ 。
(4)产品纯度测定:称取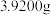 硫酸亚铁铵晶体样品,加入硫酸溶解,用容量瓶配制成
硫酸亚铁铵晶体样品,加入硫酸溶解,用容量瓶配制成 溶液。量取
溶液。量取 所配溶液于锥形瓶中,消耗
所配溶液于锥形瓶中,消耗 酸性
酸性 标准溶液体积为
标准溶液体积为 。
。
①滴定过程反应的离子方程式为_____________ 。
②产品的纯度为_______________ 。
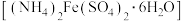 又称摩尔盐,
又称摩尔盐,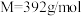 ,浅绿色能溶于水,在空气中不易被氧化。实验室以废铁屑(含少量硫化物、
,浅绿色能溶于水,在空气中不易被氧化。实验室以废铁屑(含少量硫化物、 、油污等杂质)为料制备硫酸亚铁铵晶体的流程如下:
、油污等杂质)为料制备硫酸亚铁铵晶体的流程如下:
回答下列问题:
(1)“碱煮”的目的是
(2)“酸溶”在如图所示装置中完成(部分装置省略)。仪器
 的名称是
的名称是 的作用是
的作用是
(3)欲检测“酸溶”所得溶液中是否含有
 ,可选用试剂为
,可选用试剂为 ,原因是
,原因是 ”是加入铁粉,指出该操作的主要目的是
”是加入铁粉,指出该操作的主要目的是(4)产品纯度测定:称取
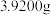 硫酸亚铁铵晶体样品,加入硫酸溶解,用容量瓶配制成
硫酸亚铁铵晶体样品,加入硫酸溶解,用容量瓶配制成 溶液。量取
溶液。量取 所配溶液于锥形瓶中,消耗
所配溶液于锥形瓶中,消耗 酸性
酸性 标准溶液体积为
标准溶液体积为 。
。①滴定过程反应的离子方程式为
②产品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(摩尔质量376g/mol)是一种氧气吸收剂,红棕色晶体,易被氧化;易溶于盐酸,微溶于乙醇,难溶于水和乙醚。其制备装置(已省略加热及支持装置)和步骤如下:
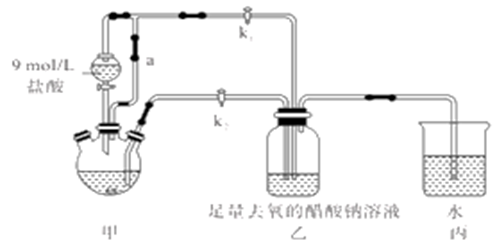
①检查装置气密性,往三颈烧瓶中依次加入过量锌粉,200mL0.200mol/LCrC13溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中。当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到11.28g[Cr(CH3COO)2]2·2H2O
(1)装置甲中连通管a的作用是________ ,如何检验甲装置的气密性是否良好?__________ 。
(2)生成红棕色晶体的离子反应方程式____________________________ 。
(3)步骤③中溶液自动转移至装置乙中的实验操作为________________ 。
(4)装置丙的作用是________________ 。
(5)为得到纯净干燥的产品,洗涤时按使用的先后顺序选用下列洗涤剂__________ (填序号)。
①乙醚②蒸馏水(煮沸冷却)③无水乙醇④盐酸
(6)本实验中[Cr(CH3COO)2]2·2H2O的产率是______________ 。

①检查装置气密性,往三颈烧瓶中依次加入过量锌粉,200mL0.200mol/LCrC13溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中。当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到11.28g[Cr(CH3COO)2]2·2H2O
(1)装置甲中连通管a的作用是
(2)生成红棕色晶体的离子反应方程式
(3)步骤③中溶液自动转移至装置乙中的实验操作为
(4)装置丙的作用是
(5)为得到纯净干燥的产品,洗涤时按使用的先后顺序选用下列洗涤剂
①乙醚②蒸馏水(煮沸冷却)③无水乙醇④盐酸
(6)本实验中[Cr(CH3COO)2]2·2H2O的产率是
您最近一年使用:0次



