已知X、Y、Z、W、M、N为短周期主族元素且原子序数依次增大,W和M同主族,Z的最高价氧化物对应的水化物能与其气态氢化物发生化合反应生成盐为Q,Y是形成化合物种类最多的元素,X2W是常见的液态物质,元素R的焰色反应为紫色(透过蓝色钴玻璃),请回答下列问题:
(1)R元素在周期表中的位置:_______ ,其原子结构示意图为:_______ 。
(2)Q所含有的化学键类型是_______ ,X2W2的电子式:_______ 。M、N、R简单离子半径由大到小的顺序:_______ 。
(3)写出一个可证明M和N非金属性强弱的离子反应方程式:_______ 。
(4)以稀X2MW4溶液作电解质溶液,石墨作电极,X的单质和W的双原子分子组成燃料电池,电池工作时,正极的电极反应式为_______ 。
(1)R元素在周期表中的位置:
(2)Q所含有的化学键类型是
(3)写出一个可证明M和N非金属性强弱的离子反应方程式:
(4)以稀X2MW4溶液作电解质溶液,石墨作电极,X的单质和W的双原子分子组成燃料电池,电池工作时,正极的电极反应式为
更新时间:2022-07-01 15:34:52
|
相似题推荐
【推荐1】目前世界上广泛采用氨和二氧化碳高温高压下制备尿素,主要反应为两步:
(1)制备尿素的总反应的反应热为ΔH3,则△H3___________ ( “大于”“小于”或“等于”) ΔH1
(2)下列说法正确的是___________。
(3)尿素生产过程中转化率通常用二氧化碳转化率来表示,当二氧化碳起始浓度为c(CO2) =2mol·L-1时(14.3MPa,水碳比= 0.5), CO2平衡转化率随投料氨碳比[c(NH3)/c(CO2)]的变化如表所示:
提高氨碳比有利于生成尿素,主要有两个原因:一是增大氨气浓度有利于平衡正向移动,二是____________ ;氨碳比为3.50时,制备尿素的总反应平衡常数K= ___________ (精确到小数点后面两位) 。
(4)可利用尿素[CO(NH2)2]水解的溶液吸收空气中的SO2。已知尿素在常温下的水解反应较慢,尿素水解生成氨基甲酸铵,氨基甲酸铵与空气中的SO2和O2反应生成(NH4)2SO4一定条件下,用尿素溶液吸收含SO2的空气,测得SO2的吸收率随溶液温度的变化如下图a所示。温度高于60°C时,SO2的吸收率逐渐升高的原因是____________ 。
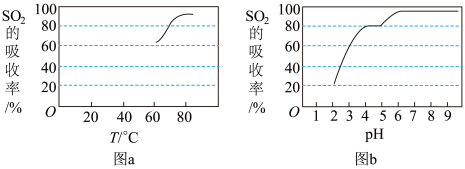
尿素溶液吸收SO2的吸收率随溶液pH的交化如下图b所示。为提高SO2的吸收率,最好控制pH约为____________ 。
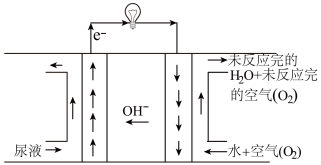
(5)通过直接尿素燃料电池装置如图,实现了“尿素能”的利用,且产生无污染的产物,写出负极反应:____________ 。
| 第一步:生成氨基甲酸铵 | 第二步:氨基甲酸铵脱水生成尿素 |
2NH3(g) + CO2(g)  NH2COONH4(l) ΔH1 NH2COONH4(l) ΔH1 | H2NCOONH4(l)  CO(NH2)2(s)+ H2O(g) ΔH2 CO(NH2)2(s)+ H2O(g) ΔH2 |
| 快速放热 | 慢速吸热 |
(1)制备尿素的总反应的反应热为ΔH3,则△H3
(2)下列说法正确的是___________。
| A.利用二氧化碳制备尿素是减缓温室效应的有效方法 |
| B.第二步反应高温条件下自发进行 |
| C.提高投料中的水碳比[c(H2O)/c(CO2)]有利于尿素的生成 |
| D.第一步反应的活化能大于第二步反应 |
| 氨碳比/浓度比 | 2.95 | 3.10 | 3.20 | 3.50 |
| CO2平衡转化率% | 56.4 | 57.5 | 57.9 | 60.0 |
提高氨碳比有利于生成尿素,主要有两个原因:一是增大氨气浓度有利于平衡正向移动,二是
(4)可利用尿素[CO(NH2)2]水解的溶液吸收空气中的SO2。已知尿素在常温下的水解反应较慢,尿素水解生成氨基甲酸铵,氨基甲酸铵与空气中的SO2和O2反应生成(NH4)2SO4一定条件下,用尿素溶液吸收含SO2的空气,测得SO2的吸收率随溶液温度的变化如下图a所示。温度高于60°C时,SO2的吸收率逐渐升高的原因是

尿素溶液吸收SO2的吸收率随溶液pH的交化如下图b所示。为提高SO2的吸收率,最好控制pH约为
(5)通过直接尿素燃料电池装置如图,实现了“尿素能”的利用,且产生无污染的产物,写出负极反应:

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气作为能源最大的优点是燃烧产物是水,无污染。请你再列举一条氢气作为能源的优点:_____________________________________________ 。
(2)LiAlH4是一种重要的储氢载体,能与水反应得到LiAlO2和氢气,该反应消耗1mol LiAlH4时转移的电子数目为_______________________________________ 。
(3)氮化锂(Li3N)是非常有前途的储氢材料,其在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为;Li3N+2H2 LiNH2+2LiH,氧化产物为
LiNH2+2LiH,氧化产物为___________ (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的___________ %(精确到0.1)。
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
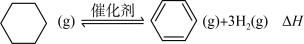
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=__________ 。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
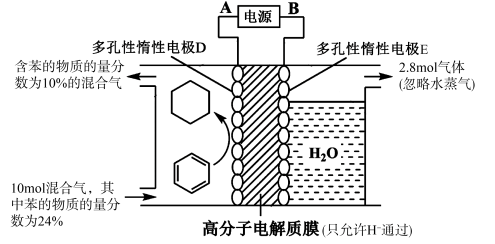
①导线中电子移动方向为__________ 。(用A、D表示)
②生成目标产物的电极反应式为_______________________________ 。
③该储氢装置的电流效率η=_________________ 。
(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
(1)氢气作为能源最大的优点是燃烧产物是水,无污染。请你再列举一条氢气作为能源的优点:
(2)LiAlH4是一种重要的储氢载体,能与水反应得到LiAlO2和氢气,该反应消耗1mol LiAlH4时转移的电子数目为
(3)氮化锂(Li3N)是非常有前途的储氢材料,其在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为;Li3N+2H2
 LiNH2+2LiH,氧化产物为
LiNH2+2LiH,氧化产物为(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
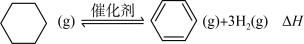
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。

①导线中电子移动方向为
②生成目标产物的电极反应式为
③该储氢装置的电流效率η=
(η=
 ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】碱性银锌二次航空电池为价格昂贵的高能电池。该电池的总反应为:Zn+Ag2O ZnO+2Ag。其电池中的基本单元示意图如图:
ZnO+2Ag。其电池中的基本单元示意图如图:

(1)该电池放电时,锌电极板为电池的____ (填“正极”或“负极”)。
(2)以KOH溶液为电解液,放电时锌电极板区域中发生的电极反应可分为两步:
反应i.锌电极板的溶解:…
反应ii.锌电极板上ZnO的析出:Zn(OH)
 ZnO+2OH-+H2O
ZnO+2OH-+H2O
补充反应i:_____ 。
(3)放电时,析出的ZnO会覆盖在锌电极板表面,影响电池使用效果。用浓KOH溶液可以抑制ZnO的生成,并促进锌电极板的溶解,从速率和平衡的角度说明其原因:____ 。
(4)将锌电极板制成蜂窝孔状,如图a所示,能增大锌电极板的表面积,但蜂窝孔的孔径过小,影响OH-进出蜂窝孔的速率,导致孔径内外OH-浓度出现差异,多次充放电后会影响锌电极板的形状。图b是使用一段时间后的锌极板变形情况。
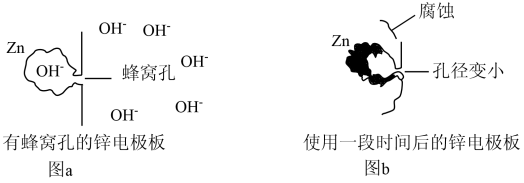
下列说法正确的是____ (填字母序号)。
a.充电时,OH-向锌极板方向迁移
b.孔内沉积ZnO,导电能力减弱,影响电池使用效果
c.导致该腐蚀变形的主要原因是孔外OH-浓度高于孔内OH-浓度
d.为延长电池使用寿命,提高电池放电效果,应选用孔径恰当的锌极板
(5)隔膜可有效阻止充放电循环中银的迁移,防止银在锌电极板析出造成电池短路。测定隔膜上附着银元素含量的方法是:用硝酸溶解隔膜上的附着物得溶解液,再以NH4Fe(SO4)2作指示剂,用NH4SCN溶液滴定溶解液。发生反应:
①Ag++SCN- AgSCN↓(白色) K=1012
AgSCN↓(白色) K=1012
②Fe3++SCN- FeSCN2+(红色) K=102.3
FeSCN2+(红色) K=102.3
结合上述两个反应的平衡常数,解释选择NH4Fe(SO4)2作为指示剂的原因:____ 。
 ZnO+2Ag。其电池中的基本单元示意图如图:
ZnO+2Ag。其电池中的基本单元示意图如图:
(1)该电池放电时,锌电极板为电池的
(2)以KOH溶液为电解液,放电时锌电极板区域中发生的电极反应可分为两步:
反应i.锌电极板的溶解:…
反应ii.锌电极板上ZnO的析出:Zn(OH)

 ZnO+2OH-+H2O
ZnO+2OH-+H2O补充反应i:
(3)放电时,析出的ZnO会覆盖在锌电极板表面,影响电池使用效果。用浓KOH溶液可以抑制ZnO的生成,并促进锌电极板的溶解,从速率和平衡的角度说明其原因:
(4)将锌电极板制成蜂窝孔状,如图a所示,能增大锌电极板的表面积,但蜂窝孔的孔径过小,影响OH-进出蜂窝孔的速率,导致孔径内外OH-浓度出现差异,多次充放电后会影响锌电极板的形状。图b是使用一段时间后的锌极板变形情况。

下列说法正确的是
a.充电时,OH-向锌极板方向迁移
b.孔内沉积ZnO,导电能力减弱,影响电池使用效果
c.导致该腐蚀变形的主要原因是孔外OH-浓度高于孔内OH-浓度
d.为延长电池使用寿命,提高电池放电效果,应选用孔径恰当的锌极板
(5)隔膜可有效阻止充放电循环中银的迁移,防止银在锌电极板析出造成电池短路。测定隔膜上附着银元素含量的方法是:用硝酸溶解隔膜上的附着物得溶解液,再以NH4Fe(SO4)2作指示剂,用NH4SCN溶液滴定溶解液。发生反应:
①Ag++SCN-
 AgSCN↓(白色) K=1012
AgSCN↓(白色) K=1012②Fe3++SCN-
 FeSCN2+(红色) K=102.3
FeSCN2+(红色) K=102.3结合上述两个反应的平衡常数,解释选择NH4Fe(SO4)2作为指示剂的原因:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在最高价氧化物的水化物中,酸性最强的化合物的分子式是___________ ,碱性最强的化合物的电子式是___________ 。
(2)最高价氧化物是两性氧化物的元素原子结构示意图是___________ ;写出它的氧化物与氢氧化钠反应的离子方程式___________ 。
(3)①与⑦组成的化合物的电子式___________ ,该化合物是由___________ (填“极性”“非极性”)键形成的。
(4)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是___________ (用离子符号表示)。
(5)过量的元素②的氢化物和元素⑦的单质反应的化学方程式___________ 。
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)最高价氧化物是两性氧化物的元素原子结构示意图是
(3)①与⑦组成的化合物的电子式
(4)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是
(5)过量的元素②的氢化物和元素⑦的单质反应的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】元素周期表反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。如表是元素周期表的一部分,数字①~⑨代表前四周期的九种主族元素。请按题目要求回答下列问题:___________ ;元素①有:H、D、T三种质子数相同,中子数不同的核素,它们互称为___________ ,物质DT属于___________ (选填“单质”、“化合物”)。
(2)写出元素①与元素②可形成的10电子分子的电子式___________ ;写出元素④最高价氧化物的水化物的电子式___________ 。
(3)③、④、⑤、⑦简单离子的半径由大到小的顺序是___________ (用离子符号作答)。
(4)②与⑥两种元素简单氢化物的沸点从高到低排序___________ (用化学式作答)。
某小组同学设计实验比较 A族元素的非金属性:Cl>Br>I。
A族元素的非金属性:Cl>Br>I。
甲同学设计实验如图1所示:打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙黄色,湿润的淀粉KI试纸变蓝。 充分反应后,静置A中液体为橙黄色,将A中液体滴入试管内,取下试管,充分振荡,试管中的
充分反应后,静置A中液体为橙黄色,将A中液体滴入试管内,取下试管,充分振荡,试管中的 层变为紫红色。
层变为紫红色。
(5)①上述___________ (选填“甲同学”、“乙同学”或“两位同学”)的实验能证明非金属性:Cl>Br>I。
②除了利用卤素单质间的置换反应,下列可作为卤族元素非金属性递变规律的判断依据有___________ 。
A. 、
、 、
、 的熔点逐渐升高 B.HCl、HBr、HI的热稳定性逐渐减弱
的熔点逐渐升高 B.HCl、HBr、HI的热稳定性逐渐减弱
C.HCl、HBr、HI的沸点逐渐升高 D.Cl-、Br-、I-的还原性逐渐增强

(2)写出元素①与元素②可形成的10电子分子的电子式
(3)③、④、⑤、⑦简单离子的半径由大到小的顺序是
(4)②与⑥两种元素简单氢化物的沸点从高到低排序
某小组同学设计实验比较
 A族元素的非金属性:Cl>Br>I。
A族元素的非金属性:Cl>Br>I。甲同学设计实验如图1所示:打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙黄色,湿润的淀粉KI试纸变蓝。

 充分反应后,静置A中液体为橙黄色,将A中液体滴入试管内,取下试管,充分振荡,试管中的
充分反应后,静置A中液体为橙黄色,将A中液体滴入试管内,取下试管,充分振荡,试管中的 层变为紫红色。
层变为紫红色。(5)①上述
②除了利用卤素单质间的置换反应,下列可作为卤族元素非金属性递变规律的判断依据有
A.
 、
、 、
、 的熔点逐渐升高 B.HCl、HBr、HI的热稳定性逐渐减弱
的熔点逐渐升高 B.HCl、HBr、HI的热稳定性逐渐减弱C.HCl、HBr、HI的沸点逐渐升高 D.Cl-、Br-、I-的还原性逐渐增强
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,已知A的某种原子核内没有中子,A和D、C和F分别为同一主族元素,B原子的最外层电子数比次外层多3,E的最高价氧化物既可与强酸溶液反应也可与强碱溶液反应。回答下列问题:
(1)C在元素周期表中的位置是_______ 。
(2)C、D分别形成的简单离子中,离子半径较大的是_______ (填离子符号)。
(3)F和G的最高价氧化物对应水化物的酸性较强的是_______ (填化学式)。
(4)由A、C、D形成的化合物中化学键的类型为_______ 。
(5)用电子式表示D2F的形成过程:_______ 。
(6)D、E的最高价氧化物对应的水化物相互反应的离子方程式为_______ 。
(7)由B、G形成的化合物分子中,B和G原子的最外层均达到8电子稳定结构,该化合物遇水可反应生成一种具有漂白性的化合物和一种能使湿润的红色石蕊试纸变蓝的气体,写出该反应的化学方程式:_______ 。
(1)C在元素周期表中的位置是
(2)C、D分别形成的简单离子中,离子半径较大的是
(3)F和G的最高价氧化物对应水化物的酸性较强的是
(4)由A、C、D形成的化合物中化学键的类型为
(5)用电子式表示D2F的形成过程:
(6)D、E的最高价氧化物对应的水化物相互反应的离子方程式为
(7)由B、G形成的化合物分子中,B和G原子的最外层均达到8电子稳定结构,该化合物遇水可反应生成一种具有漂白性的化合物和一种能使湿润的红色石蕊试纸变蓝的气体,写出该反应的化学方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】现有部分短周期元素的性质或原子结构如表:
(1)元素X的一种同位元素可测定文物年代,这种同位素的符号是_______ (用元素符号表示),元素Z的离子结构示意图为_______ 。
(2)元素Y与氢元素形成一离子YH 的电子式为
的电子式为_______
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:_______ 。
(4)元素X与元素Y相比,非金属性较强的是_______ (用元素符号表示)。下列表述中能证明这一事实的是_______ 。
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物对应水化物的酸性比X的最高价氧化物对应水化物的酸性强
c.X与Y形成的化合物中X元素呈正价状态
(5)Y的最高价氧化物的水化物与气态氢化物可化合成_______ 化合物(填“共价”或“离子”)。
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
(2)元素Y与氢元素形成一离子YH
 的电子式为
的电子式为(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:
(4)元素X与元素Y相比,非金属性较强的是
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物对应水化物的酸性比X的最高价氧化物对应水化物的酸性强
c.X与Y形成的化合物中X元素呈正价状态
(5)Y的最高价氧化物的水化物与气态氢化物可化合成
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是_______ 。请写出f和e的最高价氧化物的水化物之间反应的离子方程式_______ 。
(2)元素x和e可以组成一种二元离子化合物,写出此化合物的电子式_______ ,任选上述元素组成一种四原子共价化合物,写出其结构式:_______ 。
(3)g,h元素的简单离子,还原性比较强的是_______ (用元素符号表示),化合物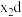 和
和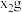 比较稳定的是
比较稳定的是_______ (写出化学式)。
(4)与y元素同主族的短周期元素b在地壳中含量丰富,其氧化物是普通玻璃的主要成分,氢氟酸可以刻蚀玻璃,请写出相关的方程式_______ 。
(5)化合物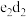 存在的化学键的类型有
存在的化学键的类型有_______ (离子键,极性共价键,非极性共价键)
(6)将h元素的气态单质通入KI溶液中,反应后加入 并振荡,有机层显
并振荡,有机层显_______ 色。此反应有1molh单质参加反应,转移的电子是_______ mol。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是
(2)元素x和e可以组成一种二元离子化合物,写出此化合物的电子式
(3)g,h元素的简单离子,还原性比较强的是
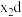 和
和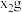 比较稳定的是
比较稳定的是(4)与y元素同主族的短周期元素b在地壳中含量丰富,其氧化物是普通玻璃的主要成分,氢氟酸可以刻蚀玻璃,请写出相关的方程式
(5)化合物
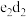 存在的化学键的类型有
存在的化学键的类型有(6)将h元素的气态单质通入KI溶液中,反应后加入
 并振荡,有机层显
并振荡,有机层显
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】下表为部分短周期元素化合价及相应原子半径的数据:
已知:①A与D可形成化合物AD2、AD3,②E与D可形成多种化合物,其中ED、ED2是常见的化合物,C可用于制光电池。
(1)用电子式表示A的氢化物与足量H 的最高价氧化物对应水化物反应生成的盐的形成过程:____________________________________________________________ ;
(2)E的简单气态氢化物极易溶于水的原因有:①_____________________________ ;
②____________________________________________ 。
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是_______________ 。
(4)将标准状况下40L无色气体ED与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式_______________________ 。
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.186 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +1 | ||
| 最低化合价 | ﹣2 | ﹣3 | ﹣4 | ﹣2 | ﹣3 | ﹣1 | ﹣1 | 0 |
(1)用电子式表示A的氢化物与足量H 的最高价氧化物对应水化物反应生成的盐的形成过程:
(2)E的简单气态氢化物极易溶于水的原因有:①
②
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是
(4)将标准状况下40L无色气体ED与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】A、B、D、E、G、M ,六种元素位于元素周期表前四周期,原子序数依次增大。其中元素A是宇宙中含量最多的元素,其一种核素原子核内无中子,B的单质既可以由分子组成也可以形成空间网状结构,化合物DE2为通常条件下为红棕色气体, G是前四周期中电负性最小的元素,M的原子最外层只有一个电子,其次外层内的所有轨道的电子均成对。请回答下列问题:
(1)基态G原子的简化电子排布式是_______ ,M在元素周期表中的位置是_______ 。
(2)元素B、D、E的第一电离能由大到小的顺序为_______ (用元素符号表示,下同),电负性由大到小的顺序为_______ 。
(3)M的同周期元素中,核外未成对电子数最多的元素的价层电子轨道表示式_______ 。
(4)写出由A、B、D、E四种元素组成的,最简单的、具有两性的共价化合物的结构简式_______ 。
(1)基态G原子的简化电子排布式是
(2)元素B、D、E的第一电离能由大到小的顺序为
(3)M的同周期元素中,核外未成对电子数最多的元素的价层电子轨道表示式
(4)写出由A、B、D、E四种元素组成的,最简单的、具有两性的共价化合物的结构简式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y与X形成的分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z两种元素的元素符号:X__ 、Z__ 。
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的化学键属于__ 键;含有离子键和共价键的化合物的化学式为__ 。
(3)由X、Y、Z所形成的常见离子化合物是__ (写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为__ 。X与W形成的化合物与水反应时,水是__ (填“氧化剂”或“还原剂”)。
(4)用电子式表示W与Z形成W2Z化合物的过程:__ 。
(5)Q与Z同主族,位于第4周期,其原子序数为__ 。
(1)X、Z两种元素的元素符号:X
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的化学键属于
(3)由X、Y、Z所形成的常见离子化合物是
(4)用电子式表示W与Z形成W2Z化合物的过程:
(5)Q与Z同主族,位于第4周期,其原子序数为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】元素a、b、c、d、e为前20号主族元素,原子序数依次增大。b元素原子最外层电子数与核外电子总数之比为2:3;c的氢化物能与其最高价氧化物对应的水化物反应生成一种盐;a与b、c均可以形成电子总数为10的分子;d元素的氧化物能使品红溶液褪色,且加热后品红颜色复原;e原子是前20号主族元素中原子半径最大的。
请回答:
(1)e元素在周期表中的位置是_______________ 。
(2)bd2的电子式是__________________ 。
(3)e的最高价氧化物的水化物所含化学键类型为___________ ,其溶液足量与b的最高价氧化物反应的离子方程式为_________________________ 。
(4)a与b形成的8核18电子物质的化学式是______________ 。
(5)b、c、d、e原子半径由大到小的顺序是___________________ (用元素符号回答)。
请回答:
(1)e元素在周期表中的位置是
(2)bd2的电子式是
(3)e的最高价氧化物的水化物所含化学键类型为
(4)a与b形成的8核18电子物质的化学式是
(5)b、c、d、e原子半径由大到小的顺序是
您最近一年使用:0次



