短周期元素A、B、C、D、E、F、G,其原子半径及主要化合价列表如表。用化学用语回答:
(1)A元素在周期表中的位置是_______ 。
(2)以上元素可形成的简单氢化物中,沸点最高的是_______ 。
(3)写出同时含A、C、D、F四种元素的离子化合物的化学式(任写一种)_______ 。
(4)C元素在一定条件下可置换出G单质。当1 mol还原剂参加反应时转移电子数为_______ 。若该反应可在高温条件下自发进行,可判断该反应的ΔH_______ 0(填“>”、“<”或“=”,下同)、ΔS_______ 0。
(5)B和E两种元素组成的化合物E2B2是一种黄红色液体,遇水迅速反应,产生能使品红溶液褪色的气体和淡黄色的沉淀。若0.1 mol的E2B2与足量水充分反应放热Q kJ的热量,写出E2B2与水反应的热化学方程式_______ 。
| 元素代码 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.075 | 0.099 | 0.077 | 0.074 | 0.102 | 0.037 | 0.117 |
| 主要化合价 | -3,+5 | -1,+7 | -4,+4 | -2 | -2,+6 | +1 | -4,+4 |
(2)以上元素可形成的简单氢化物中,沸点最高的是
(3)写出同时含A、C、D、F四种元素的离子化合物的化学式(任写一种)
(4)C元素在一定条件下可置换出G单质。当1 mol还原剂参加反应时转移电子数为
(5)B和E两种元素组成的化合物E2B2是一种黄红色液体,遇水迅速反应,产生能使品红溶液褪色的气体和淡黄色的沉淀。若0.1 mol的E2B2与足量水充分反应放热Q kJ的热量,写出E2B2与水反应的热化学方程式
更新时间:2022-07-10 21:18:47
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】从2014年4月15日零点开始,上海市空气质量实时发布系统将以实时空气质量指数替代原来的AQI指数。燃煤烟气和汽车尾气是引发AQI指数上升的主要污染源。因此,对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。
汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g) N2(g)+2CO2(g)+Q(Q>0)。
N2(g)+2CO2(g)+Q(Q>0)。
(1)该热化学反应方程式的意义是___ 。
一定条件下用气体传感器测得该反应在不同时间的NO和CO浓度如下表:
(2)前2s内的平均反应速率v(N2)___ (保留两位小数);CO的平衡转化率为___ 。
(3)下列描述中能说明上述反应已达平衡的是__ 。
a.2v正(NO)=v逆(N2)
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中CO的转化率不再发生变化
(4)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,并获得铵盐。其中脱硫的总反应式:SO2+O3+2NH3+H2O→(NH4)2SO4+O2;在(NH4)2SO4溶液中存在水解反应,常温下该水解反应的平衡常数表达式可表示为K=___ ;
有三种铵盐溶液:①NH4Cl ②(NH4)2SO4 ③NH4HSO4,若它们的物质的量浓度相等,c(NH4+)由大到小的顺序是__ (填序号,下同);若它们的pH值相等,c(NH4+)由大到小的顺序是__ 。
汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)
 N2(g)+2CO2(g)+Q(Q>0)。
N2(g)+2CO2(g)+Q(Q>0)。(1)该热化学反应方程式的意义是
一定条件下用气体传感器测得该反应在不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)/mol.L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| C(CO)/mol.L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(3)下列描述中能说明上述反应已达平衡的是
a.2v正(NO)=v逆(N2)
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中CO的转化率不再发生变化
(4)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,并获得铵盐。其中脱硫的总反应式:SO2+O3+2NH3+H2O→(NH4)2SO4+O2;在(NH4)2SO4溶液中存在水解反应,常温下该水解反应的平衡常数表达式可表示为K=
有三种铵盐溶液:①NH4Cl ②(NH4)2SO4 ③NH4HSO4,若它们的物质的量浓度相等,c(NH4+)由大到小的顺序是
您最近一年使用:0次
【推荐2】在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应: 2X(g)+Y(g)⇌aZ(g)+W(g) ∆H=-QkJ·mol-1(Q>0)(a是正整数)当反应达到平衡后,反应放出的热量为Q1kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则:
(1) 化学计量数a的值为_______
(2) 平衡常数K的表达式为________ ,温度升高,平衡常数K的值_______ ;保持温度不变,再充入一定量的X,达到新的平衡,平衡常数K的值_______ (填“增大”、“减小”或“不变”)。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?_______
(4)维持温度不变,若向该密闭容器中加入4 mol X和2 mol Y,当反应达到平衡后,物质X的转化率_________ (填“增大”、“减小”或“不变”)。
(5)说明上述反应达到平衡状态的是_____________
A.一段时间内,生成2molX同时就生成1molW
B.反应速率V(X)=2V(Y)
C. 体系中混合气体的密度不再改变
D. 混合气体的平均相对分子质量不再改变
(6)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1kJ的是_____________ (稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、O.5 mol W
D.2 molX、1mol Y、lmolZ
(1) 化学计量数a的值为
(2) 平衡常数K的表达式为
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?
(4)维持温度不变,若向该密闭容器中加入4 mol X和2 mol Y,当反应达到平衡后,物质X的转化率
(5)说明上述反应达到平衡状态的是
A.一段时间内,生成2molX同时就生成1molW
B.反应速率V(X)=2V(Y)
C. 体系中混合气体的密度不再改变
D. 混合气体的平均相对分子质量不再改变
(6)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1kJ的是
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、O.5 mol W
D.2 molX、1mol Y、lmolZ
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.1kJ/mol
CO(g)+3H2(g) △H1=+206.1kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g) △H2=+247.3kJ/mol
2CO(g)+2H2(g) △H2=+247.3kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ/mol
CO2(g)+H2(g) △H3=-41.2kJ/mol


请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v (H2)=_____ ;10min时,改变的外界条件可能是________ 。
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象_____ 。
(3)800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应③中正、逆反应速率的关系式是____________ (填代号)。
a.v(正)>v (逆) b.v(正)<v (逆)
c.v(正)= v (逆) d.无法判断.
①CH4(g)+H2O(g)
 CO(g)+3H2(g) △H1=+206.1kJ/mol
CO(g)+3H2(g) △H1=+206.1kJ/mol②CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H2=+247.3kJ/mol
2CO(g)+2H2(g) △H2=+247.3kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=-41.2kJ/mol
CO2(g)+H2(g) △H3=-41.2kJ/mol


请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v (H2)=
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象
(3)800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时反应③中正、逆反应速率的关系式是
a.v(正)>v (逆) b.v(正)<v (逆)
c.v(正)= v (逆) d.无法判断.
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】R、T、W、X、Y、Z都是短周期元素,且W、X、Y、Z的核电荷数依次增大。下表列出它们的性质和结构:
(1)Y原子的价电子排布式为___________ ,T、X、Z的电负性由大到小的顺序为___________ 用化学符号填空)。
(2)WTR分子中的三个原子除W原子外均为8电子构型,根据电子云重叠方式的不同,分子里共价键的类型有___________ 。(填σ键、π键)
(3)常温下,RW3是一种刺激性气味、易液化的气体。RW3极易溶于水的原因是___________ 。
(4)将过量的RW3气体通入盛有硫酸铜溶液的试管里,现象为___________ 。
| 元素编号 | 元素性质或原子结构 |
| R | 原子价电子排布式为nsnnpn+1 |
| T | 基态原子核外3个能级上有电子,且各能级上的电子数相等 |
| W | 原子电子层数与核外电子数相等 |
| X | 核外s能级上的电子总数与P能级上的电子总数相等 |
| Y | 元素的原子半径在该周期中最大(除稀有气体外) |
| Z | 原子核外P能级上的电子总数比s能级上的电子总数多2 |
(2)WTR分子中的三个原子除W原子外均为8电子构型,根据电子云重叠方式的不同,分子里共价键的类型有
(3)常温下,RW3是一种刺激性气味、易液化的气体。RW3极易溶于水的原因是
(4)将过量的RW3气体通入盛有硫酸铜溶液的试管里,现象为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】A、B、C、D四种元素,A单质在B单质中燃烧发出苍白色火焰,C单质跟A、D形成的化合物的水溶液反应生成A单质,C原子与B原子的电子层相同,且最外层电子数之差为奇数,D原子最外层电子数为K层电子数的3倍,其单质为淡黄色固体。
(1)四种元素符号为A_________ ,B_________ ,C_________ ,D_________ ;
(2)离子的电子层结构相同的二种元素是_________ ,离子的结构示意图分别为_________ 、_________ ;
(3)四种元素中能形成AB型共价化合物的元素是__ ,由它们的同位素原子形成的AB型分子共有___ ,其中质量数最小的一种分子可用同位 素符号表示为_____ 。
(1)四种元素符号为A
(2)离子的电子层结构相同的二种元素是
(3)四种元素中能形成AB型共价化合物的元素是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】A、B、C、D、E、F六种元素,均位于周期表的前四周期,它们的核电荷数依次增加,A原子的L层p轨道中有2个电子,B元素在同周期元素中电负性最大,C与A原子的价电子数相同,D的最高价含氧酸酸性最强,E原子核外不成对电子数最多,F元素能形成的双原子分子,其单质在常温下呈液态。
(1)A的最高价含氧酸酸根离子的价层电子对数为_____ ,其 模型是
模型是_____ 。
(2)B、D、F简单氢化物沸点由高到低的顺序为_____ (填化学式),原因是_____ 。
(3)与E同族的第n周期元素核外电子排布不遵循洪特规则特例,则它的外围电子排布式为_____ 。
(4)与A相比,从电子云重叠方式的角度解释为什么C的原子间难以形成双键和叁键_____ 。
(1)A的最高价含氧酸酸根离子的价层电子对数为
 模型是
模型是(2)B、D、F简单氢化物沸点由高到低的顺序为
(3)与E同族的第n周期元素核外电子排布不遵循洪特规则特例,则它的外围电子排布式为
(4)与A相比,从电子云重叠方式的角度解释为什么C的原子间难以形成双键和叁键
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】短周期主族元素X、Y、Z、M、W的原子序数依次递增,X的简单阴离子与He原子具有相同的电子层结构,Y基态原子未成对电子数在所处周期中最多,M是地壳中含量最多的金属元素,W原子最外层电子数是K层电子数的3倍,Z、W同主族。
(1)下列说法正确的是______ 。
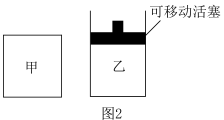
A.原子半径:
B.X、Y、Z三种元素只能形成共价化合物
C.W的简单气态氢化物的热稳定性比Z的强
D.M的单质能溶于W的最高氧化物对应水化物的稀溶液
(2)X、Y、Z、M、W五种元素中:
①电负性最小的元素是______  填元素的符号,下同
填元素的符号,下同 ,第一电离能最大的元素是
,第一电离能最大的元素是______ 。
②Z原子的电子排布图 轨道表示式
轨道表示式 为
为______ ,W的电子排布式为______ 。
③如图可以表示Y单质分子中电子云重叠方式的是______ 。
A. B.
B.  C.
C.  D.
D. 
1mol Y单质分子中含有 键的数目为
键的数目为______ 。
④Y的简单气态氢化物极易溶于水,其原因是______ ;一种含碳元素的阴离子R与Y的简单气态氢化物互为等电子体,写出R的电子式:______ 。
⑤向W的简单气态氢化物的水溶液中通入Z的单质,有W的单质析出,可以验证Z 的非金属性强于W,该反应的离子方程式为______ 。
(3)向含有M简单离子的溶液中加入过量NaOH溶液,可生成 。
。
①不考虑空间构型 要标出配位键,M要用元素符号表示
要标出配位键,M要用元素符号表示 ,
, 的结构可用示意图表示为
的结构可用示意图表示为______ 。
② 的空间构型为
的空间构型为______ ,其M原子轨道的杂化类型为______ 。
(4)铁、铜和Y元素可生成晶胞结构图1 所示的化合物,该化合物的化学式为______ 。
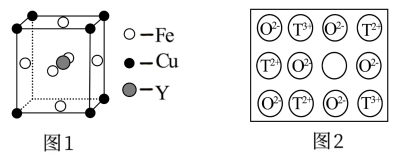
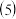 天然的和绝大部分人工制备的晶体都存在各种缺陷。如某过渡元素T的基态原子中的未成对电子数恰好等于最外层电子数;而其3d能级上的电子数等于最外层电子数的4倍。这种T的氧化物的晶胞结构就存在缺陷
天然的和绝大部分人工制备的晶体都存在各种缺陷。如某过渡元素T的基态原子中的未成对电子数恰好等于最外层电子数;而其3d能级上的电子数等于最外层电子数的4倍。这种T的氧化物的晶胞结构就存在缺陷 如图2所示
如图2所示 。
。
①基态 的外围电子排布式为
的外围电子排布式为______ ;若该T的氧化物晶体中每有1个 空缺,则应有
空缺,则应有______ 个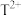 倍
倍 所取代,才能使晶体仍呈电中性。
所取代,才能使晶体仍呈电中性。
②若某T的氧化物晶体样品中 与
与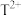 的离子数之比为1:11,则该晶体的化学式为
的离子数之比为1:11,则该晶体的化学式为______ 。
(1)下列说法正确的是
A.原子半径:
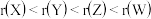
B.X、Y、Z三种元素只能形成共价化合物
C.W的简单气态氢化物的热稳定性比Z的强
D.M的单质能溶于W的最高氧化物对应水化物的稀溶液
(2)X、Y、Z、M、W五种元素中:
①电负性最小的元素是
 填元素的符号,下同
填元素的符号,下同 ,第一电离能最大的元素是
,第一电离能最大的元素是②Z原子的电子排布图
 轨道表示式
轨道表示式 为
为③如图可以表示Y单质分子中电子云重叠方式的是
A.
 B.
B.  C.
C.  D.
D. 
1mol Y单质分子中含有
 键的数目为
键的数目为④Y的简单气态氢化物极易溶于水,其原因是
⑤向W的简单气态氢化物的水溶液中通入Z的单质,有W的单质析出,可以验证Z 的非金属性强于W,该反应的离子方程式为
(3)向含有M简单离子的溶液中加入过量NaOH溶液,可生成
 。
。①不考虑空间构型
 要标出配位键,M要用元素符号表示
要标出配位键,M要用元素符号表示 ,
, 的结构可用示意图表示为
的结构可用示意图表示为②
 的空间构型为
的空间构型为(4)铁、铜和Y元素可生成晶胞结构图1 所示的化合物,该化合物的化学式为

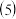 天然的和绝大部分人工制备的晶体都存在各种缺陷。如某过渡元素T的基态原子中的未成对电子数恰好等于最外层电子数;而其3d能级上的电子数等于最外层电子数的4倍。这种T的氧化物的晶胞结构就存在缺陷
天然的和绝大部分人工制备的晶体都存在各种缺陷。如某过渡元素T的基态原子中的未成对电子数恰好等于最外层电子数;而其3d能级上的电子数等于最外层电子数的4倍。这种T的氧化物的晶胞结构就存在缺陷 如图2所示
如图2所示 。
。①基态
 的外围电子排布式为
的外围电子排布式为 空缺,则应有
空缺,则应有 倍
倍 所取代,才能使晶体仍呈电中性。
所取代,才能使晶体仍呈电中性。②若某T的氧化物晶体样品中
 与
与 的离子数之比为1:11,则该晶体的化学式为
的离子数之比为1:11,则该晶体的化学式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】Ⅰ.几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。(请用相应的化学用语答题 )
(1)R的元素符号为________ ;M在元素周期表中的位置为________________ 。
(2)X与Y按原子个数比1∶1构成的物质的电子式为________________ ;所含化学键类型__________________________ 。
(3)X+、Y2-、M2-离子半径大小顺序为__________________ 。
(4)将YM2通入FeCl3溶液中的离子方程式:_________________________________________ 。
Ⅱ.如图转化关系(A、B、C中含相同元素)
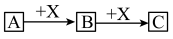
(1)若B为白色胶状不溶物,则A与C反应的离子方程式为_________________________ 。
(2)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应生成B的离子方程式为_____________________________________________ 。
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)R的元素符号为
(2)X与Y按原子个数比1∶1构成的物质的电子式为
(3)X+、Y2-、M2-离子半径大小顺序为
(4)将YM2通入FeCl3溶液中的离子方程式:
Ⅱ.如图转化关系(A、B、C中含相同元素)

(1)若B为白色胶状不溶物,则A与C反应的离子方程式为
(2)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应生成B的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答:
(1)推断B在元素周期表中的位置______________ ,写出E2D的电子式__________ .
(2)写出A与D形成的10电子阳离子的化学式______________ .
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是_______________ .
(4)常温下,1molA的单质在D的单质中完全燃烧生成液态水,放出286kJ的热量,写出该反应的热化学方程式________________________ .
(5)在Fe和Cu的混合物中,加入一定量的C的最高价氧化物对应的水化物的稀溶液,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分反应后剩余金属m2g.下列说法正确的是_____________ .
A.m1一定大于m2
B.剩余固体m2中一定没有单质Cu
C.加入稀硫酸前、后的溶液中肯定都有Fe2+
D.加入稀硫酸前、后的溶液中肯定都有Cu2+
(1)推断B在元素周期表中的位置
(2)写出A与D形成的10电子阳离子的化学式
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是
(4)常温下,1molA的单质在D的单质中完全燃烧生成液态水,放出286kJ的热量,写出该反应的热化学方程式
(5)在Fe和Cu的混合物中,加入一定量的C的最高价氧化物对应的水化物的稀溶液,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分反应后剩余金属m2g.下列说法正确的是
A.m1一定大于m2
B.剩余固体m2中一定没有单质Cu
C.加入稀硫酸前、后的溶液中肯定都有Fe2+
D.加入稀硫酸前、后的溶液中肯定都有Cu2+
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】下表显示了元素周期表中短周期的一部分,X、Y、Z、G、M、E代表6种短周期元素,请回答以下问题。
(1)E的元素符号是___________ ,其在元素周期表中的位置是___________ ,其原子结构示意图为___________ 。
(2)X的元素符号是___________ ,X的离子与Z的离子相比,半径关系是X___________ Z(填“>”“=”或“<”)。
(3) 的电子式为
的电子式为___________ (用元素符号表示,下同),其中所含化学键的类型是___________ 。
(4)用电子式表示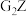 的形成过程
的形成过程___________ 。
(5)M的最高价氧化物对应的水化物与G的最高价氧化物对应的水化物发生反应的离子方程式是___________ 。
(6)上述6种元素中,金属性最强的是___________ 。
| X | Y | Z | |||||
| G | M | E |
(2)X的元素符号是
(3)
 的电子式为
的电子式为(4)用电子式表示
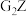 的形成过程
的形成过程(5)M的最高价氧化物对应的水化物与G的最高价氧化物对应的水化物发生反应的离子方程式是
(6)上述6种元素中,金属性最强的是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100mL2mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍。根据上述条件,回答:
(1)元素C位于第______________ 周期______________ 族,它的最高价氧化物的化学式为______________ 。
(2)A是______________ 元素,B是______________ 元素,D是______________ 元素。
(3)A与D形成稳定的化合物的化学式为______________ ,判断该化合物在空气中是否变质的简单方法是______________ 。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为______________ 。
(1)元素C位于第
(2)A是
(3)A与D形成稳定的化合物的化学式为
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】下表为元素周期表的一部分,请回答有关问题:

(1)⑤的元素符号是______ ;
(2)②的离子结构示意图__________________ ;
(3)表中最活泼的金属是______ (填写元素符号);
(4)表中元素②③④的原子半径由大到小排列____________ (用元素符号表示);
(5)表中能形成两性氢氧化物的元素是______ ,分别写出该元素的氢氧化物与⑨最高价氧化物对应水化物反应的离子方程式: __________________________________ ;
(6)比较⑦、⑩单质氧化性的强弱:___________ (用化学式表示),请设计一个实验证明你的结论__________________________________ 。

(1)⑤的元素符号是
(2)②的离子结构示意图
(3)表中最活泼的金属是
(4)表中元素②③④的原子半径由大到小排列
(5)表中能形成两性氢氧化物的元素是
(6)比较⑦、⑩单质氧化性的强弱:
您最近一年使用:0次



