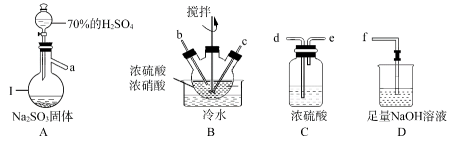
已知:①亚硝酰硫酸是白色片状、多孔或粒状晶体,遇水分解为硫酸、硝酸和NO,溶于浓硫酸而不分解。
②实验室制备亚硝酰硫酸的原理为SO2+HNO3=SO3+HNO2,SO3+HNO2=NOSO4H。
回答下列问题:
(1)仪器I的名称为
(2)按照气流从左到右的顺序,上述仪器的连接顺序为
(3)装置B中的“冷水”控制在20℃左右,温度不宜过高或过低的原因是
(4)在上述反应条件下,开始时反应缓慢,但某时刻反应速率明显加快,其原因是
(5)如果不使用装置C,造成的影响是
(6)测定亚硝酰硫酸的纯度
已知:2KMnO4 + 5NOSO4H +2H2O =K2SO4 + 2MnSO4 + 5HNO3 +2H2SO4;2
 + 5
+ 5 +16H+ =2Mn2++10CO2↑+8H2O。
+16H+ =2Mn2++10CO2↑+8H2O。步骤如下:
步骤1:准确称取14. 00g产品,在特定条件下配制成250 mL溶液。
步骤2:取25. 00 mL产品于250 mL容量瓶中,加入60. 00 mL未知浓度KMnO4溶液(过量)和10. 00 mL 25%H2SO4溶液,然后摇匀。
步骤3:用0. 2500 mol· L-1 Na2C2O4标准溶液滴定,消耗Na2C2O4溶液20. 00 mL。
把亚硝酰硫酸溶液换为蒸馏水(空白实验) ,复上述步骤,消耗Na2C2O4溶液的体积为60. 00 mL。
①达到滴定终点时的现象为
②亚硝酰硫酸的纯度为
相似题推荐
(1)海水中溶解无机碳占海水总碳的95%以上,主要以HCO
 形式存在,其准确测量是研究海洋碳循环的基础。测量溶解无机碳,可采用滴定的方法:取20mL海水于锥形瓶中,用
形式存在,其准确测量是研究海洋碳循环的基础。测量溶解无机碳,可采用滴定的方法:取20mL海水于锥形瓶中,用
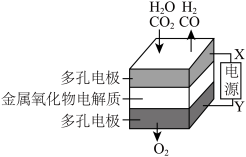
图1 图2
(2)在体积可变的恒压(P0)密闭容器中,一定量的CO2与足量的碳反应:C(s)+CO2(g)⇌2CO(g)。平衡时,体系中CO2和CO气体体积分数与温度的关系如图所示。
(已知:气体分压=气体总压×气体体积分数。)请回答下列问题:
①C(s)+CO2(g)⇌2CO(g) ΔH
②550℃时,若充入惰性气体,平衡
③650℃时,反应达平衡后CO2的转化率为
④925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=
(3)在固态金属氧化物电解池中,高温共电解H2O﹣CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。其中X是电源的
或“负”),阴极的反应式是:
①配制250 mL待标定的K2CrO4溶液。
②标定测得K2CrO4溶液浓度为0.6025 mol/L。
③按下表数据将0.2000 mol/LCaCl2溶液、K2CrO4溶液及蒸馏水混匀,静置(溶液体积变化忽略不计)。
④取上层清液于锥形瓶中,加入H2SO4和H3PO4溶液酸化,溶液由黄色转变为橙色,加入指示剂,用0.2000 mol/L(NH4)2Fe(SO4)2溶液滴定,数据记入下表。
组别 体积(mL) 物质 | 1 | 2 | 3 | 4 | 5 | 6 |
CaCl2 | 25.00 | 25.00 | 25.00 | 25.00 | 25.00 | 25.00 |
K2CrO4 | 15.00 | 16.00 | 17.00 | 18.00 | 19.00 | 20.00 |
蒸馏水 | 10.00 | 9.00 | 8.00 | 7.00 | 6.00 | 5.00 |
取上层清液 | 10.00 | 10.00 | 10.00 | 10.00 | 10.00 | 10.00 |
耗(NH4)2Fe(SO4)2 | 13.33 | 15.00 | 16.78 | 18.42 | 20.15 | 21.89 |
 ),进而计算出上层清液中的c(Ca2+),即得Ksp(CaCrO4)。
),进而计算出上层清液中的c(Ca2+),即得Ksp(CaCrO4)。回答下列问题:
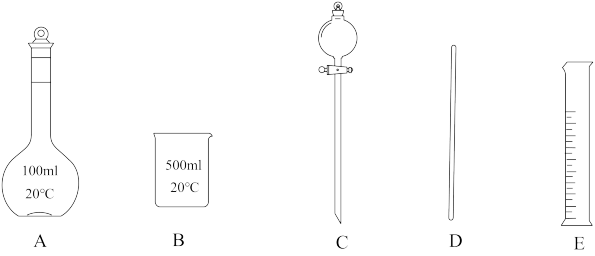
(1)步骤①中无需使用下列哪些仪器
(2)基态Cr原子的电子排布式为
(3)步骤④中所得橙色溶液中铬元素的主要存在形式为
(4) 根据第2组滴定数据,计算得上层清液中c(
 )=
)=(5)滴定时,有一组数据出现了明显异常,所测c(
 )偏大,原因可能有
)偏大,原因可能有A.滴定终点读数时仰视刻度线 B.达终点时滴定管尖嘴有标准液悬挂
C.盛装待测液的锥形瓶未润洗 D.摇动锥形瓶时有液体溅出
(6)利用上表数据经计算绘制出如下图点,请根据图点绘出溶度积曲线
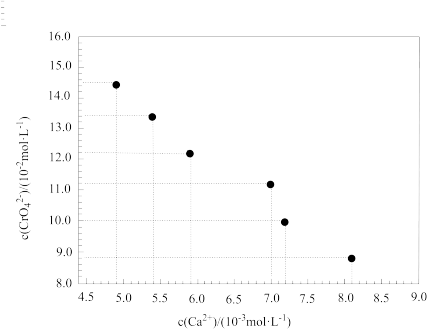
(7)请结合图线推测Ksp(CaCrO4)≈
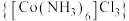 是黄色或橙黄色晶体,实验室以
是黄色或橙黄色晶体,实验室以 为原料经催化制备
为原料经催化制备 ,步骤如下:
,步骤如下:I.
 的制备
的制备 可以通过钴和氯气反应制得,实验室制备纯净
可以通过钴和氯气反应制得,实验室制备纯净 可用如图实验装置(已知:
可用如图实验装置(已知: 易潮解)。
易潮解)。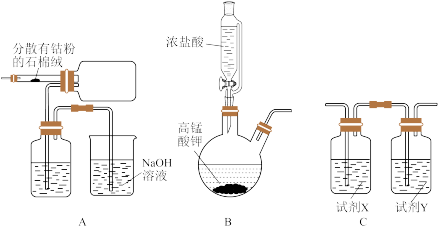
(1)B装置用于制备氯气,其反应的化学方程式为
(2)组装好仪器进行实验时,要先加入浓盐酸,使B装置中开始生成氯气,待A装置内充满黄绿色气体,再加热A装置中的钴粉,目的是
II.三氯化六氨合钴(Ⅲ)的制备。其原理为:

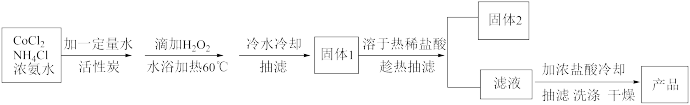
已知:三氯化六氨合钴不溶于乙醇,常温水中溶解度较小。
(3)水浴温度不超过60℃的原因是
(4)下列说法不正确的是_______(填标号)。
A. 除作为反应物外,还有调节溶液的pH、增强 除作为反应物外,还有调节溶液的pH、增强 的氧化性的作用 的氧化性的作用 |
| B.活性炭是脱色剂、固体2是活性炭 |
C.加入浓盐酸,析出产品的反应方程式为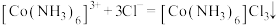 |
| D.可用乙醇水溶液洗涤产品 |
III.晶体结构测定与钴含量分析。
(5)测定晶体结构最常见的仪器是
 中心离子采取
中心离子采取 杂化,其空间结构为
杂化,其空间结构为(6)利用
 将KI氧化成
将KI氧化成 ,
, 被还原后的产物为
被还原后的产物为 。然后用
。然后用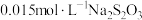 标准溶液滴定生成的
标准溶液滴定生成的 ,
, 所得产物为
所得产物为 。若称取样品的质量为0.295g,滴定
。若称取样品的质量为0.295g,滴定 时,达到终点消耗
时,达到终点消耗 标准溶液的平均体积为54.00mL。该样品中钴元素的质量分数为
标准溶液的平均体积为54.00mL。该样品中钴元素的质量分数为
该工艺条件下,有关金属阳离子开始沉淀和完全沉淀的pH如表:
| 金属阳离子 | Fe2+ | Fe3+ | Al3+ |
| 开始沉淀的pH | 9.5 | 2.2 | 3.7 |
| 完全沉淀的pH | 11.1 | 3.1 | 4.7 |
(1)基态Fe2+的核外电子排布式为
(2)进行“酸浸”操作最适合选择的试剂为
(3)下列有关说法错误的是
| A.适当增大酸的浓度可以提高酸浸效率 |
| B.滤渣①的主要成分可用作太阳能电池板 |
| C.“操作1”和“操作2”均为过滤 |
| D.“操作3”需使用的主要仪器为蒸发皿 |
A.HNO3 B.KMnO4 C.H2O2
其中涉及的离子方程式为
(5)“调节pH”的范围是

回答下列问题:
(1)酸浸时,REPO4转化为
 ,可以适当升高温度,目的是
,可以适当升高温度,目的是(2)TBP是磷酸三丁酯,不溶于水,能萃取金属阳离子和酸分子(H3PO4、HNO3等)。加入氨水反萃取的原理是
(3)水相Ⅱ过滤后得到的滤渣的主要成分为REPO4、Ca3(PO4)2、CaHPO4,后续加入硫酸的主要目的是
(4)加入H2C2O4,含稀土元素的离子转化为草酸盐,将得到的部分草酸晶体
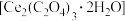 用热重法对其进行分析,得到剩余固体的质量随温度变化的曲线如图所示。已知200℃~580℃之间
用热重法对其进行分析,得到剩余固体的质量随温度变化的曲线如图所示。已知200℃~580℃之间 受热分解反应生成一种含铈物质和CO,写出该反应的化学方程式
受热分解反应生成一种含铈物质和CO,写出该反应的化学方程式
②已知c点固体是纯净的含铈氧化物,则该物质为
【推荐3】镓(Ga)是重要的半导体材料,氮化镓、砷化镓和氧化镓分别是第二代、第三代、第四代半导体材料的代表材料。金属镓在自然界中通常以微量分散于铝土矿、闪锌矿等矿石中,提取非常困难。从闪锌矿渣中提取镓是种常见的方法,具体工艺流程如下:

已知:①金属镓在化学性质上非常接近金属铝,其单质、氧化物和氢氧化物均有两性;
②闪锌矿渣通常含有 ,
, 、
、 ,硅酸盐等杂质;
,硅酸盐等杂质;
③25℃时,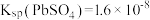 、
、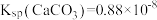 。
。
回答下列问题:
(1)为了提高镓的浸取率,可以采取的措施为
(2)滤渣Ⅰ中主要含有
(3)写出加入氧化锌后发生反应的离子方程式(以Ga为例):
(4)工业上通常向
 溶液中通入过量
溶液中通入过量 ,产生大量白色沉淀,过滤后加热固体能得到高纯
,产生大量白色沉淀,过滤后加热固体能得到高纯 ,写出加入过量
,写出加入过量 后的化学方程式:
后的化学方程式:(5)在工业上,通常用高纯镓作阴极,石墨作阳极,
 溶液作为电解质,通过电解制备高纯Ga.写出阴极电极反应式:
溶液作为电解质,通过电解制备高纯Ga.写出阴极电极反应式:(6)氮化镓是目前应用最广泛的半导体材料之一,目前广泛应用于相控阵雷达、快速充电器等行业。氮化镓有不同的晶型,其中六方氮化镓和立方氮化镓之间可以相互转化。

①六方氮化镓晶体硬度极高,熔点为1700℃,其高温熔融物不导电。六方氮化镓属于
②写出六方氮化镓晶胞的组成:
(7)①已知
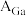 的坐标为
的坐标为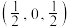 ,请写出
,请写出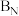 的坐标
的坐标②若立方氮化镓的边长为a nm,则其密度为 (列出计算式)。
(列出计算式)。

(1)酸性条件下,含I-的卤水发生如下反应:
 +I-+____→NO ↑+I2 +_____,补充完整方程式并配平:
+I-+____→NO ↑+I2 +_____,补充完整方程式并配平:(2)上述反应为什么不选用常见的氧化剂氯气,而选择价格并不便宜的NaNO2,可能原因是
(3)从第②步反应后的溶液中提纯I2涉及到的方法可以是
a.萃取 b.升华 c.纸层析 d.过滤
(4)在富集碘元素过程中,还使用了NaHSO3溶液。该物质既能水解又能电离,设计实验验证其水解程度和电离程度的相对大小
已知:a.反应原理:CH2OH( CHOH)4CHO+Br2+H2O
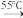 C6H12O7(葡萄糖酸)+2HBr;2C6H12O7 (葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
C6H12O7(葡萄糖酸)+2HBr;2C6H12O7 (葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑b.相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 |
| 在水中的溶解性 | 可溶于冷水,易溶于热水 | 可溶 | 极易溶 |
| 在乙醇中的溶解性 | 微溶 | 微溶 | 可溶 |


c.相关物质酸性:氢溴酸>葡萄糖酸>碳酸
d.相关物质相对分子质量:葡萄糖180,葡萄糖酸钙430
回答下列问题:
(1)步骤Ⅰ中溴水氧化葡萄糖时,甲同学设计了如图a的反应装置。你认为缺少的仪器
(2)步骤Ⅱ中加入过量CaCO3,除了能提高葡萄糖酸的转化率,还有的作用是
(3)步骤Ⅲ的“操作”是将所得悬浊液煮沸,并趁热采用装置b抽滤,滤掉未反应的CaCO3,得到澄清透明的葡萄糖酸钙溶液。抽滤时自来水流的作用是使瓶内与大气形成压强差。与普通过滤操作相比,抽滤的优点是
(4)步骤Ⅴ洗涤操作洗涤剂选用乙醇-水混合溶液,理由是
(5)该实验中葡萄糖酸钙的产率为
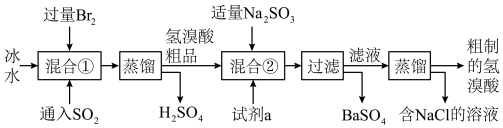
回答下列问题:
(1)混合①中发生反应的离子方程式为
(2)混合②中加入试剂a是
(3)工业氢溴酸常带有淡淡的黄色,可能的原因是:①含Fe3+,②含Br2,③含Fe3+和Br2,只用下列一种试剂就能分析产生淡黄色的原因,该试剂是
a.KMnO4溶液 b.NaOH溶液 c.KSCN溶液 d.淀粉KI溶液 e.CCl4
(4)加入Na2SO3的目的是除去过量的Br2,但要防止过量,原因是
(5)实验室制取Br2的反应为:2NaBr+3H2SO4+MnO2
 2NaHSO4+MnSO4+Br2↑+2H2O,制取Br2最好选用如图装置中的
2NaHSO4+MnSO4+Br2↑+2H2O,制取Br2最好选用如图装置中的