纳米级Cu2O由于具有优良的催化性能而受关注,表中为制取Cu2O的两种方法:
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成____ 而使Cu2O产率降低。
(2)已知:①2Cu(s)+ O2(g)=Cu2O(s) △H1=-169kJ·mol-1
O2(g)=Cu2O(s) △H1=-169kJ·mol-1
②C(s)+ O2(g)=CO(g) △H2=-110.5kJ·mol-1
O2(g)=CO(g) △H2=-110.5kJ·mol-1
③Cu(s)+ O2(g)=CuO(s) △H3=-157kJ·mol-1
O2(g)=CuO(s) △H3=-157kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g) △H=____ 。
(3)方法b是用液态肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH—的浓度来制备纳米Cu2O,装置如图所示:
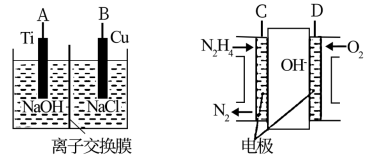
①上述装置中B电极应连____ (填“C”或“D”)电极。
②该离子交换膜为____ (填“阴”或“阳”)离子交换膜,该电解池的阴极反应式____ 。
③原电池中负极反应式为____ 。
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 电解法,反应为2Cu+H2O Cu2O+H2↑ Cu2O+H2↑ |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成
(2)已知:①2Cu(s)+
 O2(g)=Cu2O(s) △H1=-169kJ·mol-1
O2(g)=Cu2O(s) △H1=-169kJ·mol-1②C(s)+
 O2(g)=CO(g) △H2=-110.5kJ·mol-1
O2(g)=CO(g) △H2=-110.5kJ·mol-1③Cu(s)+
 O2(g)=CuO(s) △H3=-157kJ·mol-1
O2(g)=CuO(s) △H3=-157kJ·mol-1则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g) △H=
(3)方法b是用液态肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH—的浓度来制备纳米Cu2O,装置如图所示:

①上述装置中B电极应连
②该离子交换膜为
③原电池中负极反应式为
更新时间:2022-09-03 22:03:52
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】我国2020年颁布的能源法中,首次将氢能纳入能源定义。在工业市场中,甲烷水蒸气重整制氢是目前工业制氢最为成熟的方法,被广泛应用于氢气的工业生产。甲烷水蒸气重整反应体系中主要存在的反应方程式有:
反应1:CH4(g)+H2O(g)=CO(g)+3H2(g) ∆H1=+206 kJ/mol
反应2:CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ∆H2
反应3:CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H3=-41 kJ/mol
(1)∆H2=_______ kJ/mol。
(2)反应1在_______ 下自发进行(填“高温”,“低温”或“任意温度”)。
(3)一定温度下,向某容积为1L的恒容容器中充入1 mol CH4(g)和3 mol H2O(g),发生上述反应,t min后反应达到平衡。达到平衡时,容器中CO为m mol,CO2为n mol。
①t min内CH4的消耗速率为_______ mol·L-1·min-1。(用含m,n,t的代数式表示,下同)。反应1的平衡常数Kc=_______ mol2/L2。
②保持容器体积和投料量不变,分别在1MPa和5MPa下进行上述反应,测得容器中CO和CH4的含量随温度的变化如下图所示。
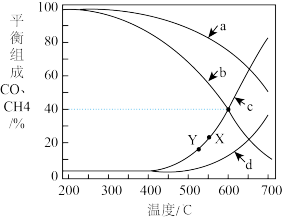
5MPa时,表示CO和CH4平衡组成随温度变化关系的曲线分别是_______ 和_______ 。X点平衡组成含量高于Y点的原因是_______ 。
(4)关于甲烷水蒸气重整制氢,下列说法正确的是_______ 。
A.甲烷水蒸气重整反应是可逆、强吸热的,因此工业生产中反应的温度越高越好
B.反应中水碳比n(H2O)/n(CH4)越高,CH4的转化率越高,因此生产中一般适当提高水碳比
C.反应过程中可以向转化炉内通入空气或氧气,为甲烷的进一步转化提供能量
D.降低压强有利于CH4转化为H2,因此生产中应适当降低压强
反应1:CH4(g)+H2O(g)=CO(g)+3H2(g) ∆H1=+206 kJ/mol
反应2:CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ∆H2
反应3:CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H3=-41 kJ/mol
(1)∆H2=
(2)反应1在
(3)一定温度下,向某容积为1L的恒容容器中充入1 mol CH4(g)和3 mol H2O(g),发生上述反应,t min后反应达到平衡。达到平衡时,容器中CO为m mol,CO2为n mol。
①t min内CH4的消耗速率为
②保持容器体积和投料量不变,分别在1MPa和5MPa下进行上述反应,测得容器中CO和CH4的含量随温度的变化如下图所示。

5MPa时,表示CO和CH4平衡组成随温度变化关系的曲线分别是
(4)关于甲烷水蒸气重整制氢,下列说法正确的是
A.甲烷水蒸气重整反应是可逆、强吸热的,因此工业生产中反应的温度越高越好
B.反应中水碳比n(H2O)/n(CH4)越高,CH4的转化率越高,因此生产中一般适当提高水碳比
C.反应过程中可以向转化炉内通入空气或氧气,为甲烷的进一步转化提供能量
D.降低压强有利于CH4转化为H2,因此生产中应适当降低压强
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】氯及其化合物在生活和生产中应用广泛。
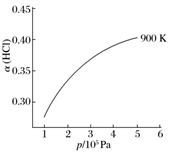
(1)已知:900 K时,4HCl(g)+O2(g) 2Cl2(g)+2H2O(g),反应自发。
2Cl2(g)+2H2O(g),反应自发。
①该反应是放热还是吸热,判断并说明理由___________________________ 。
②900 K时,体积比为4∶1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(p)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×105~4.5 ×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。
×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。_____________________
(2)已知:Cl2(g)+2NaOH(aq)===NaCl(aq)+NaClO(aq)+H2O(l) ΔHl=-102 kJ·mol-1
3Cl2(g)+6NaOH(aq)===5NaCl(aq)+NaClO3(aq)+3H2O(l) ΔH2=-422 kJ·mol-1
①写出在溶液中NaClO分解生成NaClO3的热化学方程式:________________________________ 。
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol·L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为ct mol·L-1,写出该时刻溶液中Cl-浓度的表达式:c(Cl-)=________________ (用c0、ct表示)mol·L-1。
③有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-===ClO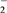 + Cl-
+ Cl-
Ⅱ.ClO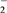 +ClO-===ClO
+ClO-===ClO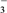 +Cl-
+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:______________________________________________________ 。
(1)已知:900 K时,4HCl(g)+O2(g)
 2Cl2(g)+2H2O(g),反应自发。
2Cl2(g)+2H2O(g),反应自发。①该反应是放热还是吸热,判断并说明理由
②900 K时,体积比为4∶1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(p)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×105~4.5
 ×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。
×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。
(2)已知:Cl2(g)+2NaOH(aq)===NaCl(aq)+NaClO(aq)+H2O(l) ΔHl=-102 kJ·mol-1
3Cl2(g)+6NaOH(aq)===5NaCl(aq)+NaClO3(aq)+3H2O(l) ΔH2=-422 kJ·mol-1
①写出在溶液中NaClO分解生成NaClO3的热化学方程式:
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol·L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为ct mol·L-1,写出该时刻溶液中Cl-浓度的表达式:c(Cl-)=
③有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-===ClO
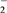 + Cl-
+ Cl-Ⅱ.ClO
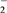 +ClO-===ClO
+ClO-===ClO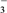 +Cl-
+Cl-常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:
您最近一年使用:0次
【推荐3】二氧化硫和一氧化碳均为常见的大气污染物,对二者的治理是当前的重要课题之一。回答下列问题:
(1)有人设计通过硫循环来完成二者的综合治理,发生如下反应:
反应I: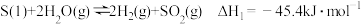
反应II: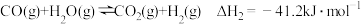
反应Ⅲ: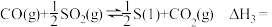
_________  。
。
(2)硫酸是一种重要的化工产品。接触法制硫酸中的关键工序是SO2的催化氧化: 。
。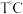 下,向容积为5L的恒容密闭容器中充入0.8molSO2和0.5molO2,发生反应,4min时反应达到平衡,此时测得SO3的物质的量分数为60%。
下,向容积为5L的恒容密闭容器中充入0.8molSO2和0.5molO2,发生反应,4min时反应达到平衡,此时测得SO3的物质的量分数为60%。
①0~4min内,用O2表示该反应的反应速率
____________  ,
, 的转化率为
的转化率为_________ %。
②保持其他条件不变,升高温度,此时反应的平衡常数K将__________ (填“增大”、“减小”或“不变”)。
③若反应达到平衡时,压强为pMPa,则该反应的平衡常数Kp=_________ (用含p的代数式表示,已知:分压=物质的量分数×总压) 。
。
(3)某实验小组模拟工业上用CO来制备C2H4(电解质为碱性溶液),实验装置如图所示。
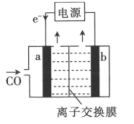
①b电极为________ (填“阳极”或“阴极”)。
②写出a电极上的电极反应式:______________ 。
(1)有人设计通过硫循环来完成二者的综合治理,发生如下反应:
反应I:
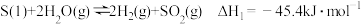
反应II:
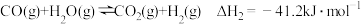
反应Ⅲ:
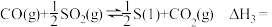
 。
。(2)硫酸是一种重要的化工产品。接触法制硫酸中的关键工序是SO2的催化氧化:
 。
。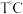 下,向容积为5L的恒容密闭容器中充入0.8molSO2和0.5molO2,发生反应,4min时反应达到平衡,此时测得SO3的物质的量分数为60%。
下,向容积为5L的恒容密闭容器中充入0.8molSO2和0.5molO2,发生反应,4min时反应达到平衡,此时测得SO3的物质的量分数为60%。①0~4min内,用O2表示该反应的反应速率

 ,
, 的转化率为
的转化率为②保持其他条件不变,升高温度,此时反应的平衡常数K将
③若反应达到平衡时,压强为pMPa,则该反应的平衡常数Kp=
 。
。(3)某实验小组模拟工业上用CO来制备C2H4(电解质为碱性溶液),实验装置如图所示。

①b电极为
②写出a电极上的电极反应式:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】Ⅰ.MgH2拥有很高的储氢密度,相对便宜的价格以及良好的可逆储氢性能,在储氢材料中具有重要作用和地位,一直都是广大研究者关注的焦点。回答下列问题:
(1)请写出MgH2的电子式:___________________ 。
(2)MgH2能与H2O反应生成白色沉淀Mg(OH)2和H2,NH3与H2O类似,MgH2与NH3反应也生成氢气,反应原理类似,请写出反应的化学方程式_____________ 。
Ⅱ.(3)甲铵(H2NCOONH4,氨基甲酸铵,简称甲铵),在不同条件下分解的能量变化如图所示,ΔH=__________________ kJ·mol−1。

Ⅲ.氨呈弱碱性,氨燃料与碱性燃料电池是一对较好的组合。直接氨碱性(膜)燃料电池总的化学方程式为:4NH3+3O2=2N2+6H2O,工作原理如图:
(4)MnO2电极为________________ 极(填“正”“负”“阴”或“阳”),写出Ni电极的电极反应式:__________ 。
(1)请写出MgH2的电子式:
(2)MgH2能与H2O反应生成白色沉淀Mg(OH)2和H2,NH3与H2O类似,MgH2与NH3反应也生成氢气,反应原理类似,请写出反应的化学方程式
Ⅱ.(3)甲铵(H2NCOONH4,氨基甲酸铵,简称甲铵),在不同条件下分解的能量变化如图所示,ΔH=

Ⅲ.氨呈弱碱性,氨燃料与碱性燃料电池是一对较好的组合。直接氨碱性(膜)燃料电池总的化学方程式为:4NH3+3O2=2N2+6H2O,工作原理如图:

(4)MnO2电极为
您最近一年使用:0次
【推荐2】回答下列问题:
(1)ClO2是新型自来水消毒剂,具有强氧化性。其一种生产工艺如图甲所示:

①电解反应的化学方程式为_______ 。
②NCl3具有强氧化性,制取ClO2反应的化学方程式为_______ 。
③饮用水中残留的ClO2可用适量FeSO4溶液去除,该反应的离子方程式为_______ 。
(2)在酸性条件下,黄铁矿(FeS2)催化氧化的流程如图乙,反应Ⅱ的离子方程式为:_______ 。
(1)ClO2是新型自来水消毒剂,具有强氧化性。其一种生产工艺如图甲所示:

①电解反应的化学方程式为
②NCl3具有强氧化性,制取ClO2反应的化学方程式为
③饮用水中残留的ClO2可用适量FeSO4溶液去除,该反应的离子方程式为
(2)在酸性条件下,黄铁矿(FeS2)催化氧化的流程如图乙,反应Ⅱ的离子方程式为:

您最近一年使用:0次
【推荐3】CuCl为白色固体,微溶于水,不溶于乙醇和稀硫酸,在空气中迅速被氧化成绿色;见光则分解,变成褐色;已知CuCl+ 3Cl-=[CuCl4]3-。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:

(1)图中的铁粉可以用二氧化硫气体代替,可以减少污染气体的排放,请写出用SO2代替铁粉进行反应的离子方程式:_____________ 。
(2)常温下形成电镀污泥时,溶液pH=9,已知Ksp[Fe(OH)3]=4×10-38,Ksp[Cu(OH)2]=2×10-20,此时溶液中c(Fe3+):c(Cu2+)=_______ 。
(3)析出CuCl晶体后,采用过滤的方法进行分离,再对晶体进行洗涤。下列关于洗涤的说法正确的是______ (填序号)。
A.因为存在CuCl的沉淀溶解平衡,所以用饱和NaCl溶液洗涤可以降低CuCl的溶解度
B.尽量少用水洗涤,防止其溶解或水解生成CuOH
C.可以用乙醇洗涤使产品快速干燥
D.洗涤时在漏斗中充分搅拌,使杂质尽可能地溶解达到除去的目的
E.如果采用减压过滤,在洗涤时应该先打开阀门与空气相通,再关闭抽气泵,然后再向漏斗中加入洗涤液
(4)第三次过滤的滤液主要成分是_________ 。
(5)对污泥进行酸浸时的化学反应方程式为___________________ 。
(6)检验氧化亚铜晶体洗涤干净的操作是_______________ 。
(7)以粗铜为电极电解一定浓度的氯化钠溶液,控制一定的电压和电流,也可以制得氯化亚铜,写出电解时的阳极反应式:_____________ 。

(1)图中的铁粉可以用二氧化硫气体代替,可以减少污染气体的排放,请写出用SO2代替铁粉进行反应的离子方程式:
(2)常温下形成电镀污泥时,溶液pH=9,已知Ksp[Fe(OH)3]=4×10-38,Ksp[Cu(OH)2]=2×10-20,此时溶液中c(Fe3+):c(Cu2+)=
(3)析出CuCl晶体后,采用过滤的方法进行分离,再对晶体进行洗涤。下列关于洗涤的说法正确的是
A.因为存在CuCl的沉淀溶解平衡,所以用饱和NaCl溶液洗涤可以降低CuCl的溶解度
B.尽量少用水洗涤,防止其溶解或水解生成CuOH
C.可以用乙醇洗涤使产品快速干燥
D.洗涤时在漏斗中充分搅拌,使杂质尽可能地溶解达到除去的目的
E.如果采用减压过滤,在洗涤时应该先打开阀门与空气相通,再关闭抽气泵,然后再向漏斗中加入洗涤液
(4)第三次过滤的滤液主要成分是
(5)对污泥进行酸浸时的化学反应方程式为
(6)检验氧化亚铜晶体洗涤干净的操作是
(7)以粗铜为电极电解一定浓度的氯化钠溶液,控制一定的电压和电流,也可以制得氯化亚铜,写出电解时的阳极反应式:
您最近一年使用:0次



