已知水在25℃和95℃时,其电离平衡曲线如图所示:
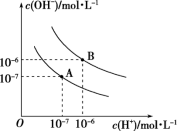
(1)则25℃时水的电离平衡曲线应为_______ (填“A”或“B”),请说明理由:_______ 。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为_______ 。
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_______ 。
(4)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
假设溶液混合前后的体积不变,则a=_______ ,实验②所得溶液中由水电离产生的c(OH-)=_______ mol·L-1。
(5)95℃时,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
①按丁方式混合后,所得溶液显_______ (填“酸”“碱”或“中”)性。
②写出按乙方式混合后,反应的化学方程式:_______ ,所得溶液显_______ (填“酸”“碱”或“中”)性。
③按甲方式混合,所得溶液的pH为_______ (混合时,忽略溶液体积的变化)。
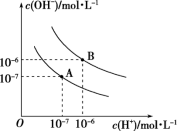
(1)则25℃时水的电离平衡曲线应为
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是
(4)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
| 实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积不变,则a=
(5)95℃时,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 | 乙 | 丙 | 丁 | |
| 0.1mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
| 0.1mol·L-1NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显
②写出按乙方式混合后,反应的化学方程式:
③按甲方式混合,所得溶液的pH为
更新时间:2022-09-30 18:38:06
|
相似题推荐
解答题-原理综合题
|
困难
(0.15)
【推荐1】水是最常用的溶剂。水分子间形成很强的氢键,与一般液体物质相比,常态水具有较大的密度、比热、蒸发热、表面张力和介电常数。水的三相点温度0.01℃、压强610Pa;临界温度374.2℃、临界压强22.1MPa。近年发现,近(超)临界水具备许多特有性质,以其为介质,可以有效实现许多重要的化学反应,应用前景广阔。
(1)画出水的压强-温度(p-T)相图(示意图),标注气相、液相、固相和超临界水所在的区域_______ 。
(2)计算液态水在90°C和0.1MPa时的pKw_______ ( 和
和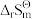 可视为常数,相关数据见表1)。
可视为常数,相关数据见表1)。
(3)有人研究了乙酸乙酯在23-30MPa、250-400℃和没有任何其他外加物的条件下的水解动力学,并提出两种可能的机理。
机理1:
CH3COOH CH3COO-+H+Ka
CH3COO-+H+Ka
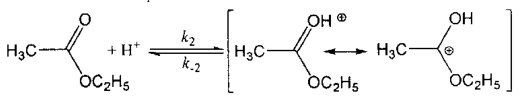 K2
K2
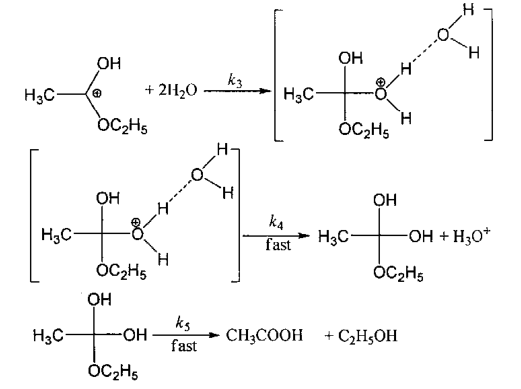
机理2:
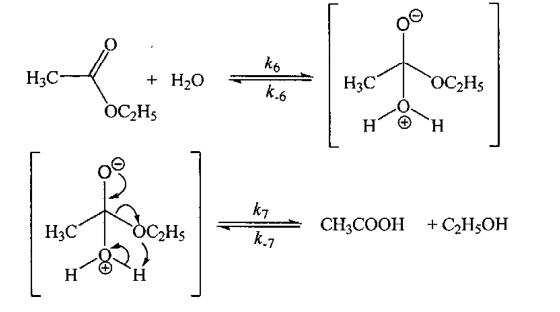
请推测乙酸乙酯在超临界温度时的水解反应按上述哪种机理进行。为什么_______ ?
相关热力学数据如下:
表1有关物质的标准热力学数据(25°C)
表2水和乙酸在25MPa及不同温度下的解离常数Kw和Ka
(4)乙酸乙酯水解反应速率可表示为:r=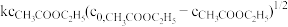 。其中k为速率常数,
。其中k为速率常数, 为乙酸乙酯的初始浓度。请通过推导说明水解反应按哪种机理进行
为乙酸乙酯的初始浓度。请通过推导说明水解反应按哪种机理进行_______ 。
(5)实验表明:近(超)临界水中酯类水解反应的表观活化能可降到常规条件下的1/2,水解反应速率大幅度提高。请通过机理1分析原因_______ 。
(1)画出水的压强-温度(p-T)相图(示意图),标注气相、液相、固相和超临界水所在的区域
(2)计算液态水在90°C和0.1MPa时的pKw
 和
和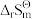 可视为常数,相关数据见表1)。
可视为常数,相关数据见表1)。(3)有人研究了乙酸乙酯在23-30MPa、250-400℃和没有任何其他外加物的条件下的水解动力学,并提出两种可能的机理。
机理1:
CH3COOH
 CH3COO-+H+Ka
CH3COO-+H+Ka K2
K2
机理2:

请推测乙酸乙酯在超临界温度时的水解反应按上述哪种机理进行。为什么
相关热力学数据如下:
表1有关物质的标准热力学数据(25°C)
 /kJ·mol-1 /kJ·mol-1 |  /J·mol-1·K-1 /J·mol-1·K-1 | |
| H2O | -285.830 | 69.91 |
| H+ | 0 | 0 |
| OH- | -229.994 | -10.75 |
表2水和乙酸在25MPa及不同温度下的解离常数Kw和Ka
| 温度/°C | pKw | pKa |
| 250 | 11.05 | 5.95 |
| 300 | 11.12 | 6.65 |
| 350 | 11.55 | 7.90 |
| 400 | 16.57 | 11.41 |
| 450 | 18.13 | 15.48 |
(4)乙酸乙酯水解反应速率可表示为:r=
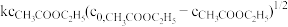 。其中k为速率常数,
。其中k为速率常数, 为乙酸乙酯的初始浓度。请通过推导说明水解反应按哪种机理进行
为乙酸乙酯的初始浓度。请通过推导说明水解反应按哪种机理进行(5)实验表明:近(超)临界水中酯类水解反应的表观活化能可降到常规条件下的1/2,水解反应速率大幅度提高。请通过机理1分析原因
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
解题方法
【推荐1】实验室中,用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高纯氧化铁( —
—
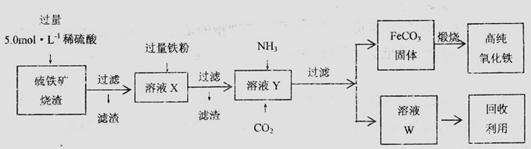
Fe2O3)的步骤如下:
回答下列问题:
(1)上述实验中,加入铁粉的作用是____________ 。(用离子方程式表示)实验中检验溶液x中的离子是否与铁粉完全反应的试剂是____________ 溶液
(2)实验室欲用18.4 mol·L-1。的浓硫酸配制100 mL5.0mol·L-1的硫酸溶液,所用仪器除胶头滴管、量筒、烧杯、玻璃棒外,还有_________ (填写仪器名称);
(3)某同学用下图所示装置实现向溶液Y中通入NH3和CO2
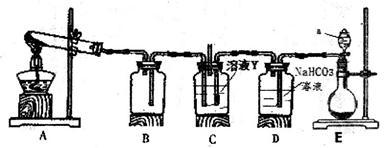
①上述装置的中,仪器a的名称是_______ ;装置B的作用是____________________ 。
②圆底烧瓶内放置的固体药品为________ (填化学式);试管内发生反应的化学方程式为_________________ 。
③甲、乙、丙三位同学分别用上述装置进行实验,装置C的试剂瓶内溶液体积相等。
若甲、乙两同学实验中,通入的NH3和CO2的物质的量之比分别为2:l和l:l,恰好完全反应后,溶液中水的电离程度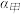
________ (填“>”“=”或“<”)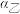 。
。
若丙同学未用装置D,则反应后溶液中离子浓度间的关系为[H+]+[NH4+]=_______ 。
 —
—
Fe2O3)的步骤如下:
回答下列问题:
(1)上述实验中,加入铁粉的作用是
(2)实验室欲用18.4 mol·L-1。的浓硫酸配制100 mL5.0mol·L-1的硫酸溶液,所用仪器除胶头滴管、量筒、烧杯、玻璃棒外,还有
(3)某同学用下图所示装置实现向溶液Y中通入NH3和CO2

①上述装置的中,仪器a的名称是
②圆底烧瓶内放置的固体药品为
③甲、乙、丙三位同学分别用上述装置进行实验,装置C的试剂瓶内溶液体积相等。
若甲、乙两同学实验中,通入的NH3和CO2的物质的量之比分别为2:l和l:l,恰好完全反应后,溶液中水的电离程度
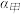
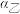 。
。若丙同学未用装置D,则反应后溶液中离子浓度间的关系为[H+]+[NH4+]=
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
【推荐1】通过电化学、热化学等方法,将 转化为
转化为 等化学品,是实现“双碳”目标的途径之一。请回答:
等化学品,是实现“双碳”目标的途径之一。请回答:
(1)某研究小组采用电化学方法将 转化为
转化为 ,装置如图。电极B上的电极反应式是
,装置如图。电极B上的电极反应式是_______ 。
 :
: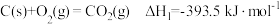
Ⅱ:
Ⅲ: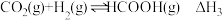
①
_______  。
。
②反应Ⅲ在恒温、恒容的密闭容器中进行, 和
和 的投料浓度均为
的投料浓度均为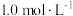 ,平衡常数
,平衡常数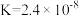 ,则
,则 的平衡转化率为
的平衡转化率为_______ 。
③用氨水吸收 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
_______ 。[已知: 时,电离常数
时,电离常数 、
、 ]
]
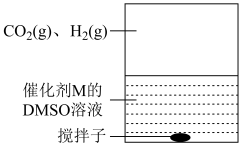
(3)为提高效率,该研究小组参考文献优化热化学方法,在如图密闭装置中充分搅拌催化剂M的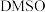 (有机溶剂)溶液,
(有机溶剂)溶液, 和
和 在溶液中反应制备
在溶液中反应制备 ,反应过程中保持
,反应过程中保持 和
和 的压强不变,总反应
的压强不变,总反应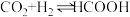 的反应速率为v,反应机理如下列三个基元反应,各反应的活化能
的反应速率为v,反应机理如下列三个基元反应,各反应的活化能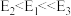 (不考虑催化剂活性降低或丧失)。
(不考虑催化剂活性降低或丧失)。
Ⅳ:

V: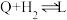

VI: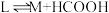

_______ 。
A.v与 的压强无关 B.v与溶液中溶解
的压强无关 B.v与溶液中溶解 的浓度无关
的浓度无关
C.温度升高,v不一定增大 D.在溶液中加入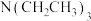 ,可提高
,可提高 转化率
转化率
②实验测得: ,
, 下,v随催化剂M浓度c变化如图。
下,v随催化剂M浓度c变化如图。 时,v随c增大而增大:
时,v随c增大而增大: 时,v不再显著增大。请解释原因
时,v不再显著增大。请解释原因_______ 。
 转化为
转化为 等化学品,是实现“双碳”目标的途径之一。请回答:
等化学品,是实现“双碳”目标的途径之一。请回答:(1)某研究小组采用电化学方法将
 转化为
转化为 ,装置如图。电极B上的电极反应式是
,装置如图。电极B上的电极反应式是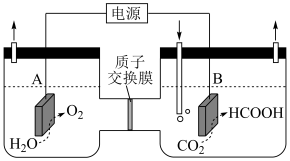
 :
: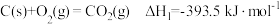
Ⅱ:

Ⅲ:
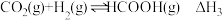
①

 。
。②反应Ⅲ在恒温、恒容的密闭容器中进行,
 和
和 的投料浓度均为
的投料浓度均为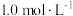 ,平衡常数
,平衡常数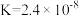 ,则
,则 的平衡转化率为
的平衡转化率为③用氨水吸收
 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
 时,电离常数
时,电离常数 、
、 ]
](3)为提高效率,该研究小组参考文献优化热化学方法,在如图密闭装置中充分搅拌催化剂M的
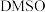 (有机溶剂)溶液,
(有机溶剂)溶液, 和
和 在溶液中反应制备
在溶液中反应制备 ,反应过程中保持
,反应过程中保持 和
和 的压强不变,总反应
的压强不变,总反应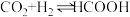 的反应速率为v,反应机理如下列三个基元反应,各反应的活化能
的反应速率为v,反应机理如下列三个基元反应,各反应的活化能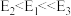 (不考虑催化剂活性降低或丧失)。
(不考虑催化剂活性降低或丧失)。Ⅳ:


V:
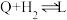

VI:
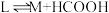

A.v与
 的压强无关 B.v与溶液中溶解
的压强无关 B.v与溶液中溶解 的浓度无关
的浓度无关C.温度升高,v不一定增大 D.在溶液中加入
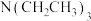 ,可提高
,可提高 转化率
转化率②实验测得:
 ,
, 下,v随催化剂M浓度c变化如图。
下,v随催化剂M浓度c变化如图。 时,v随c增大而增大:
时,v随c增大而增大: 时,v不再显著增大。请解释原因
时,v不再显著增大。请解释原因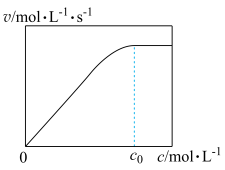
您最近一年使用:0次



