回答下列问题
(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如表:
aA(g) + bB(g) C(g)
C(g)
则:
①该可逆反应的化学方程式可表示为_______ ;
②0到2s用物质C来表示的反应速率为_______ ;
③从反应开始到2s末,B的转化率为_______ ;
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是_______ 。
A.vB(消耗)=vC(生成) B.容器内气体的总压强保持不变
C.容器内气体的密度不变 D.容器内气体A的物质的量分数保持不变
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验:
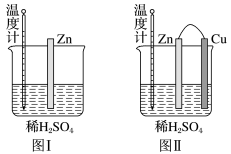
①下列说法正确的是_______ 。
A.图Ⅰ低于图Ⅱ的示数
B.图Ⅰ和图Ⅱ中的温度计示数相等,均高于室温
C.图Ⅰ和图Ⅱ的气泡均产生于锌棒表面
D.图Ⅱ中产生气体的速率比图Ⅰ快
②写出在碱性条件下,氢氧燃料电池的负极反应方程式_______ ;当外电路有2mol电子通过时,消耗在标准状况下氧气的体积为_______ L 。
③原电池中,电解质溶液的阳离子流向_______ 极(填“正”或“负”)。
(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如表:
aA(g) + bB(g)
 C(g)
C(g)| 物质 | A | B | C |
| 起始物质的量(mol) | 2 | 2 | 0 |
| 2s末物质的量(mol) | 1.4 | 0.8 | 0.6 |
则:
①该可逆反应的化学方程式可表示为
②0到2s用物质C来表示的反应速率为
③从反应开始到2s末,B的转化率为
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是
A.vB(消耗)=vC(生成) B.容器内气体的总压强保持不变
C.容器内气体的密度不变 D.容器内气体A的物质的量分数保持不变
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验:

①下列说法正确的是
A.图Ⅰ低于图Ⅱ的示数
B.图Ⅰ和图Ⅱ中的温度计示数相等,均高于室温
C.图Ⅰ和图Ⅱ的气泡均产生于锌棒表面
D.图Ⅱ中产生气体的速率比图Ⅰ快
②写出在碱性条件下,氢氧燃料电池的负极反应方程式
③原电池中,电解质溶液的阳离子流向
更新时间:2022/10/13 23:08:58
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】氮氧化物的排放会引起一些环境问题。
(1)工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) △H。在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1 L的密闭容器中,n(CH4)随反应时间的变化如图所示:
N2(g)+CO2(g)+2H2O(g) △H。在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1 L的密闭容器中,n(CH4)随反应时间的变化如图所示:

①根据图判断该反应的热效应△H_______ 0(填 “>”、“<” 或“=”) 0,理由是_______ 。
②温度为T1时,0-10 min内NO2和H2O的平均反应速率相比哪个大?_______ 。
③该反应达到平衡后,为了在提高反应速率的同时提高NO2的转化率,可采取的措施有_______ 。
A.改用高效催化剂 B.升高温度
C.缩小容器的体积 D.增加CH4的浓度
(2)为了模拟反应2NO(g)+2CO(g) N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒温恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表所示:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒温恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表所示:
①前2 s内的平均反应速率v(N2)=_______ ;此温度下,该反应的平衡常数K=_______ (填具体数值)。
②能说明上述反应达到平衡状态的是_______ 。
A.n(CO2)=2n(N2)
B.混合气体的平均相对分子质量不变
C.气体密度不变
D.容器内气体压强不变
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示,则NO的平衡转化率随温度升高而减小的原因是_______ ;图中压强p1、p2、p3的大小顺序为_______ 。

(1)工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) △H。在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1 L的密闭容器中,n(CH4)随反应时间的变化如图所示:
N2(g)+CO2(g)+2H2O(g) △H。在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1 L的密闭容器中,n(CH4)随反应时间的变化如图所示:
①根据图判断该反应的热效应△H
②温度为T1时,0-10 min内NO2和H2O的平均反应速率相比哪个大?
③该反应达到平衡后,为了在提高反应速率的同时提高NO2的转化率,可采取的措施有
A.改用高效催化剂 B.升高温度
C.缩小容器的体积 D.增加CH4的浓度
(2)为了模拟反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒温恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表所示:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒温恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表所示:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(10-4 mol·L-1 ) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)(10-3 mol·L-1 ) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2 s内的平均反应速率v(N2)=
②能说明上述反应达到平衡状态的是
A.n(CO2)=2n(N2)
B.混合气体的平均相对分子质量不变
C.气体密度不变
D.容器内气体压强不变
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示,则NO的平衡转化率随温度升高而减小的原因是

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料的过程。水煤气生产原理为:C(s)+H2O(g) CO(g)+H2(g)-131.3kJ。
CO(g)+H2(g)-131.3kJ。
(1)该反应的平衡常数K的表达式__ ;温度升高,K值__ (填“变大”、“不变”或“变小”)。
(2)一定温度下,在一个容积不变的密闭容器中进行水煤气的生产反应,下列能判断该反应达到化学平衡状态的是__ 。
A.容器内压强不变 B.容器内气体密度不变
C.v(CO)=v(H2O) D.c(CO)=c(H2)
(3)如反应的容器容积为1.0L,反应时间为5.0min,容器内气体密度增大了0.12g/L,在这段时间内CO的平均反应速率为__ 。
(4)研究表明:在使用等质量催化剂时,增大催化剂的表面积可提高化学反应速率,为了分别验证温度,催化剂的表面积对化学反应速率的影响规律,至少应该设计__ 个实验。
 CO(g)+H2(g)-131.3kJ。
CO(g)+H2(g)-131.3kJ。(1)该反应的平衡常数K的表达式
(2)一定温度下,在一个容积不变的密闭容器中进行水煤气的生产反应,下列能判断该反应达到化学平衡状态的是
A.容器内压强不变 B.容器内气体密度不变
C.v(CO)=v(H2O) D.c(CO)=c(H2)
(3)如反应的容器容积为1.0L,反应时间为5.0min,容器内气体密度增大了0.12g/L,在这段时间内CO的平均反应速率为
(4)研究表明:在使用等质量催化剂时,增大催化剂的表面积可提高化学反应速率,为了分别验证温度,催化剂的表面积对化学反应速率的影响规律,至少应该设计
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】化学反应速率和限度与生产、生活密切相关。
Ⅰ.完成下列问题
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
①哪一时间段平均反应速率最大___________ min(填0~1、1~2、2~3、3~4、4~5),从客观因素角度解释原因___________ 。
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率___________ (设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是___________(选填字母)。
Ⅱ.完成下列问题
(3)在一定温度下的恒容容器中,反应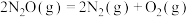 的化学反应瞬时速率方程为:
的化学反应瞬时速率方程为: 。检测实验数据如下:
。检测实验数据如下:
则n=___________ ;k=___________
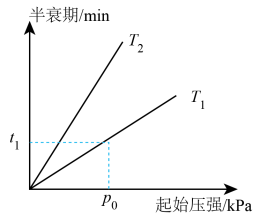
(4)不同温度(T)下, 分解的半衰期随起始压强的变化如图所示(图中半衰期指任一浓度下
分解的半衰期随起始压强的变化如图所示(图中半衰期指任一浓度下 消耗一半时所需的相应时间),则
消耗一半时所需的相应时间),则
___________ (填“>”“=”或“<”) 。
。
(5)上述反应半衰期t的计算方程为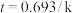 。则当
。则当 初始投入浓度
初始投入浓度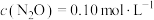 则当
则当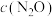 减少到0.00625
减少到0.00625 时,耗时
时,耗时___________ s。
Ⅰ.完成下列问题
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是___________(选填字母)。
| A.蒸馏水 | B.KCl溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
Ⅱ.完成下列问题
(3)在一定温度下的恒容容器中,反应
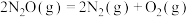 的化学反应瞬时速率方程为:
的化学反应瞬时速率方程为: 。检测实验数据如下:
。检测实验数据如下:| 序号 | 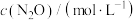 | 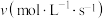 |
| ① | 0.10 | 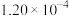 |
| ② | 0.20 | 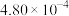 |
| ③ | 0.30 | 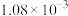 |
(4)不同温度(T)下,
 分解的半衰期随起始压强的变化如图所示(图中半衰期指任一浓度下
分解的半衰期随起始压强的变化如图所示(图中半衰期指任一浓度下 消耗一半时所需的相应时间),则
消耗一半时所需的相应时间),则
 。
。
(5)上述反应半衰期t的计算方程为
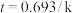 。则当
。则当 初始投入浓度
初始投入浓度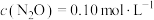 则当
则当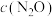 减少到0.00625
减少到0.00625 时,耗时
时,耗时
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】一定温度下,在一体积为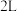 的恒容密闭容器中发生
的恒容密闭容器中发生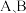 两种气体间的转化反应,
两种气体间的转化反应, 的物质的量随时间的变化情况如图所示。请回答下列问题:
的物质的量随时间的变化情况如图所示。请回答下列问题:___________ 。
(2)反应从开始至 ,用B表示的反应速率为
,用B表示的反应速率为___________ 。
(3)比较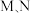 两点时该反应的正反应速率的相对大小:
两点时该反应的正反应速率的相对大小: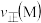
___________ (填“ ”“
”“ ”或“
”或“ ”)
”)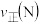 。
。
(4)若降低温度,则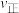
___________ (填“加快”“减慢”或“不变”,下同),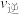
___________ 。
(5)一定条件下发生反应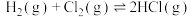 ,下列说法能表明该反应已达到平衡状态的是
,下列说法能表明该反应已达到平衡状态的是___________ (填序号)。
①生成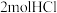 的同时消耗
的同时消耗
②生成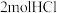 的同时生成
的同时生成
③混合气体中各物质的浓度保持不变
④混合气体中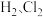 的浓度之比为
的浓度之比为
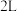 的恒容密闭容器中发生
的恒容密闭容器中发生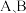 两种气体间的转化反应,
两种气体间的转化反应,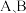 的物质的量随时间的变化情况如图所示。请回答下列问题:
的物质的量随时间的变化情况如图所示。请回答下列问题:
(2)反应从开始至
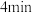 ,用B表示的反应速率为
,用B表示的反应速率为(3)比较
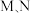 两点时该反应的正反应速率的相对大小:
两点时该反应的正反应速率的相对大小: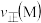
 ”“
”“ ”或“
”或“ ”)
”)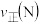 。
。(4)若降低温度,则
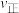
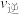
(5)一定条件下发生反应
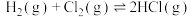 ,下列说法能表明该反应已达到平衡状态的是
,下列说法能表明该反应已达到平衡状态的是①生成
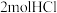 的同时消耗
的同时消耗
②生成
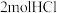 的同时生成
的同时生成
③混合气体中各物质的浓度保持不变
④混合气体中
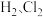 的浓度之比为
的浓度之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】亚硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为:2NO(g)+Cl2(g)⇌2ClNO(g)△H。
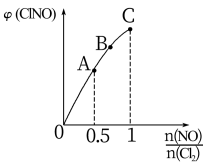
(1)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随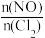 的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是
的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是___________ 点。
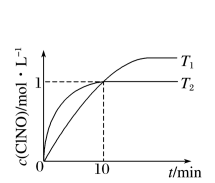
(2)在2L的恒容密闭容器中充入4mol NO(g)和2mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图。
①由图可知T1、T2温度下的反应速率v1___________ v2,△H___________ 0(填“>”、“<”或“=”)。
②反应开始到10min时,Cl2的平均反应速率v(Cl2)=___________ 。
③温度为T1时,能作为该反应达到平衡的标志的有___________ 。
a.气体体积保持不变b.容器气体质量保持不变c.气体颜色保持不变d.v(ClNO)=v(NO)
④保持温度为T2时,若将容器体积扩大到原来的两倍,再次达到平衡时,测得ClNO的浓度___________ 0.5mol/L(填“大于”、“小于”、“等于”或“无法确定”)
⑤保持温度为T2达到平衡时,此时增加4molNO(g)和2mol Cl2(g),在相同的温度下再次达到平衡,n(ClNO)___________ 4mol(填“大于”、“小于”、“等于”或“无法确定”)
(1)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随
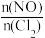 的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是
的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是
(2)在2L的恒容密闭容器中充入4mol NO(g)和2mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图。

①由图可知T1、T2温度下的反应速率v1
②反应开始到10min时,Cl2的平均反应速率v(Cl2)=
③温度为T1时,能作为该反应达到平衡的标志的有
a.气体体积保持不变b.容器气体质量保持不变c.气体颜色保持不变d.v(ClNO)=v(NO)
④保持温度为T2时,若将容器体积扩大到原来的两倍,再次达到平衡时,测得ClNO的浓度
⑤保持温度为T2达到平衡时,此时增加4molNO(g)和2mol Cl2(g),在相同的温度下再次达到平衡,n(ClNO)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】Ⅰ.二氧化碳加氢可转化为二甲醚(CH3OCH3),既可降低二氧化碳排放量,也可得到性能优良的汽车燃料。反应原理为: 。
。
(1)该反应的能量变化如图所示,该反应为___________ (填“放热”或“吸热”)反应。 ,工业上可利用此反应生产合成氨原料气
,工业上可利用此反应生产合成氨原料气 。请回答下列问题:
。请回答下列问题:
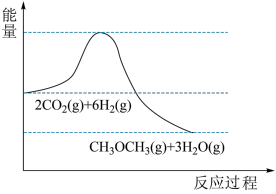
(2)一定温度下,向2L恒容密闭容器中充入
 和
和
 发生上述反应,
发生上述反应, 的物质的量随时间的变化如图所示。
的物质的量随时间的变化如图所示。___________ 。
②1min末,
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
③0~2min内的平均反应速率
___________  ,平衡时
,平衡时 的转化率为
的转化率为___________ 。[转化率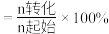 ]
]
(3)若要进一步提高该反应的化学反应速率,除了使用催化剂和升高温度外,还可以采取的措施有___________ (任写一条)。
(4)下列能说明上述反应达到平衡状态的是___________ (填代号)。
① ②恒温恒容时,容器内的总压强不随时间而变化
②恒温恒容时,容器内的总压强不随时间而变化
③恒温恒容时,容器内混合气体的密度保持不变 ④ 、
、 的浓度保持不变
的浓度保持不变
⑤ 、
、 的物质的量之比为1:3 ⑥断开
的物质的量之比为1:3 ⑥断开
 键的同时断开
键的同时断开
 键
键
 。
。(1)该反应的能量变化如图所示,该反应为
 ,工业上可利用此反应生产合成氨原料气
,工业上可利用此反应生产合成氨原料气 。请回答下列问题:
。请回答下列问题:(2)一定温度下,向2L恒容密闭容器中充入

 和
和
 发生上述反应,
发生上述反应, 的物质的量随时间的变化如图所示。
的物质的量随时间的变化如图所示。
②1min末,

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。③0~2min内的平均反应速率

 ,平衡时
,平衡时 的转化率为
的转化率为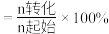 ]
](3)若要进一步提高该反应的化学反应速率,除了使用催化剂和升高温度外,还可以采取的措施有
(4)下列能说明上述反应达到平衡状态的是
①
 ②恒温恒容时,容器内的总压强不随时间而变化
②恒温恒容时,容器内的总压强不随时间而变化③恒温恒容时,容器内混合气体的密度保持不变 ④
 、
、 的浓度保持不变
的浓度保持不变⑤
 、
、 的物质的量之比为1:3 ⑥断开
的物质的量之比为1:3 ⑥断开
 键的同时断开
键的同时断开
 键
键
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】二氧化氮可由NO和 生成,已知在2 L密闭容器内,800℃时反应:
生成,已知在2 L密闭容器内,800℃时反应: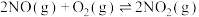
 ,
,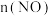 、
、 随时间的变化如表:
随时间的变化如表:
(1)已知: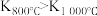 ,则该反应的
,则该反应的
_______ 0(填“大于”或“小于”),用 表示0~2 s内该反应的平均速率为
表示0~2 s内该反应的平均速率为_______ 。
(2)能说明该反应已达到平衡状态的是_______。
(3)此条件下为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动,应采取的措施有_______ 。
(4)在题述条件下,若开始通入的是0.2 mol 气体,达到化学平衡时,
气体,达到化学平衡时, 的转化率为
的转化率为_______ 。
(5)煤燃烧产生的烟气含氮的氧化物,用 催化还原
催化还原 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。
①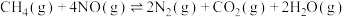

②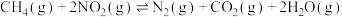

对于反应②,欲提高 的转化率,可采取的措施有_______。
的转化率,可采取的措施有_______。
 生成,已知在2 L密闭容器内,800℃时反应:
生成,已知在2 L密闭容器内,800℃时反应: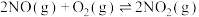
 ,
,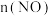 、
、 随时间的变化如表:
随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
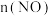 /mol /mol | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
 /mol /mol | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
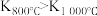 ,则该反应的
,则该反应的
 表示0~2 s内该反应的平均速率为
表示0~2 s内该反应的平均速率为(2)能说明该反应已达到平衡状态的是_______。
| A.容器内气体颜色保持不变 | B.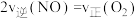 |
| C.容器内压强保持不变 | D.容器内气体密度保持不变 |
(4)在题述条件下,若开始通入的是0.2 mol
 气体,达到化学平衡时,
气体,达到化学平衡时, 的转化率为
的转化率为(5)煤燃烧产生的烟气含氮的氧化物,用
 催化还原
催化还原 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。①
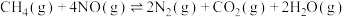

②
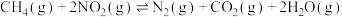

对于反应②,欲提高
 的转化率,可采取的措施有_______。
的转化率,可采取的措施有_______。| A.增加原催化剂的表面积 | B.降低温度 |
C.减小投料比 | D.增大压强 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】一定条件下,向2L恒容密闭容器中充入1mol PCl5,发生反应:PCl5(g) PCl3(g)+Cl2(g),反应过程中测定的部分数据见下表(反应过程中条件不变):
PCl3(g)+Cl2(g),反应过程中测定的部分数据见下表(反应过程中条件不变):
请回答下列问题:
(1)x的值是________ ;
(2)0-50s内,用PCl3的浓度变化表示的化学反应速率是________ ;
(3)250s以后,Cl2的物质的量不再改变的原因是_______________ ;
(4)250s时,容器中Cl2的物质的量是_____ ,PCl5的物质的量是______ ,PCl5的转化率是______ 。
 PCl3(g)+Cl2(g),反应过程中测定的部分数据见下表(反应过程中条件不变):
PCl3(g)+Cl2(g),反应过程中测定的部分数据见下表(反应过程中条件不变):t/s | 0 | 50 | 100 | 150 | 250 | 350 | 450 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 | x | |
(1)x的值是
(2)0-50s内,用PCl3的浓度变化表示的化学反应速率是
(3)250s以后,Cl2的物质的量不再改变的原因是
(4)250s时,容器中Cl2的物质的量是
您最近一年使用:0次
【推荐3】一定条件下,CO2和CO可以互相转化
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g) CO(g)+H2O(g)。
CO(g)+H2O(g)。
甲容器15min后达到平衡,此时CO2的转化率为75%,则0-15min内平均反应速率 (H2)=
(H2)=______ ,此条件下该反应的平衡常数K=______ 。欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是________________ ,且________________ (用含y的等式表示)。
(2)研究表明,温度、压强对反应C6H5CH2CH3(g)+CO2(g) C6H5CH=CH2(g)+CO(g)+H2O(g) ΔH中乙苯的平衡转化率影响如下图所示:则ΔH
C6H5CH=CH2(g)+CO(g)+H2O(g) ΔH中乙苯的平衡转化率影响如下图所示:则ΔH ______ 0(填“>”“< ” 或“=”),压强p1、p2、p3从大到小的顺序是________________ 。
(3)CO可被NO2氧化CO+NO2 CO2+NO。当温度高于225℃时,反应速率
CO2+NO。当温度高于225℃时,反应速率 正=k正·c(CO) ·c(NO2)、
正=k正·c(CO) ·c(NO2)、 逆= k逆·c(CO2) ·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为
逆= k逆·c(CO2) ·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为______ 。
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)
 CO(g)+H2O(g)。
CO(g)+H2O(g)。| 容器 | 反应物 |
| 甲 | 8molCO2(g)、16molH2(g) |
| 乙 | wmolCO2(g)、xmolH2(g)、ymolCO(g)、zmolH2O(g) |
甲容器15min后达到平衡,此时CO2的转化率为75%,则0-15min内平均反应速率
 (H2)=
(H2)=
(2)研究表明,温度、压强对反应C6H5CH2CH3(g)+CO2(g)
 C6H5CH=CH2(g)+CO(g)+H2O(g) ΔH中乙苯的平衡转化率影响如下图所示:则ΔH
C6H5CH=CH2(g)+CO(g)+H2O(g) ΔH中乙苯的平衡转化率影响如下图所示:则ΔH (3)CO可被NO2氧化CO+NO2
 CO2+NO。当温度高于225℃时,反应速率
CO2+NO。当温度高于225℃时,反应速率 正=k正·c(CO) ·c(NO2)、
正=k正·c(CO) ·c(NO2)、 逆= k逆·c(CO2) ·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为
逆= k逆·c(CO2) ·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)设计的原电池如图所示,请回答下列问题:
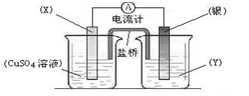
(1)电极X的材料是:________ (填化学式);电解质溶液Y是:_________ ;
(2)银电极为电池的_______ 极,发生的电极反应为:___________________ ,X电极上发生的电极反应为:_____________________________________ ;
(3)外电路中的电子是从_________ 电极流出(填“X”或“银”)。

(1)电极X的材料是:
(2)银电极为电池的
(3)外电路中的电子是从
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】I.将等质量的Cu片、Zn片放入盛有1L稀硫酸溶液的烧杯中,用导线连接形成原电池。如下图所示:
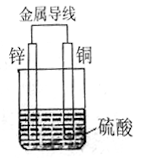
①原电池的负极材料是_____ ,(填“名称”)
铜片上发生反应的类型是_____ 反应(填“氧化”或“还原”)
②一段时间内,当电路中有2mol的电子发生转移时,理论上该装置中可收集气体___ L(标准状况)
II. 一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示
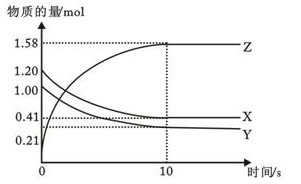
(1)反应从开始到10s时,用Y的浓度变化来表示的反应速率为__________
(2)该反应的化学方程式为:______________
(3)在恒温恒容的密闭容器中,当下列物理量不再发生变化时,一定可以作为上述反应达到平衡的标志是____________
①混合气体的压强 ②混合气体的密度 ③混合气体的总物质的量 ④相同时间内,X消耗的物质的量与Z消耗的物质的量之比为1:2 ⑤各物质表示的反应速率之比等于化学计量数之比 ⑥混合气体的平均相对分子质量

①原电池的负极材料是
铜片上发生反应的类型是
②一段时间内,当电路中有2mol的电子发生转移时,理论上该装置中可收集气体
II. 一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示

(1)反应从开始到10s时,用Y的浓度变化来表示的反应速率为
(2)该反应的化学方程式为:
(3)在恒温恒容的密闭容器中,当下列物理量不再发生变化时,一定可以作为上述反应达到平衡的标志是
①混合气体的压强 ②混合气体的密度 ③混合气体的总物质的量 ④相同时间内,X消耗的物质的量与Z消耗的物质的量之比为1:2 ⑤各物质表示的反应速率之比等于化学计量数之比 ⑥混合气体的平均相对分子质量
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】燃料电池是利用燃料与氧气反应从而将化学能转化为电能的装置。
(1)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
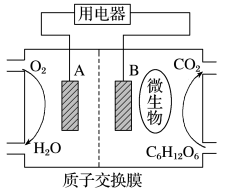
①A为生物燃料电池的_______ (填“正”或“负”)极。
②正极反应式为_______ 。
③放电过程中, 由
由_______ 极区向_______ 极区迁移(填“正”或“负”)。
④在电池反应中,每消耗 氧气,理论上生成标准状况下二氧化碳的体积是
氧气,理论上生成标准状况下二氧化碳的体积是_______ 。
(2)一氧化碳无色无味有毒,世界各国每年均有不少人因一氧化碳中毒而失去生命。一种一氧化碳分析仪的工作原理如图所示,该装置中电解质为氧化钇一氧化钠,其中 可以在固体介质
可以在固体介质 中自由移动。传感器中通过的电流越大,尾气中一氧化碳的含量越高。
中自由移动。传感器中通过的电流越大,尾气中一氧化碳的含量越高。

①工作时, 由电极
由电极_______ 向电极_______ 移动(填“a”或b”);
②电子由电极_______ 通过传感器流向电极_______ (填“a”或b”)。
(1)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。

①A为生物燃料电池的
②正极反应式为
③放电过程中,
 由
由④在电池反应中,每消耗
 氧气,理论上生成标准状况下二氧化碳的体积是
氧气,理论上生成标准状况下二氧化碳的体积是(2)一氧化碳无色无味有毒,世界各国每年均有不少人因一氧化碳中毒而失去生命。一种一氧化碳分析仪的工作原理如图所示,该装置中电解质为氧化钇一氧化钠,其中
 可以在固体介质
可以在固体介质 中自由移动。传感器中通过的电流越大,尾气中一氧化碳的含量越高。
中自由移动。传感器中通过的电流越大,尾气中一氧化碳的含量越高。
①工作时,
 由电极
由电极②电子由电极
您最近一年使用:0次



