某固态结晶水合物 X 由 5 种元素组成。某学习小组进行了如下实验:
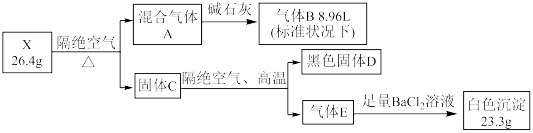
已知气体B能与 AgNO3 溶液反应, D中两种元素质量比为4:1 ,请回答:
(1)上述五种元素中,写出原子序数最大的元素在周期表中的位置___________
(2)气体 B 的实验方法是___________
(3)写出 X 在隔绝空气条件下加热,生成 A 、D 、E 的化学方程式:___________
(4)已知气体B和固体D加热时会发生反应,产物中有两种单质,当参加反应的 D 质量是1.2g时,所生成的两种单质的质量差为___________ g

已知气体B能与 AgNO3 溶液反应, D中两种元素质量比为4:1 ,请回答:
(1)上述五种元素中,写出原子序数最大的元素在周期表中的位置
(2)气体 B 的实验方法是
(3)写出 X 在隔绝空气条件下加热,生成 A 、D 、E 的化学方程式:
(4)已知气体B和固体D加热时会发生反应,产物中有两种单质,当参加反应的 D 质量是1.2g时,所生成的两种单质的质量差为
更新时间:2022-10-20 21:08:15
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】烟道气的主要成分为粉尘、空气、H2O、NOx,其中NOx是主要的大气污染物之一,为了监测某工厂烟道气中NOx含量,采集标准状况下50.00 L烟道气样经除尘、干燥后缓慢通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3−,除去多余的H2O2并加水稀释至100.00 mL。量取20.00 mL该溶液,加入30.00 mL 0.01000 mol·L−1FeSO4标准溶液(过量),充分反应后,用0.001000 mol·L−1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液10.00 mL。滴定过程中发生如下反应:
Fe2+ + NO3− + H+ — NO↑ + Fe3+ + H2O (未配平)
 + Fe2+ + H+ — Cr3+ + Fe3++ H2O (未配平)
+ Fe2+ + H+ — Cr3+ + Fe3++ H2O (未配平)
(1)NO被H2O2氧化为NO3−的离子方程式是_________ 。
(2)配制100mL 0.001000 mol·L−1 K2Cr2O7标准溶液时,除需用到烧杯、量筒、玻璃棒外,还需用到的玻璃仪器有_________ 、_________ 。
(3)若FeSO4标准溶液部分变质,会使NOx含量测定结果_________ (填“偏高” 、“偏低”或“无影响 ”)。
(4)标准状况下该工厂烟道气中NOx(折合成NO2)的含量为_________ mg·m−3(写出计算过程)。
Fe2+ + NO3− + H+ — NO↑ + Fe3+ + H2O (未配平)
 + Fe2+ + H+ — Cr3+ + Fe3++ H2O (未配平)
+ Fe2+ + H+ — Cr3+ + Fe3++ H2O (未配平)(1)NO被H2O2氧化为NO3−的离子方程式是
(2)配制100mL 0.001000 mol·L−1 K2Cr2O7标准溶液时,除需用到烧杯、量筒、玻璃棒外,还需用到的玻璃仪器有
(3)若FeSO4标准溶液部分变质,会使NOx含量测定结果
(4)标准状况下该工厂烟道气中NOx(折合成NO2)的含量为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】纳米微晶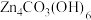 (碱式碳酸锌)属于高端精细化工产品,晶粒粒度在
(碱式碳酸锌)属于高端精细化工产品,晶粒粒度在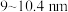 ,不溶于水和醇。某高校实验室用工业级硫酸锌(主要成分为
,不溶于水和醇。某高校实验室用工业级硫酸锌(主要成分为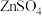 ,含少量
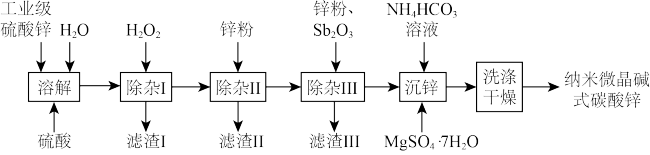
,含少量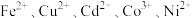 )制备纳米微晶碱式碳酸锌样品的流程如图所示:
)制备纳米微晶碱式碳酸锌样品的流程如图所示:
已知:a. 的
的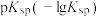 分别是37.4、15.4、16.2。
分别是37.4、15.4、16.2。
b.残留在溶液中的离子浓度小于 时可认为沉淀完全。
时可认为沉淀完全。
c.滤渣Ⅲ所含主要金属元素是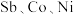 。
。
(1)“除杂Ⅰ”的目的是除去溶液中的铁元素,则 的作用是
的作用是________________ ;若溶液中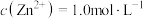 ,此过程中还应调节溶液的
,此过程中还应调节溶液的 在
在____ 范围(不考虑离子间的相互影响)。
(2)“除杂Ⅱ”与“除杂Ⅲ”均为还原除杂。
①滤渣Ⅱ的主要金属元素是_________________________
②“除杂Ⅲ”中加入的 在溶液中主要以
在溶液中主要以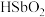 形式存在。请写出锌与
形式存在。请写出锌与 反应生成“金属间化合物”
反应生成“金属间化合物”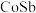 (
(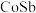 中各元素化合价视为0价)的离子方程式:
中各元素化合价视为0价)的离子方程式:___________________________
(3)“沉锌”后得到的固体先用去离子水洗涤,再用乙醇洗涤。用乙醇洗涤的目的是_______________________
(4)加入 的主要目的是降低样品晶粒粒度,但主元素
的主要目的是降低样品晶粒粒度,但主元素 的质量分数必须在56%以上。若镁、锌的质量比值过高,
的质量分数必须在56%以上。若镁、锌的质量比值过高, 还可能会生成
还可能会生成_________ (填化学式),从而对样品造成影响。
(5)样品中锌的含量可用 (可表示为
(可表示为 )滴定测定,反应的离子方程式为
)滴定测定,反应的离子方程式为 。取
。取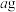 纳米微晶碱式碳酸锌样品,酸溶后得到pH为5~6的溶液,以二甲酚橙作指示剂,用
纳米微晶碱式碳酸锌样品,酸溶后得到pH为5~6的溶液,以二甲酚橙作指示剂,用 标准溶液滴定,消耗
标准溶液滴定,消耗 溶液
溶液 ,则样品中锌的质量分数是
,则样品中锌的质量分数是_______ (用代数式表示)。
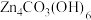 (碱式碳酸锌)属于高端精细化工产品,晶粒粒度在
(碱式碳酸锌)属于高端精细化工产品,晶粒粒度在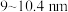 ,不溶于水和醇。某高校实验室用工业级硫酸锌(主要成分为
,不溶于水和醇。某高校实验室用工业级硫酸锌(主要成分为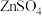 ,含少量
,含少量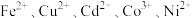 )制备纳米微晶碱式碳酸锌样品的流程如图所示:
)制备纳米微晶碱式碳酸锌样品的流程如图所示:
已知:a.
 的
的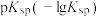 分别是37.4、15.4、16.2。
分别是37.4、15.4、16.2。b.残留在溶液中的离子浓度小于
 时可认为沉淀完全。
时可认为沉淀完全。c.滤渣Ⅲ所含主要金属元素是
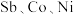 。
。(1)“除杂Ⅰ”的目的是除去溶液中的铁元素,则
 的作用是
的作用是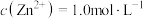 ,此过程中还应调节溶液的
,此过程中还应调节溶液的 在
在(2)“除杂Ⅱ”与“除杂Ⅲ”均为还原除杂。
①滤渣Ⅱ的主要金属元素是
②“除杂Ⅲ”中加入的
 在溶液中主要以
在溶液中主要以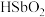 形式存在。请写出锌与
形式存在。请写出锌与 反应生成“金属间化合物”
反应生成“金属间化合物”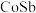 (
(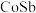 中各元素化合价视为0价)的离子方程式:
中各元素化合价视为0价)的离子方程式:(3)“沉锌”后得到的固体先用去离子水洗涤,再用乙醇洗涤。用乙醇洗涤的目的是
(4)加入
 的主要目的是降低样品晶粒粒度,但主元素
的主要目的是降低样品晶粒粒度,但主元素 的质量分数必须在56%以上。若镁、锌的质量比值过高,
的质量分数必须在56%以上。若镁、锌的质量比值过高, 还可能会生成
还可能会生成(5)样品中锌的含量可用
 (可表示为
(可表示为 )滴定测定,反应的离子方程式为
)滴定测定,反应的离子方程式为 。取
。取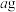 纳米微晶碱式碳酸锌样品,酸溶后得到pH为5~6的溶液,以二甲酚橙作指示剂,用
纳米微晶碱式碳酸锌样品,酸溶后得到pH为5~6的溶液,以二甲酚橙作指示剂,用 标准溶液滴定,消耗
标准溶液滴定,消耗 溶液
溶液 ,则样品中锌的质量分数是
,则样品中锌的质量分数是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程。
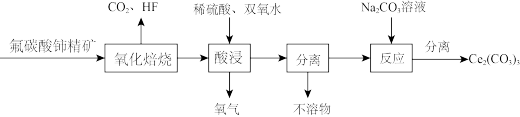
(1)氟碳酸铈的化学式为为CeFCO3,该化合物中,Ce的化合价为_____________ 。
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为___________ 。
(3)试剂X是________________ 。
(4)若试剂X改为氢氧化钠溶液,则反应生成难溶物—一氢氧化铈(Ⅲ),其暴露于空气中时变成紫色,最终变成黄色的氢氧化高铈(Ⅳ)。氢氧化铈在空气中被氧化成氢氧化高铈的化学方程式为__________________________________________________ 。
(5)取(4)中得到的Ce(OH)4产品(质量分数为97%)1. 00 g,加硫酸溶解后,用0.1000mol·L-1的FeSO4溶液滴定至终点(铈被还原成Ce3+),则需要滴加标准溶液的体积为_________ mL。

(1)氟碳酸铈的化学式为为CeFCO3,该化合物中,Ce的化合价为
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为
(3)试剂X是
(4)若试剂X改为氢氧化钠溶液,则反应生成难溶物—一氢氧化铈(Ⅲ),其暴露于空气中时变成紫色,最终变成黄色的氢氧化高铈(Ⅳ)。氢氧化铈在空气中被氧化成氢氧化高铈的化学方程式为
(5)取(4)中得到的Ce(OH)4产品(质量分数为97%)1. 00 g,加硫酸溶解后,用0.1000mol·L-1的FeSO4溶液滴定至终点(铈被还原成Ce3+),则需要滴加标准溶液的体积为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐1】现有某固体混合物,可能由Fe、MgO、 、
、 、
、 、
、 、NaCl中的若干种物质组成,设计实验方案探究该固体混合物的成分,所加试剂均过量。
、NaCl中的若干种物质组成,设计实验方案探究该固体混合物的成分,所加试剂均过量。
(1)固体A中为________ (写化学式,下同),沉淀B为________ 。
(2)该固体混合物中一定不含有________ ;可能含有________ ,若要确定是否含有该物质,还需要进行的操作是________ 。
(3)确定固体中含有 的依据是
的依据是________ 。
(4)写出气体A通入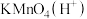 后,气体体积缩小所发生反应的离子方程式
后,气体体积缩小所发生反应的离子方程式________ 。实验室中可以选择下列部分装置证明气体A的成分,正确的仪器接口顺序为________ 。
 、
、 、
、 、
、 、NaCl中的若干种物质组成,设计实验方案探究该固体混合物的成分,所加试剂均过量。
、NaCl中的若干种物质组成,设计实验方案探究该固体混合物的成分,所加试剂均过量。
(1)固体A中为
(2)该固体混合物中一定不含有
(3)确定固体中含有
 的依据是
的依据是(4)写出气体A通入
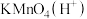 后,气体体积缩小所发生反应的离子方程式
后,气体体积缩小所发生反应的离子方程式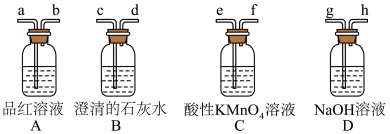
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示。
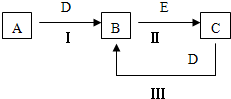
(1)若A是能使湿润的红色石蕊试纸变蓝的气体;
C、D均为空气的主要成分;E是一种有毒气体能与血红蛋白结合,反应Ⅱ在三元催化器催化作用下常用于汽车尾气的转化。
①写出反应I的化学方程式_________________________________ ;
②写出反应Ⅱ的化学方程式________________________________ 。
(2)若A是淡黄色化合物;常温下D是无色气体;C是一种常见的碱,含有的阴、阳离子均为10电子粒子。
①写出反应I的化学方程式_________________________________ ;
②写出反应 的化学方程式
的化学方程式________________________________ 。
(3)若A是酸,D是一种常见金属,E是一种常见非金属。
①写出反应Ⅱ的离子方程式________________________________ 。
②检验B中含有C的方法是:取少量溶液加入__________ (填序号)后观察现象
a.NaOH溶液 b.KSCN溶液 c.酸性KMnO4溶液 d.淀粉-KI溶液

(1)若A是能使湿润的红色石蕊试纸变蓝的气体;
C、D均为空气的主要成分;E是一种有毒气体能与血红蛋白结合,反应Ⅱ在三元催化器催化作用下常用于汽车尾气的转化。
①写出反应I的化学方程式
②写出反应Ⅱ的化学方程式
(2)若A是淡黄色化合物;常温下D是无色气体;C是一种常见的碱,含有的阴、阳离子均为10电子粒子。
①写出反应I的化学方程式
②写出反应
 的化学方程式
的化学方程式(3)若A是酸,D是一种常见金属,E是一种常见非金属。
①写出反应Ⅱ的离子方程式
②检验B中含有C的方法是:取少量溶液加入
a.NaOH溶液 b.KSCN溶液 c.酸性KMnO4溶液 d.淀粉-KI溶液
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐3】结晶水合物X由六种元素组成,某学习小组按如下流程进行实验:
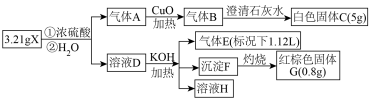
已知:
①第一步反应中元素价态没有发生变化;
②气体E能使湿润的红色石蕊试纸变蓝色;
③溶液D中含有三种正盐,其中一种即为溶液H中的唯一溶质,另一种盐M在高温灼烧时可得到相同物质的量的三种产物:红棕色G和两种组成元素相同的氧化物。
(1)X的组成中,非金属元素有___________ ,X的化学式___________ 。
(2)盐M高温分解生成三种氧化物的化学方程式___________ 。
(3)沉淀F和次氯酸钠、浓氢氧化钠反应可以制备一种能净水的钠盐,请写出该反应的离子方程式___________ 。
(4)溶液D在空气中敞口放置一段时间后,请设计实验检验溶液D中可能存在的金属阳离子:___________ 。

已知:
①第一步反应中元素价态没有发生变化;
②气体E能使湿润的红色石蕊试纸变蓝色;
③溶液D中含有三种正盐,其中一种即为溶液H中的唯一溶质,另一种盐M在高温灼烧时可得到相同物质的量的三种产物:红棕色G和两种组成元素相同的氧化物。
(1)X的组成中,非金属元素有
(2)盐M高温分解生成三种氧化物的化学方程式
(3)沉淀F和次氯酸钠、浓氢氧化钠反应可以制备一种能净水的钠盐,请写出该反应的离子方程式
(4)溶液D在空气中敞口放置一段时间后,请设计实验检验溶液D中可能存在的金属阳离子:
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
解题方法
【推荐1】R元素的单质4.5g,跟足量的硫酸反应生成R2(SO4)3,并放出5.6L的H2(标准状况下).试求:
(1)R的相对原子质量为_____
(2)若R原子中质子数比中子数少1,则R是(填元素符号)_____ ,它在元素周期表的位置为第_____ 周期第_____ 族.
(1)R的相对原子质量为
(2)若R原子中质子数比中子数少1,则R是(填元素符号)
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐2】下图是元素周期表的一部分。
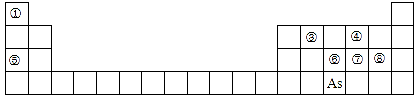
Ⅰ.(1)④、⑤、⑧的离子半径由大到小的顺序为_________ (用离子符号表示)。
(2)③、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_______ 。(用化学式表示)
(3) 由④⑤⑧三种元素组成,它的水溶液是生活中常见的消毒剂,
由④⑤⑧三种元素组成,它的水溶液是生活中常见的消毒剂, 可与
可与 的水溶液反应,产物有
的水溶液反应,产物有 的最高价含氧酸,该反应的化学方程式为
的最高价含氧酸,该反应的化学方程式为_______________ 。
Ⅱ.以下框图中的物质均为中学中常见的化合物或单质(部分产物略去),已知化合物 为由以上①④两种元素组成的人类生命活动不可缺少的常见液态物质,试回答
为由以上①④两种元素组成的人类生命活动不可缺少的常见液态物质,试回答
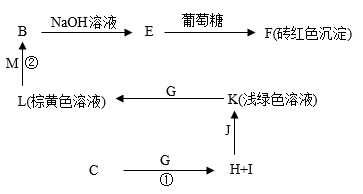
(1)化合物 的电子式为
的电子式为______________ , 的化学式为
的化学式为____________ 。
(2)写出反应①和反应②的离子方程式
①________________________________________ 。
②________________________________________ 。

Ⅰ.(1)④、⑤、⑧的离子半径由大到小的顺序为
(2)③、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
(3)
 由④⑤⑧三种元素组成,它的水溶液是生活中常见的消毒剂,
由④⑤⑧三种元素组成,它的水溶液是生活中常见的消毒剂, 可与
可与 的水溶液反应,产物有
的水溶液反应,产物有 的最高价含氧酸,该反应的化学方程式为
的最高价含氧酸,该反应的化学方程式为Ⅱ.以下框图中的物质均为中学中常见的化合物或单质(部分产物略去),已知化合物
 为由以上①④两种元素组成的人类生命活动不可缺少的常见液态物质,试回答
为由以上①④两种元素组成的人类生命活动不可缺少的常见液态物质,试回答
(1)化合物
 的电子式为
的电子式为 的化学式为
的化学式为(2)写出反应①和反应②的离子方程式
①
②
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】下表中的实线表示元素周期表的部分边界,a-j分别表示周期表中对应位置的元素。回答下列问题:
(1)请在上表中用实线补全元素周期表边界_______ 。
(2)元素b在元素周期表中的位置是_______ ;元素a与d形成的4核18电子物质的分子式_______ 。
(3)元素e、g、h的简单离子半径由小到大的顺序为______ 。(用离子符号表示)
(4)元素e的气态氢化物比元素i的气态氢化物稳定性______ 。(填“强”或“弱”)。
(5)元素d与f形成的化合物中,原子个数1:1的化合物所含化学键类型为______ 。
(6)用电子式表示元素i、j形成化合物的过程______________________ 。
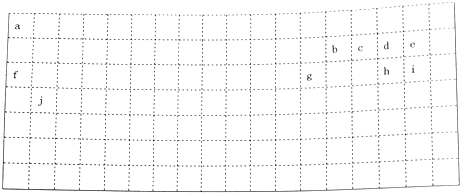
(1)请在上表中用实线补全元素周期表边界
(2)元素b在元素周期表中的位置是
(3)元素e、g、h的简单离子半径由小到大的顺序为
(4)元素e的气态氢化物比元素i的气态氢化物稳定性
(5)元素d与f形成的化合物中,原子个数1:1的化合物所含化学键类型为
(6)用电子式表示元素i、j形成化合物的过程
您最近一年使用:0次



