有四种短周期元素,它们的结构、性质等信息如表所述:
(1)基态A原子的核外电子排布式为_______
(2)A、B、C离子半径由大到小的顺序为:_______ ( 填元素符号)
(3)基态C原子的核外电子排布图是_______ ,其原子核外有_______ 个未成对电子,能量最高的电子为_______ 轨道 上的电子,其轨道呈_______ 形。
(4)D所在周期第一电离能最大的元素名为_______ ,该周期电负性最大的元素符号为_______ 。
(5)用电子式表示AD化合物的形成过程_______ 。
(6)CD3分子中含有的σ 键类型为_______ σ键。 (填s-s;s-p: p-p)
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A周同期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)基态A原子的核外电子排布式为
(2)A、B、C离子半径由大到小的顺序为:
(3)基态C原子的核外电子排布图是
(4)D所在周期第一电离能最大的元素名为
(5)用电子式表示AD化合物的形成过程
(6)CD3分子中含有的σ 键类型为
更新时间:2022/11/03 12:25:11
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】已知,短周期A、B、C、D、E、F六种主族元素,它们的原子序数依次增大,其中A的一种原子无中子,B的单质在空气中含量最高,它与A的单质在一定条件下反应生成易溶于水的化合物甲,C、E同主族,C原子的最外层电子数是其周期序数的3倍,D是短周期中原子半径最大的元素。回答下列问题:
(1)E在元素周期表中的位置____ ,元素F最高价氧化物对应水化合物的化学式为____ 。
(2)下列叙述中能够证明元素F非金属性强于元素E非金属性的事实为_______ 。
a.一定条件下E和F的单质都能与钠反应
b.F的单质能与E的氢化物反应生成E单质
c.F的氢化物比E的氢化物稳定
d.常温下E单质和F单质状态不同
(3)X可能是由B、D、E三种元素中的一种组成的单质,能经图所示的过程转化为W(其它条件略去)。
X Y
Y Z
Z W
W
①若Z是淡黄色固体物质,则该物质的电子式为_______ 。
②若Y是能使品红溶液褪色的有刺激性气味的无色气体,则W的浓溶液与铜共热的化学方程式为_______ 。
③若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂的物质的量之比为_______ ,将铜加入W的稀溶液中发生反应的离子方程式为_______ 。
(4)实验室可用图所示的装置(缺收集装置)制备并收集甲。
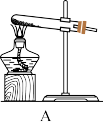
①若选用A装置制备甲,则试管中的试剂是_______ (填化学式)。
②为制取干燥的甲,可将装置A与下列装置_______ (填序号)进行连接。
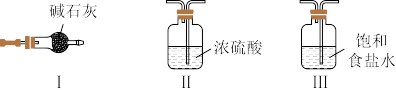
(1)E在元素周期表中的位置
(2)下列叙述中能够证明元素F非金属性强于元素E非金属性的事实为
a.一定条件下E和F的单质都能与钠反应
b.F的单质能与E的氢化物反应生成E单质
c.F的氢化物比E的氢化物稳定
d.常温下E单质和F单质状态不同
(3)X可能是由B、D、E三种元素中的一种组成的单质,能经图所示的过程转化为W(其它条件略去)。
X
 Y
Y Z
Z W
W①若Z是淡黄色固体物质,则该物质的电子式为
②若Y是能使品红溶液褪色的有刺激性气味的无色气体,则W的浓溶液与铜共热的化学方程式为
③若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂的物质的量之比为
(4)实验室可用图所示的装置(缺收集装置)制备并收集甲。

①若选用A装置制备甲,则试管中的试剂是
②为制取干燥的甲,可将装置A与下列装置

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】前四周期原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36,已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;G原子s能级与P能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
(1)Y原子核外共有______ 种不同运动状态的电子,T+离子价电子排布图为________ 。
(2)T元素在周期表的位置为__________ 。
(3)G、Q、R三种元素的氯化物的熔点如下表,G的氯化物明显高于其他两种的原因是__________ 。Q的氯化物高于R的氯化物,有同学猜想可能是因为其存在缔合分子,试写出其结构式____ 。
(4)硒(Se)与Z同一主族,Se原子比Z原子多两个电子层,则Se的原子序数为_____ ,其最高价氧化物中心原子的杂化方式为_____ 。该族2-5周期元素单质分别于H2反应生成1mol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是_____ (填字母代号)。
a.+99.7KJ/mol b.+29.7KJ/mol
c.-20.6KJ/mol d.-241.8KJ/mol
(5)金属Q属立方晶系,其晶胞边长为405pm,密度是2.70g/cm3,通过计算确定Q原子在三维空间中堆积方式________ (已知NA=6.02×1023,4053=6.64×107);晶胞中距离最近的Q原子可看作是接触的,列式计算Q的原子半径=pm______ 。(只列出计算式即可)
(1)Y原子核外共有
(2)T元素在周期表的位置为
(3)G、Q、R三种元素的氯化物的熔点如下表,G的氯化物明显高于其他两种的原因是
| 氟化物 | G的氯化物 | Q的氯化物 | R的氯化物 |
| 熔点/℃ | 714 | 190 | -70 |
a.+99.7KJ/mol b.+29.7KJ/mol
c.-20.6KJ/mol d.-241.8KJ/mol
(5)金属Q属立方晶系,其晶胞边长为405pm,密度是2.70g/cm3,通过计算确定Q原子在三维空间中堆积方式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
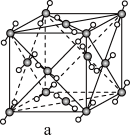
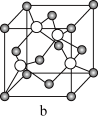
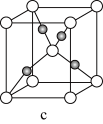
【推荐3】已知四种短周期元素的原子序数的大小顺序为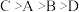 ;D和氢原子可形成4核10电子分子,该分子可使湿润的红色石器试纸变蓝:A、C同周期,B和C同主族;A与B可形成两种离子化合物
;D和氢原子可形成4核10电子分子,该分子可使湿润的红色石器试纸变蓝:A、C同周期,B和C同主族;A与B可形成两种离子化合物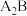 、
、 ,氢原子与B可形成两种共价化合物
,氢原子与B可形成两种共价化合物 、
、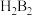 。试回答下列问题:
。试回答下列问题:
(1)C元素的元素符号为_____ ;写出A的电子排布式______ 。
(2)写出D元素形成的 分子的结构式
分子的结构式____ ,其中 键与
键与 键的数目比为
键的数目比为______ 。
(3)B、D元素的第一电离能大小关系为:B_______ D(填“<”或“>”)。
(4)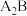 对应的水化物的碱性比
对应的水化物的碱性比
______ (填“强”或“弱”);写出 的电子式
的电子式________ 。
(5)化合物 、
、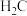 它们结构与组成相似,热稳定性更强的是
它们结构与组成相似,热稳定性更强的是__________ (填化学式), 的沸点比
的沸点比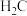 高得多的原因是
高得多的原因是_______________ 。
(6)下列选项能作为C元素和氧元素非金属性强弱比较的依据的是_________ 。
a.C的氧化物对应的水化物的酸性弱于盐酸
b.C元素的电负性小于氯的电负性
c.化学反应: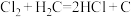
(7)B和C可以形成化合物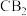 ,
,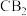 分子中空间结构为
分子中空间结构为___ (填“V型”成“直线型”)。中心原子C采用____ 杂化。
(8)元素B和铜原子形成的化合物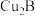 晶体结构可能是
晶体结构可能是______ (填字母)。
 ;D和氢原子可形成4核10电子分子,该分子可使湿润的红色石器试纸变蓝:A、C同周期,B和C同主族;A与B可形成两种离子化合物
;D和氢原子可形成4核10电子分子,该分子可使湿润的红色石器试纸变蓝:A、C同周期,B和C同主族;A与B可形成两种离子化合物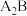 、
、 ,氢原子与B可形成两种共价化合物
,氢原子与B可形成两种共价化合物 、
、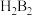 。试回答下列问题:
。试回答下列问题:(1)C元素的元素符号为
(2)写出D元素形成的
 分子的结构式
分子的结构式 键与
键与 键的数目比为
键的数目比为(3)B、D元素的第一电离能大小关系为:B
(4)
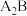 对应的水化物的碱性比
对应的水化物的碱性比
 的电子式
的电子式(5)化合物
 、
、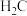 它们结构与组成相似,热稳定性更强的是
它们结构与组成相似,热稳定性更强的是 的沸点比
的沸点比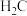 高得多的原因是
高得多的原因是(6)下列选项能作为C元素和氧元素非金属性强弱比较的依据的是
a.C的氧化物对应的水化物的酸性弱于盐酸
b.C元素的电负性小于氯的电负性
c.化学反应:
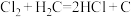
(7)B和C可以形成化合物
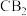 ,
,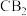 分子中空间结构为
分子中空间结构为(8)元素B和铜原子形成的化合物
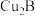 晶体结构可能是
晶体结构可能是


您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】下图是“金字塔”式元素周期表的一部分,图上标有VIA族和几种元素的位置。请用准确的化学符号和用语 回答下列问题:
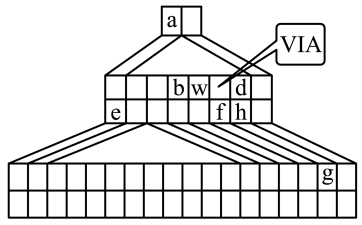
(1)g元素在周期表中的位置___________ 。用一个离子方程式表示h元素和g元素非金属性的强弱___________ 。
(2)w的最低价氢化物与最高价氧化物对应的水化物反应的化学方程式为_______ ;ba4分子的空间构型是_________ ;
(3)d、e、f的简单离子的半径由大到小是:___________ ;

(1)g元素在周期表中的位置
(2)w的最低价氢化物与最高价氧化物对应的水化物反应的化学方程式为
(3)d、e、f的简单离子的半径由大到小是:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
(1)元素X的最高价氧化物的电子式为________ ;元素Y、Z、W的原子半径由大到小顺序为________ 。
(2)单质铜和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为____________ 。
(3)元素W位于周期表的第_____ 周期第________ 族,其非金属性比R弱,用原子结构的知识解释原因:__________ 。元素W和R的气态氢化物的稳定性关系为:________ (写出化学式)。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的化学方程式:____________ 。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为____________ 。
(1)元素X的最高价氧化物的电子式为
(2)单质铜和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为
(3)元素W位于周期表的第
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的化学方程式:
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质为黄绿色有毒气体。请回答下列问题:
(1)Q的原子结构示意图是___________ 。
(2)六种元素中,原子半径最大的是___________ 。(写元素符号)
(3)Z、Q、M原子半径由大到小的顺序为(用元素符号表示)___________ 。
(4)Y和Z的气态氢化物中,热稳定性强的是___________ (用物质化学式表示)。
(5)Y的气态氢化物与X和M形成的化合物反应,产物的化学式为___________ 。
(6)X与Z可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:___________ 。
(7)单质R与水反应的离子方程式为___________ 。
(1)Q的原子结构示意图是
(2)六种元素中,原子半径最大的是
(3)Z、Q、M原子半径由大到小的顺序为(用元素符号表示)
(4)Y和Z的气态氢化物中,热稳定性强的是
(5)Y的气态氢化物与X和M形成的化合物反应,产物的化学式为
(6)X与Z可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:
(7)单质R与水反应的离子方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】氮族元素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
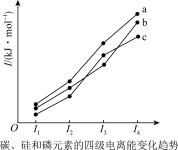
(1)As原子的价电子的轨道表示式为_______ ,同周期中与其具有相同未成对电子数的元素还有_______ 种。如图表示碳、硅和磷元素的四级电离变化趋势,其中表示碳元素的曲线是_______ (填标号)。
(2)含有氨基物质的碱性随着N原子电子云密度的增大而增强,则NH3、CH3NH2、NH2OH的碱性由强到弱的顺序为_______ 。
(3)配合物甘氨酸亚铁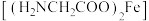 的主要生理功能是预防和改善缺铁性贫血,中心离子的配位数是4,则配位原子为
的主要生理功能是预防和改善缺铁性贫血,中心离子的配位数是4,则配位原子为_______ ,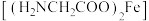 中σ键与π键的个数比为
中σ键与π键的个数比为_______ 。
(4)气态 PCl5空间构型为三角双锥,结构如图1,其中心原子的杂化类型为_______ (填符号),
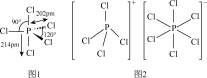
a. b.
b. c.
c.
PCl5的二溴代物PCl3Br2的结构有_______ 种;固态PCl5中含有正四面体形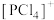 和正八面体形的
和正八面体形的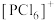 如图2,而固态PBr5却含有
如图2,而固态PBr5却含有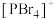 和Br-,不能形成
和Br-,不能形成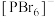 的原因是
的原因是_______ 。
(1)As原子的价电子的轨道表示式为

(2)含有氨基物质的碱性随着N原子电子云密度的增大而增强,则NH3、CH3NH2、NH2OH的碱性由强到弱的顺序为
(3)配合物甘氨酸亚铁
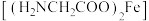 的主要生理功能是预防和改善缺铁性贫血,中心离子的配位数是4,则配位原子为
的主要生理功能是预防和改善缺铁性贫血,中心离子的配位数是4,则配位原子为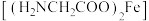 中σ键与π键的个数比为
中σ键与π键的个数比为(4)气态 PCl5空间构型为三角双锥,结构如图1,其中心原子的杂化类型为

a.
 b.
b. c.
c.
PCl5的二溴代物PCl3Br2的结构有
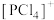 和正八面体形的
和正八面体形的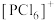 如图2,而固态PBr5却含有
如图2,而固态PBr5却含有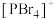 和Br-,不能形成
和Br-,不能形成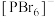 的原因是
的原因是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】A、B、D、E、G、M ,六种元素位于元素周期表前四周期,原子序数依次增大。其中元素A是宇宙中含量最多的元素,其一种核素原子核内无中子,B的单质既可以由分子组成也可以形成空间网状结构,化合物DE2为通常条件下为红棕色气体, G是前四周期中电负性最小的元素,M的原子最外层只有一个电子,其次外层内的所有轨道的电子均成对。请回答下列问题:
(1)基态G原子的简化电子排布式是_______ ,M在元素周期表中的位置是_______ 。
(2)元素B、D、E的第一电离能由大到小的顺序为_______ (用元素符号表示,下同),电负性由大到小的顺序为_______ 。
(3)M的同周期元素中,核外未成对电子数最多的元素的价层电子轨道表示式_______ 。
(4)写出由A、B、D、E四种元素组成的,最简单的、具有两性的共价化合物的结构简式_______ 。
(1)基态G原子的简化电子排布式是
(2)元素B、D、E的第一电离能由大到小的顺序为
(3)M的同周期元素中,核外未成对电子数最多的元素的价层电子轨道表示式
(4)写出由A、B、D、E四种元素组成的,最简单的、具有两性的共价化合物的结构简式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】目前新能源汽车电池主要是磷酸铁锂(LiFePO4)和三元锂电池(正极含有Ni、Co、Mn三种元素)。回答下列问题:
(1)基态Co原子的价电子排布式为____ ,能量最高的能级有___ 个空间运动状态。
(2)LiFePO4中四种元素的第一电离能由大到小的顺序是___ (填元素符号),其阴离子的立体构型名称是____ 。
(3)检验Ni2+的方法:加入丁二酮肟试剂立即生成鲜红色的二丁二酮肟合镍(II)螯合物。反应方程式如下: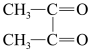 )高很多的原因是
)高很多的原因是____ 。
②二丁二酮肟合镍(II)螯合物中N原子的杂化类型是____ ,该物质中存在的作用力有____ (填正确答案标号)。
A.离子键 B.配位键 C.极性共价键 D.非极性共价键 E.氢键
(4)三元锂电池的负极材料是石墨。石墨晶体的二维平面结构如图1所示,晶胞结构如图2所示。试回答:____ 。
②根据图2计算石墨晶体的密度是____ g/cm3(写出表达式即可)。
(1)基态Co原子的价电子排布式为
(2)LiFePO4中四种元素的第一电离能由大到小的顺序是
(3)检验Ni2+的方法:加入丁二酮肟试剂立即生成鲜红色的二丁二酮肟合镍(II)螯合物。反应方程式如下:
2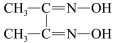 (丁二酮肟)+Ni2+
(丁二酮肟)+Ni2+
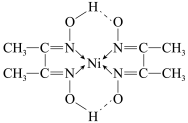 (二丁二酮肟合镍(II))+2H+
(二丁二酮肟合镍(II))+2H+
 )高很多的原因是
)高很多的原因是②二丁二酮肟合镍(II)螯合物中N原子的杂化类型是
A.离子键 B.配位键 C.极性共价键 D.非极性共价键 E.氢键
(4)三元锂电池的负极材料是石墨。石墨晶体的二维平面结构如图1所示,晶胞结构如图2所示。试回答:
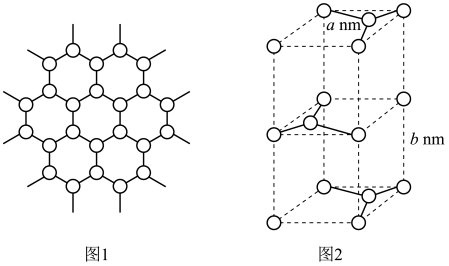
②根据图2计算石墨晶体的密度是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】(1)C、N、O三种元素电负性从大到小的顺序是___________。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.NH3分子的空间构型是___________;与N2H4分子属于等电子体的是___________(写出一种即可)。
(3)金属镍及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题:
①Ni原子的核外电子排布式为___________;
②NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO___________FeO(填“<”或“>”);
③NiO晶胞中Ni和O的配位数分别为___________、___________。
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,其价电子排布与Cu相似,Au原子的价电子排布式为___________;一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为___________;该晶体中,原子之间的强相互作用是___________;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图)的结构相似,该晶体储氢后的化学式应为___________。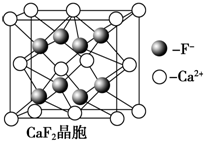
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.NH3分子的空间构型是___________;与N2H4分子属于等电子体的是___________(写出一种即可)。
(3)金属镍及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题:
①Ni原子的核外电子排布式为___________;
②NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO___________FeO(填“<”或“>”);
③NiO晶胞中Ni和O的配位数分别为___________、___________。
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,其价电子排布与Cu相似,Au原子的价电子排布式为___________;一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为___________;该晶体中,原子之间的强相互作用是___________;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图)的结构相似,该晶体储氢后的化学式应为___________。

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】(1) Cu基态原子价电子排布式为___________ ,在第二周期中,第一电离能比N高的元素有___________ ;基态Zn原子核外占据最高能层电子的电子云轮廓图形状为___________ ;基态F原子的价电子轨道表达式为___________ 。
(2)硝酸锰是工业制备中常用的催化剂,Mn(NO3)2的NO 空间构型为
空间构型为___________ ;写出一种与NO 互为等电子体的微粒的化学式:
互为等电子体的微粒的化学式:___________ ;
(3)O的第一电离能___________ (填"大于"或"小于")N的第一电离能,原因为___________ 。
(4)NH4HF2的组成元素的电负性由大到小的顺序为___________ 。(用元素符号表示);其中N原子的杂化方式为___________ ;HF能形成分子缔合体(HF)n的原因为___________ 。
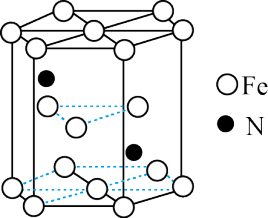
(5)某种磁性氮化铁的晶胞结构如图所示,晶胞底边长为anm,高为cnm,则这种磁性氮化铁的晶体密度为___________ g/cm3(用含a、c和NA的式子表示)。
(2)硝酸锰是工业制备中常用的催化剂,Mn(NO3)2的NO
 空间构型为
空间构型为 互为等电子体的微粒的化学式:
互为等电子体的微粒的化学式:(3)O的第一电离能
(4)NH4HF2的组成元素的电负性由大到小的顺序为
(5)某种磁性氮化铁的晶胞结构如图所示,晶胞底边长为anm,高为cnm,则这种磁性氮化铁的晶体密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】亚微米级Cu0/Fe3O4复合物多相催化过一硫酸盐降解有机污染物的过程如图所示:
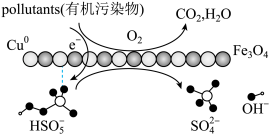
回答下列问题:
(1)基态铜原子的价层电子排布式为_____________ ,其位于元素周期表的___ 区。
(2)O、S、H 的电负性由大到小的顺序为____________ 。
(3) 的中心原子的价层电子对数为
的中心原子的价层电子对数为__________ ,其空间构型为_____________ 。
(4)冰的晶体结构如图所示,则1mol冰中含有_________ mol氢键。
(5) Cu0/Fe3O4复合物也是有机反应中的催化剂,如: +NH3+H2O2
+NH3+H2O2 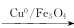
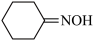 +2H2O
+2H2O
① 1mol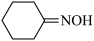 中含有σ键的数目为
中含有σ键的数目为________ NA(NA为阿伏加 德罗常数的值)。
②NH3的键角__________________ (填“大于”“小于”或“等于”) NF3的键角;理由是 _______________________________________________________ 。
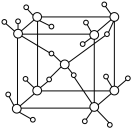
(6)铜的晶胞结构如图,则铜的配位数为_________ ,若铜原子的半径为a pm,则铜晶胞的密度为___________ g•cm‑3(列出计算式)。


回答下列问题:
(1)基态铜原子的价层电子排布式为
(2)O、S、H 的电负性由大到小的顺序为
(3)
 的中心原子的价层电子对数为
的中心原子的价层电子对数为(4)冰的晶体结构如图所示,则1mol冰中含有

(5) Cu0/Fe3O4复合物也是有机反应中的催化剂,如:
 +NH3+H2O2
+NH3+H2O2 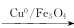
 +2H2O
+2H2O① 1mol
 中含有σ键的数目为
中含有σ键的数目为②NH3的键角
(6)铜的晶胞结构如图,则铜的配位数为

您最近一年使用:0次



