下列说法错误的是
A.除去 溶液中少量的 溶液中少量的 ,可选用CuO固体 ,可选用CuO固体 |
B.配制一定浓度的 溶液时,将 溶液时,将 固体溶于稀硫酸中,然后稀释至所需浓度 固体溶于稀硫酸中,然后稀释至所需浓度 |
C.在NaHS溶液中,滴入少量 溶液,产生黑色沉淀, 溶液,产生黑色沉淀, 的水解程度增大,pH增大 的水解程度增大,pH增大 |
| D.用饱和氯化铵溶液可以清洗钢铁表面的锈迹 |
更新时间:2022-12-04 19:29:15
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】设NA为阿伏加 德罗常数的值。关于常温下pH=2的H3PO4溶液,下列说法不正确的是
| A.加入NaH2PO4固体,溶液酸性增强 |
| B.每升溶液中的H+数目为0.01NA |
| C.加水稀释使H3PO4电离程度增大,溶液pH增大 |
D.c(H+)=c( )+2c( )+2c( )+3c( )+3c( )+c(OH-) )+c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列说法正确的是( )
| A.25℃时,向水中加入少量固体NaHSO4,c(H+)增大,Kw不变 |
B.向0.1mol·L-1CH3COOH溶液中加入少量的CH3COONa晶体, 减小 减小 |
| C.常温下,向BaCO3饱和溶液中加入Na2CO3固体,c(Ba2+)减小,BaCO3的Ksp减小 |
| D.一定条件下,将一定浓度的CH3COONa溶液加水稀释,溶液中所有离子的浓度都减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列说法不正确的是
A.室温下, 溶液中 溶液中 数目小于 数目小于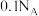 |
B.室温下, 溶液中阴离子数目小于 溶液中阴离子数目小于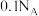 |
C.将 的各自溶液分别蒸干均得不到原溶质 的各自溶液分别蒸干均得不到原溶质 |
D.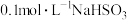 溶液中: 溶液中: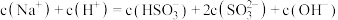 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】在25℃下,稀释 和某酸HA的溶液,溶液pH变化的曲线如图所示,其中
和某酸HA的溶液,溶液pH变化的曲线如图所示,其中 表示稀释前的体积,
表示稀释前的体积, 表示稀释后的体积,下列说法错误的是
表示稀释后的体积,下列说法错误的是
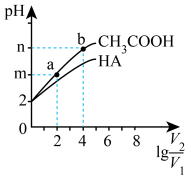
 和某酸HA的溶液,溶液pH变化的曲线如图所示,其中
和某酸HA的溶液,溶液pH变化的曲线如图所示,其中 表示稀释前的体积,
表示稀释前的体积, 表示稀释后的体积,下列说法错误的是
表示稀释后的体积,下列说法错误的是
A.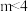 ,两种酸溶液pH相同时, ,两种酸溶液pH相同时, |
| B.a、b两点中,水的电离程度a小于b |
C.25℃时,等浓度的 与NaA溶液中, 与NaA溶液中,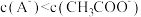 |
D.曲线上a、b两点中, 的比值一定相等 的比值一定相等 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】25 ℃时,在25 mL 0.1 mol·L-1的NaOH溶液中逐渐加入0.2 mol·L-1 CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是
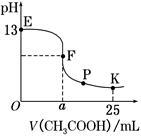

| A.a=12.5,且混合溶液pH=7 |
| B.对应曲线上E、F之间的任何一点,溶液中都有 c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C.K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| D.P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】关于化学与生活、化学与生产,下列说法正确的是
| A.NH3(g)+HCl(g)=NH4Cl(s)低温下能自发进行,说明该反应的ΔH>0 |
| B.工业上常用NH4Cl溶液除锈,利用了NH4Cl溶液水解显酸性 |
| C.工业电解精炼铜用粗铜作阳极,纯铜作阴极,CuSO4溶液作电解质溶液,相同时间段内阴极和阳极的质量变化相等 |
| D.为了延缓海水中钢闸门的腐蚀,常将钢闸门与直流电源的负极相连,该方法为牺牲阳极的阴极保护法 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列反应的离子方程式表示错误的是
A.泡沫灭火器的反应原理: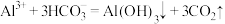 |
B.硝酸银溶液中加入足量稀氨水: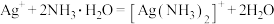 |
C.少量 通入 通入 溶液中: 溶液中: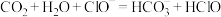 |
D.硫化氢通入 溶液中: 溶液中: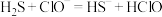 |
您最近一年使用:0次

 CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是
CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是

