已知25℃时,几种弱酸的电离平衡常数如下:
 :
: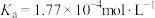 ,
,
 :
: ,
,
 :
: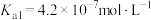 ,
,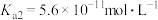 ,
,
则以下反应不能自发进行的是
 :
: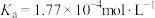 ,
, :
: ,
, :
: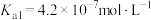 ,
,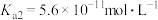 ,
,则以下反应不能自发进行的是
A. |
B.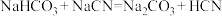 |
C.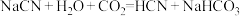 |
D.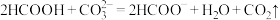 |
22-23高二上·广东广州·期中 查看更多[8]
广东省广州市第六中学2022-2023学年高二上学期期中考试化学试题山东省枣庄市第三中学2022-2023学年高二上学期12月月考化学试题湖南省雅礼中学2022-2023学年高二上学期第三次月考化学试题天津市耀华中学2022-2023学年高二上学期期末考试化学试题(已下线)高二上期末考化学191河南省开封市祥符高级中学2023-2024学年高二上学期第一次月考化学试题(已下线)寒假作业05 电离平衡及溶液的酸碱性-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)四川省广元市苍溪中学校2023-2024学年高二上学期12月月考化学试题
更新时间:2022-12-12 21:36:23
|
【知识点】 弱电解质的电离平衡常数
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】王水能溶解金,是因为与金反应生成四氯金酸(HAuCl4),25℃时,向20mL0.1mol•L-1HAuCl4溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图1所示,含Cl微粒的物质的量分数(δ)随pH的变化关系如图2所示,下列说法错误的是
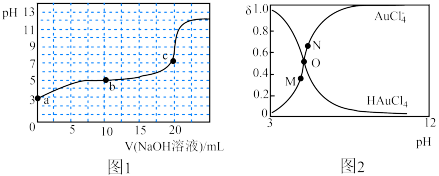

| A.Ka(HAuCl4)的数量级为10—5 |
B.c点对应溶液中:c(Na+)=c(AuCl ) ) |
| C.滴定曲线中的b点可能对应图2中N点 |
D.b点对应溶液中:c(H+)+c(HAuCl4)=c(OH—)+c(AuCl ) ) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】25℃时,往20.00mL0.1mol/LHA溶液中滴入0.1mol/LNaOH溶液,体系中-lgc(HA)、-lgc(A-)、NaOH溶液的体积与溶液pH的关系如图所示。下列说法不正确的是
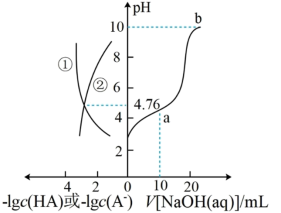

| A.曲线①表示-lgc(HA)与溶液pH的关系 |
| B.a点对应的溶液中:2c(H+)+c(HA)=2c(OH-)+c(A-) |
| C.b点对应的溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
| D.25℃时,HA的电离平衡常数的数量级为10-4 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】常温下,向20.00 mL 0.10 mol⋅L
 溶液中滴加0.10 mol⋅L
溶液中滴加0.10 mol⋅L 的NaOH溶液,溶液中的
的NaOH溶液,溶液中的 (
( )随pH的变化关系如图所示(已知
)随pH的变化关系如图所示(已知 )。下列说法错误的是
)。下列说法错误的是
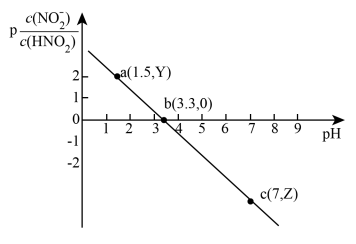

 溶液中滴加0.10 mol⋅L
溶液中滴加0.10 mol⋅L 的NaOH溶液,溶液中的
的NaOH溶液,溶液中的 (
( )随pH的变化关系如图所示(已知
)随pH的变化关系如图所示(已知 )。下列说法错误的是
)。下列说法错误的是
| A.图中a点的Y值为1.8 |
| B.溶液中水的电离程度:c>b>a |
C.常温下, 的电离常数 的电离常数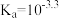 |
D.当加入10.00 mL NaOH溶液时,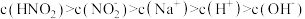 |
您最近一年使用:0次



