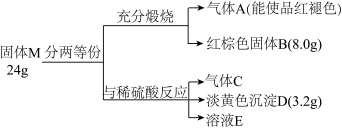
有一固体物质,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了如下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是___________ ,一定不含有的物质是___________ ,可能含有的物质是___________ (以上空格均填写化学式)。对可能含有的物质,可采用向滤液中滴加___________ 溶液的方法来检验。
(2)写出步骤②③中反应的离子方程式:
步骤②:___________ ;步骤③:___________ 。
①将固体混合物溶于水中,搅拌后得无色透明溶液;②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是
(2)写出步骤②③中反应的离子方程式:
步骤②:
更新时间:2022-12-02 20:31:40
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】现有部分短周期元素的性质或原子结构如表:
(1)元素X的一种同位元素可测定文物年代,这种同位素的符号是_______ (用元素符号表示),元素Z的离子结构示意图为_______ 。
(2)元素Y与氢元素形成一离子YH 的电子式为
的电子式为_______
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:_______ 。
(4)元素X与元素Y相比,非金属性较强的是_______ (用元素符号表示)。下列表述中能证明这一事实的是_______ 。
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物对应水化物的酸性比X的最高价氧化物对应水化物的酸性强
c.X与Y形成的化合物中X元素呈正价状态
(5)Y的最高价氧化物的水化物与气态氢化物可化合成_______ 化合物(填“共价”或“离子”)。
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
(2)元素Y与氢元素形成一离子YH
 的电子式为
的电子式为(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:
(4)元素X与元素Y相比,非金属性较强的是
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物对应水化物的酸性比X的最高价氧化物对应水化物的酸性强
c.X与Y形成的化合物中X元素呈正价状态
(5)Y的最高价氧化物的水化物与气态氢化物可化合成
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以 的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中制取高纯碳酸钴
的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中制取高纯碳酸钴 的工艺流程如图:
的工艺流程如图:

(1)写出一条加快碱溶速率的措施_______ 。
(2)过程II中加入稀 酸化后,再加入
酸化后,再加入 溶液浸出钴。则浸出钴的离子反应方程式为
溶液浸出钴。则浸出钴的离子反应方程式为_______ (产物中只有一种酸根)。该过程不能用盐酸代替硫酸进行酸化,原因是_______ 。
(3)过程III中碳酸钠溶液的作用是沉淀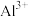 和
和 ,写出沉淀
,写出沉淀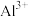 的离子方程式
的离子方程式_______ 。已知 微溶于水,过程Ⅲ控制
微溶于水,过程Ⅲ控制 不宜过低,否则会影响沉淀
不宜过低,否则会影响沉淀 ,原因是
,原因是_______ 。
(4)过程IV沉钴的离子方程式是_______ 。
(5)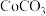 可用于制备锂离子电池的正极材料
可用于制备锂离子电池的正极材料 ,其生产工艺是将
,其生产工艺是将 的
的 和
和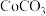 的固体混合物在空气中加热至700℃~900℃。试写出该反应的化学方程式
的固体混合物在空气中加热至700℃~900℃。试写出该反应的化学方程式____ 。
 的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中制取高纯碳酸钴
的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中制取高纯碳酸钴 的工艺流程如图:
的工艺流程如图:
(1)写出一条加快碱溶速率的措施
(2)过程II中加入稀
 酸化后,再加入
酸化后,再加入 溶液浸出钴。则浸出钴的离子反应方程式为
溶液浸出钴。则浸出钴的离子反应方程式为(3)过程III中碳酸钠溶液的作用是沉淀
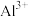 和
和 ,写出沉淀
,写出沉淀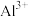 的离子方程式
的离子方程式 微溶于水,过程Ⅲ控制
微溶于水,过程Ⅲ控制 不宜过低,否则会影响沉淀
不宜过低,否则会影响沉淀 ,原因是
,原因是(4)过程IV沉钴的离子方程式是
(5)
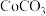 可用于制备锂离子电池的正极材料
可用于制备锂离子电池的正极材料 ,其生产工艺是将
,其生产工艺是将 的
的 和
和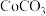 的固体混合物在空气中加热至700℃~900℃。试写出该反应的化学方程式
的固体混合物在空气中加热至700℃~900℃。试写出该反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
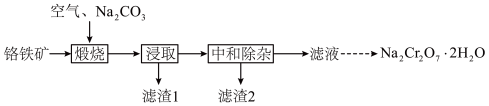
【推荐3】重铬酸钠晶体( )为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含
)为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含 ,还含少量
,还含少量 、
、 、
、 等]制备,主要工艺流程如下:
等]制备,主要工艺流程如下:
已知:① 在水溶液中常以
在水溶液中常以 、
、 、
、 、
、 等形态存在;本实验条件下,当
等形态存在;本实验条件下,当 约为3.5时
约为3.5时 转化为
转化为 。
。
②酸性条件下, 具有较强的氧化性,易被还原成
具有较强的氧化性,易被还原成 。
。
请回答下列问题:
(1)“煅烧”时, 转化为
转化为 和
和 ,写出铬铁矿发生的主要反应的化学方程式
,写出铬铁矿发生的主要反应的化学方程式_______ 。
(2)“中和除杂”时,先用水将浸取液稀释,并加热至接近沸腾,然后调节溶液 约为7。
约为7。
①加热至接近沸腾的目的为_______ 。
②若持续加热较长时间,可以通过生成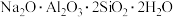 而将硅除去,写出相应的离子方程式
而将硅除去,写出相应的离子方程式_______ 。
(3)室温下,“中和除杂”后所得的滤液中存在下列平衡:



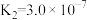
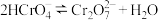
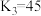
室温下,反应 的平衡常数
的平衡常数
_______ ;酸化 时,通常用硫酸而不用盐酸,原因是
时,通常用硫酸而不用盐酸,原因是_______ 。
 )为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含
)为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含 ,还含少量
,还含少量 、
、 、
、 等]制备,主要工艺流程如下:
等]制备,主要工艺流程如下:
已知:①
 在水溶液中常以
在水溶液中常以 、
、 、
、 、
、 等形态存在;本实验条件下,当
等形态存在;本实验条件下,当 约为3.5时
约为3.5时 转化为
转化为 。
。②酸性条件下,
 具有较强的氧化性,易被还原成
具有较强的氧化性,易被还原成 。
。请回答下列问题:
(1)“煅烧”时,
 转化为
转化为 和
和 ,写出铬铁矿发生的主要反应的化学方程式
,写出铬铁矿发生的主要反应的化学方程式(2)“中和除杂”时,先用水将浸取液稀释,并加热至接近沸腾,然后调节溶液
 约为7。
约为7。①加热至接近沸腾的目的为
②若持续加热较长时间,可以通过生成
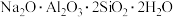 而将硅除去,写出相应的离子方程式
而将硅除去,写出相应的离子方程式(3)室温下,“中和除杂”后所得的滤液中存在下列平衡:



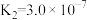
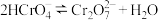
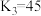
室温下,反应
 的平衡常数
的平衡常数
 时,通常用硫酸而不用盐酸,原因是
时,通常用硫酸而不用盐酸,原因是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,Y为黑色固体,常温下C为无色液体,B是一种盐,受热极易分解,在工农业生产中用途较广。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如图(其中有些反应的条件及部分生成物被略去):

请填写下列空白:
(1)原电池反应①中正极的电极反应式为________________ ;
(2)反应②的化学方程式为__________________ ;
(3)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为____________ ;
(4)“操作b”为___________________ ;
(5)反应⑤的化学方程式为_______________________ ;
(6)检验气体E的试剂及现象是___________________ ;
(7)已知E可与次氯酸钠溶液反应生成K,K和E的组成元素相同,且一分子K中有18个电子,则K中所含的化学键类型为___________ 、____________ 。

请填写下列空白:
(1)原电池反应①中正极的电极反应式为
(2)反应②的化学方程式为
(3)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
(4)“操作b”为
(5)反应⑤的化学方程式为
(6)检验气体E的试剂及现象是
(7)已知E可与次氯酸钠溶液反应生成K,K和E的组成元素相同,且一分子K中有18个电子,则K中所含的化学键类型为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】在一定条件下,可实现如图所示物质之间的变化:
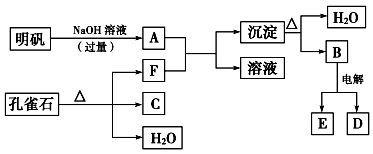
(1)已知孔雀石的主要成分是Cu2(OH)2CO3,受热易分解。则图中的F是_______ (填化学式)。
(2)写出明矾与过量NaOH溶液反应的离子方程式_______ 。A与过量F反应的离子方程式_______ 。
(3)图中所得C和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式:_______ 。
(4)每生成1mol固体D,同时生成_______ molE。

(1)已知孔雀石的主要成分是Cu2(OH)2CO3,受热易分解。则图中的F是
(2)写出明矾与过量NaOH溶液反应的离子方程式
(3)图中所得C和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式:
(4)每生成1mol固体D,同时生成
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】火柴是人们常用的生活用品,某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S等物质,设计了以下系列实验,并回答下列各题。
Ⅰ、火柴头中硫元素的实验证明

A B
⑴设计装置A中可观察到______ 的实验现象,即可证明火柴头上含有S元素。
⑵甲同学认为B装置中除了可选用稀高锰酸钾外还可选用:品红溶液、紫色石蕊溶液、滴有酚酞的NaOH溶液、溴水等,经大家分析后淘汰了紫色石蕊溶液和滴有酚酞的NaOH 溶液。你认为淘汰的原因可能是_________ 。甲同学还认为在A装置中选用浓的高锰酸钾酸性溶液更好,因为浓度越大反应速率越快,你认为对吗?______ (先判断再说明原因)。
Ⅱ、火柴头中含有Cl元素的证明,设计了以下实验流程图:

⑴为验证火柴头中含有Cl元素的实验步骤是:取滤液C……请回答后续实验步骤 是____________________________________ 。
⑵有学生提出检验火柴头上KClO3另一套实验方案:
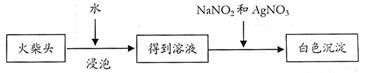
实验中发生的反应是 KClO3+ 3NaNO2+ AgNO3= AgCl↓+ 3NaNO3+ KNO3,其中NaNO2 是______________ 。剂,有人提出上述方法中出现白色沉淀并不能充分说明火柴头上 KClO3的存在,其理由是______________ 。
Ⅲ、测定火柴头中KClO3的含量,设计了以下实验流程图:

⑴步骤②的实验操作装置如下图所示,仪器a的名称为____ ,装置B的作用是____ 。
则当抽滤完毕或中途停止抽滤时,最佳的正确操作是________ 。

⑵得到的沉淀常用95%的酒精洗涤再抽滤,试问用酒精洗涤的原因___ 。(3)实验测 得火柴头中KClO3的质量分数为_________ ;未洗涤沉淀,测得KClO3的质量分数将_____________________ (填 “偏大”、“偏小”、或“无影响”,下同)。
Ⅰ、火柴头中硫元素的实验证明

A B
⑴设计装置A中可观察到
⑵甲同学认为B装置中除了可选用稀高锰酸钾外还可选用:品红溶液、紫色石蕊溶液、滴有酚酞的NaOH溶液、溴水等,经大家分析后淘汰了紫色石蕊溶液和滴有酚酞的NaOH 溶液。你认为淘汰的原因可能是
Ⅱ、火柴头中含有Cl元素的证明,设计了以下实验流程图:

⑴为验证火柴头中含有Cl元素的实验步骤是:取滤液C……请回答后续实验步骤 是
⑵有学生提出检验火柴头上KClO3另一套实验方案:

实验中发生的反应是 KClO3+ 3NaNO2+ AgNO3= AgCl↓+ 3NaNO3+ KNO3,其中NaNO2 是
Ⅲ、测定火柴头中KClO3的含量,设计了以下实验流程图:

⑴步骤②的实验操作装置如下图所示,仪器a的名称为
则当抽滤完毕或中途停止抽滤时,最佳的正确操作是

⑵得到的沉淀常用95%的酒精洗涤再抽滤,试问用酒精洗涤的原因
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】有一瓶无色透明溶液,含 、
、 、
、 、
、 、
、 、
、 、
、 中的某几种。
中的某几种。
①取少量原溶液,加入足量的 溶液产生白色沉淀;
溶液产生白色沉淀;
②取少量原溶液,加入足量的 ,溶液不产生沉淀;
,溶液不产生沉淀;
③取少量原溶液,加入足量的 溶液产生白色沉淀,再加稀硝酸,白色沉淀不溶解。
溶液产生白色沉淀,再加稀硝酸,白色沉淀不溶解。
回答下列问题:
(1)原溶液中一定含有的离子是_______ ,一定不含有的阴离子是_______ ,可能含有的离子是_______ 。
(2)写出①中反应的离子方程式_______ 。
 、
、 、
、 、
、 、
、 、
、 、
、 中的某几种。
中的某几种。①取少量原溶液,加入足量的
 溶液产生白色沉淀;
溶液产生白色沉淀;②取少量原溶液,加入足量的
 ,溶液不产生沉淀;
,溶液不产生沉淀;③取少量原溶液,加入足量的
 溶液产生白色沉淀,再加稀硝酸,白色沉淀不溶解。
溶液产生白色沉淀,再加稀硝酸,白色沉淀不溶解。回答下列问题:
(1)原溶液中一定含有的离子是
(2)写出①中反应的离子方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】某固体可能由Na2SO4、NaCl、Na2CO3、KNO3中的一种或几种组成,现进行如下实验:
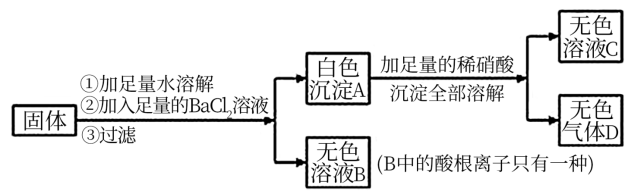
试完成下列问题:
(1)白色沉淀A的化学式为________ ,无色气体D的化学式为________ 。
(2)原固体中一定含有________ ,一定不含有________ ,可能含有________ 。
(3)为检验上述可能含有的物质是否一定存在,某同学又设计了如下实验方案:
①取少量固体溶于水,加入足量的Ba(NO3)2溶液,充分反应后,过滤;
②取滤液加入AgNO3溶液,观察有无白色沉淀生成,由此得出结论。
在上述某同学的实验方案①中,加入足量的Ba(NO3)2溶液的目的是________ 。

试完成下列问题:
(1)白色沉淀A的化学式为
(2)原固体中一定含有
(3)为检验上述可能含有的物质是否一定存在,某同学又设计了如下实验方案:
①取少量固体溶于水,加入足量的Ba(NO3)2溶液,充分反应后,过滤;
②取滤液加入AgNO3溶液,观察有无白色沉淀生成,由此得出结论。
在上述某同学的实验方案①中,加入足量的Ba(NO3)2溶液的目的是
您最近一年使用:0次