回答下列问题
(1)一定条件下,二氧化碳可合成低碳烯烃,缓解温室效应、充分利用碳资源。
已知:①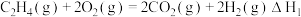
②
③
④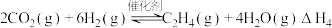
则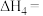
__________  用
用 、
、 、
、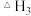 表示
表示 。
。
(2)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ ”表示。
”表示。

由图可知合成氨反应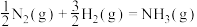 的
的
__________  。该历程中反应速率最慢的步骤的化学方程式为
。该历程中反应速率最慢的步骤的化学方程式为__________ 。
(3)用 和天然气生产
和天然气生产 的反应为
的反应为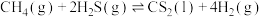 。
。
已知:I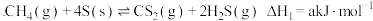
II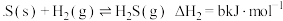
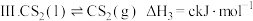
则反应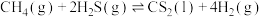 的
的
__________ 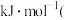 用含
用含 、
、 、
、 的代数式表示
的代数式表示 。
。
(4)已知:①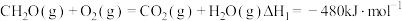 ;
;
②相关化学键的键能数据如表所示:
则
__________ 。
(1)一定条件下,二氧化碳可合成低碳烯烃,缓解温室效应、充分利用碳资源。
已知:①
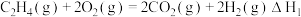
②

③

④
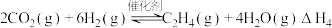
则
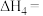
 用
用 、
、 、
、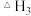 表示
表示 。
。(2)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“
 ”表示。
”表示。
由图可知合成氨反应
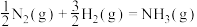 的
的
 。该历程中反应速率最慢的步骤的化学方程式为
。该历程中反应速率最慢的步骤的化学方程式为(3)用
 和天然气生产
和天然气生产 的反应为
的反应为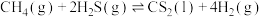 。
。已知:I
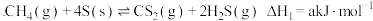
II
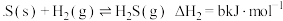
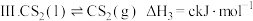
则反应
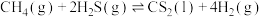 的
的
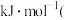 用含
用含 、
、 、
、 的代数式表示
的代数式表示 。
。(4)已知:①
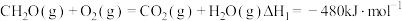 ;
;②相关化学键的键能数据如表所示:
| 化学键 | O=O | H-H | O-H |
| 键能/(kJ/mol) | 498 | 436 | 464 |

22-23高三上·陕西咸阳·阶段练习 查看更多[2]
更新时间:2022-12-12 21:35:12
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为__________ 、_______ 。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示:
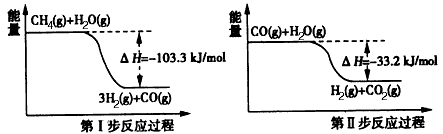
甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________ 。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5KJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5KJ/mol
③H2O(l)=H2O(g) △H=+44KJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式__________________ 。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为_________________ 。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示:

甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5KJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5KJ/mol
③H2O(l)=H2O(g) △H=+44KJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】据报道,CH4也是一种温室气体,对环境的影响是相同条件下CO2的40倍。研究CH4和CO2的转化技术对环境改善有着积极的意义。一个比较好的思路是,首先两者在一定条件下反应转化为CO和H2,然后再将CO和H2反应转化为CH3OH。
已知:①甲烷的燃烧热为890.3kJ·mol−1;
②CO(g)+ O2(g)=CO2(g) ΔH1=-283kJ·mol−1;
O2(g)=CO2(g) ΔH1=-283kJ·mol−1;
③H2(g)+ O2(g)=H2O(l) ΔH2=-285.8kJ·mol−1;
O2(g)=H2O(l) ΔH2=-285.8kJ·mol−1;
回答下列问题:
(1)写出符合甲烷燃烧热的热化学方程式:_______ 。
(2)常温下,CH4(g)+CO2(g)=2CO(g)+2H2(g),其反应热ΔH=_______ ,若在恒温恒容条件下,增大起始CO2的体积分数(增加CO2的用量),反应速率_______ (填“增大”“减小”或“不变”),CO2的转化率_______ (填“提高”“降低”或“不变”)。
(3)若已知以下两个反应的平衡常数分别为:
CO2(g)+CH4(g)⇌2H2(g)+2CO(g) K1
CO(g)+2H2(g)⇌CH3OH(g) K2
则CO2(g)+2H2(g)+CH4(g)⇌2CH3OH(g)的平衡常数为_______ (用K1、K2表示)。
(4)有人提出分开处理温室气体的思路如下:
ⅰ.将CO2转化为CO(NH2)2,其原理为:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g),若该反应在恒温恒容条件下进行,下列说法能说明该反应已达到平衡的有_______ (填标号);
A.断裂3molN—H键的同时断裂2molO—H键
B.NH3、CO2、H2O的物质的量恰好相等
C.混合气体的平均相对分子质量不再发生改变
D.体系的压强不再发生改变
ⅱ.将CH4纯化后制作成燃料电池,则在酸性条件下,该燃料电池工作时负极的电极反应式为_______ 。
(5)研究发现,CO2和H2在催化剂作用下可以按照不同的计量数之比进行反应。其原理如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1<0
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2>0
向体积恒定的容器中通入一定量的CO2和H2发生反应,温度升高,则平衡时CH3OH的平衡浓度_______ (填“逐渐增大”“逐渐减小”或“不发生改变”)。若在反应过程中,随着温度的升高,持续监测CH3OH与CO的浓度比,测得的数据先增大后减小,其先增大的原因可能是_______ 。
已知:①甲烷的燃烧热为890.3kJ·mol−1;
②CO(g)+
 O2(g)=CO2(g) ΔH1=-283kJ·mol−1;
O2(g)=CO2(g) ΔH1=-283kJ·mol−1;③H2(g)+
 O2(g)=H2O(l) ΔH2=-285.8kJ·mol−1;
O2(g)=H2O(l) ΔH2=-285.8kJ·mol−1;回答下列问题:
(1)写出符合甲烷燃烧热的热化学方程式:
(2)常温下,CH4(g)+CO2(g)=2CO(g)+2H2(g),其反应热ΔH=
(3)若已知以下两个反应的平衡常数分别为:
CO2(g)+CH4(g)⇌2H2(g)+2CO(g) K1
CO(g)+2H2(g)⇌CH3OH(g) K2
则CO2(g)+2H2(g)+CH4(g)⇌2CH3OH(g)的平衡常数为
(4)有人提出分开处理温室气体的思路如下:
ⅰ.将CO2转化为CO(NH2)2,其原理为:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g),若该反应在恒温恒容条件下进行,下列说法能说明该反应已达到平衡的有
A.断裂3molN—H键的同时断裂2molO—H键
B.NH3、CO2、H2O的物质的量恰好相等
C.混合气体的平均相对分子质量不再发生改变
D.体系的压强不再发生改变
ⅱ.将CH4纯化后制作成燃料电池,则在酸性条件下,该燃料电池工作时负极的电极反应式为
(5)研究发现,CO2和H2在催化剂作用下可以按照不同的计量数之比进行反应。其原理如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1<0
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2>0
向体积恒定的容器中通入一定量的CO2和H2发生反应,温度升高,则平衡时CH3OH的平衡浓度
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
(1)将煤转化成水煤气的反应:C(s)+H2O(g) CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中增大H2的浓度(其他条件保持不变),此反应的△H
CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中增大H2的浓度(其他条件保持不变),此反应的△H_____ (填“增大”、“减小”或“不变”)。
(2)CO2制备甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
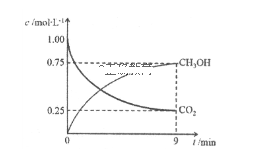
①该反应化学平衡常数K的表达式是_________ 。
②0~9 min时间内,该反应的平均反应速率v(H2)=_________ 。
③在相同条件下,密闭容器的体积缩小至0.5 L时,此反应达平衡时放出的热量(Q)可能是_________ (填字母序号)kJ。
a. 0<Q<29.5 b. 29.5<Q<36.75c. 36.75<Q<49 d. 49<Q<98
④在一定条件下,体系中CO2的平衡转化率( )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。
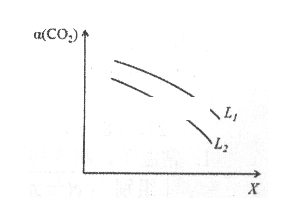
i. X表示的物理量是_________ 。
ii. 判断L1与L2的大小关系:L1________ L2(填“<”,“=”或“>”)
(1)将煤转化成水煤气的反应:C(s)+H2O(g)
 CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中增大H2的浓度(其他条件保持不变),此反应的△H
CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中增大H2的浓度(其他条件保持不变),此反应的△H(2)CO2制备甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
①该反应化学平衡常数K的表达式是
②0~9 min时间内,该反应的平均反应速率v(H2)=
③在相同条件下,密闭容器的体积缩小至0.5 L时,此反应达平衡时放出的热量(Q)可能是
a. 0<Q<29.5 b. 29.5<Q<36.75c. 36.75<Q<49 d. 49<Q<98
④在一定条件下,体系中CO2的平衡转化率(
 )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。
i. X表示的物理量是
ii. 判断L1与L2的大小关系:L1
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】(1) 液态化合物
液态化合物 与液态
与液态 恰好完全反应生成两种对环境友好的气体,此时放出
恰好完全反应生成两种对环境友好的气体,此时放出 的热量,请写出该反应的热化学方程式:
的热量,请写出该反应的热化学方程式:_______ 。
(2)已知 (视
(视 为已知数),请写出稀硫酸与稀
为已知数),请写出稀硫酸与稀 溶液反应的热化学方程式:
溶液反应的热化学方程式:______ 。
(3)已知 ,把
,把 和
和 ,充入密闭容器中充分反应,测得放出的热量始终小于
,充入密闭容器中充分反应,测得放出的热量始终小于 。请简述其原因:
。请简述其原因:______ 。
(4)请仔细看图:
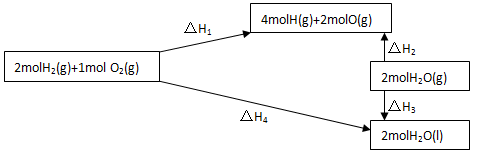
根据盖斯定律,
_______ (用 、
、 、
、 表示)。
表示)。
 液态化合物
液态化合物 与液态
与液态 恰好完全反应生成两种对环境友好的气体,此时放出
恰好完全反应生成两种对环境友好的气体,此时放出 的热量,请写出该反应的热化学方程式:
的热量,请写出该反应的热化学方程式:(2)已知
 (视
(视 为已知数),请写出稀硫酸与稀
为已知数),请写出稀硫酸与稀 溶液反应的热化学方程式:
溶液反应的热化学方程式:(3)已知
 ,把
,把 和
和 ,充入密闭容器中充分反应,测得放出的热量始终小于
,充入密闭容器中充分反应,测得放出的热量始终小于 。请简述其原因:
。请简述其原因:(4)请仔细看图:

根据盖斯定律,

 、
、 、
、 表示)。
表示)。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】请运用反应热的知识填写下列空白:
(1)已知: (s,白磷)=
(s,白磷)= (s,黑磷)
(s,黑磷) 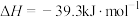 ;
;
 (s,白磷)=
(s,白磷)= (s,红磷)
(s,红磷) 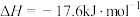 ;
;
由此推知,其中最稳定的磷单质是___________ 。
(2)①硅粉与HCl在300℃时反应生成1 mol SiHCl3气体和H2,放出225 kJ热量,该反应的热化学方程式为___________ 。
②在 25℃ 和 101kPa时,4 g硫粉在O2中完全燃烧生成SO2气体,放出37 kJ的热量,写出表示S燃烧热的热化学方程式:___________ 。
(3)已知上述反应中相关的化学键键能数据如下:
则该反应的 ΔH = ___________ 。
(4)将 氢化为
氢化为 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:
①

②

③

反应③的 ΔH3 =___________ (用ΔH1,ΔH2表示)
(5)①2Cu2O(s) + O2(g) =4CuO(s) ΔH1=-277kJ·mol-1
②8CuO(s) + CH4(g)=4Cu2O(s) + CO2(g)+2H2O(g) ΔH2=-348kJ·mol-1
反应CH4(g) +2O2(g)=CO2(g)+2H2O(g) ΔH=___________ kJ·mol-1
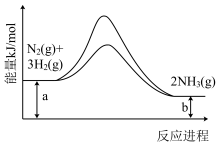
(6)合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式___________ 。
(1)已知:
 (s,白磷)=
(s,白磷)= (s,黑磷)
(s,黑磷) 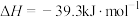 ;
; (s,白磷)=
(s,白磷)= (s,红磷)
(s,红磷) 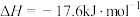 ;
;由此推知,其中最稳定的磷单质是
(2)①硅粉与HCl在300℃时反应生成1 mol SiHCl3气体和H2,放出225 kJ热量,该反应的热化学方程式为
②在 25℃ 和 101kPa时,4 g硫粉在O2中完全燃烧生成SO2气体,放出37 kJ的热量,写出表示S燃烧热的热化学方程式:
(3)已知上述反应中相关的化学键键能数据如下:
| 化学键 | C-H | C=O | H-H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
(4)将
 氢化为
氢化为 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:①


②


③


反应③的 ΔH3 =
(5)①2Cu2O(s) + O2(g) =4CuO(s) ΔH1=-277kJ·mol-1
②8CuO(s) + CH4(g)=4Cu2O(s) + CO2(g)+2H2O(g) ΔH2=-348kJ·mol-1
反应CH4(g) +2O2(g)=CO2(g)+2H2O(g) ΔH=
(6)合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】Ⅰ.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察图象,然后回答问题。
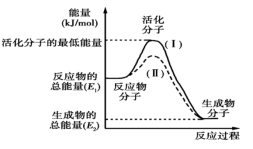
(1)图中所示反应是_______ (填“吸热”或“放热”)反应,该反应的ΔH=_______ (用含E1、E2的代数式表示)。
(2)下列4个反应中,符合示意图描述的反应的是_______ (填代号)。
a.盐酸与NaOH反应
b.Na与H2O反应生成H2
c.铝热反应
d.高温煅烧石灰石
Ⅱ.按要求完成下列问题:
(1)在1.01×105 Pa时,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则H2的燃烧热的热化学方程式为_______
(2)1.00 L 1.00 mol·L-1H2SO4溶液与2.00 L 1.00 mol·L-1NaOH溶液完全反应,放出114.6 kJ热量,该反应的中和热的热化学方程式为_______
(3)已知N2(g) + 2O2(g) = 2NO2(g);∆H=+67.7KJ/mol,
N2H4(g) + O2(g) = N2(g)+2H2O(g);∆H= -534KJ/mol,
则N2H4(g)与NO2(g)完全反应生成N2(g)和H2O(g)的热化学方程式为_______
(4)可以甲烷为原料制得:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。有关化学反应的能量变化如图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为_______
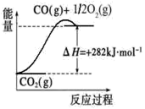
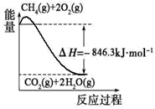
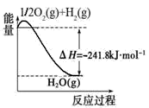

(1)图中所示反应是
(2)下列4个反应中,符合示意图描述的反应的是
a.盐酸与NaOH反应
b.Na与H2O反应生成H2
c.铝热反应
d.高温煅烧石灰石
Ⅱ.按要求完成下列问题:
(1)在1.01×105 Pa时,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则H2的燃烧热的热化学方程式为
(2)1.00 L 1.00 mol·L-1H2SO4溶液与2.00 L 1.00 mol·L-1NaOH溶液完全反应,放出114.6 kJ热量,该反应的中和热的热化学方程式为
(3)已知N2(g) + 2O2(g) = 2NO2(g);∆H=+67.7KJ/mol,
N2H4(g) + O2(g) = N2(g)+2H2O(g);∆H= -534KJ/mol,
则N2H4(g)与NO2(g)完全反应生成N2(g)和H2O(g)的热化学方程式为
(4)可以甲烷为原料制得:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。有关化学反应的能量变化如图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为



您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.已知:2H2+O2 2H2O
2H2O
该反应1g氢气完全燃烧放出热量121.6kJ,其中断裂1molH-H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH-O键放出热量_______ 。
 2H2O
2H2O该反应1g氢气完全燃烧放出热量121.6kJ,其中断裂1molH-H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH-O键放出热量
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(1)键能也可以用于估算化学反应的反应热(ΔH),下表是部分化学键的键能数据:
已知白磷的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物结构如图所示,则上表中X=___________ 。
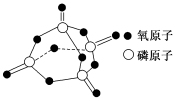
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①已知:I.C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5kJ/mol
II.2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ/mol
Ⅲ.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1) ΔH3=-2599.2kJ/mol
则由C(石墨,s)和H2(g)反应生成1molC2H2(g)的热化学方程式为___________ 。
②已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,放出xkJ热量。已知单质碳的燃烧热为ykJ/mol,则1molC与O2反应生成CO的反应热△H为___________ 。
(1)键能也可以用于估算化学反应的反应热(ΔH),下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ·mol-1) | 172 | 335 | 498 | X |

(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①已知:I.C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5kJ/mol
II.2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ/mol
Ⅲ.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1) ΔH3=-2599.2kJ/mol
则由C(石墨,s)和H2(g)反应生成1molC2H2(g)的热化学方程式为
②已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,放出xkJ热量。已知单质碳的燃烧热为ykJ/mol,则1molC与O2反应生成CO的反应热△H为
您最近一年使用:0次

 又称联氨,在航空航天方面应用广泛,可用作火箭燃料。已知
又称联氨,在航空航天方面应用广泛,可用作火箭燃料。已知 键、
键、 键键能分别为
键键能分别为 ,
,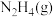 与
与 反应的能量变化如图所示:
反应的能量变化如图所示:
 键的键能为
键的键能为

