疫情期间,很多自来水厂用二氧化氯ClO2消毒,防止水体污染。二氧化氯(ClO2)黄绿色气体,易溶于水,熔点为-59.5℃,沸点为11.0℃,浓度过高时易发生分解引起爆炸。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,ClO2被还原成Cl-,写出该反应的离子方程式:___________ 。
(2)来实验小组设计了如图所示的实验装置用于制取ClO2
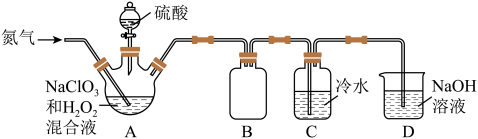
①氮气不参与反应,通入氮气的主要作用有2个,一是可以起到搅排作用,二是___________ 。
②装置A用于制备ClO2气体,同时还有生成另种一种无色无味的气体,该反应的离子方程式为___________ 。
③装置B的作用是___________ 。
(3)ClO2也可用亚氯酸钠和稀盐酸为原料制备,化学方程式为: 5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O,该反应的氧化剂与还原剂个数之比为:___________ 。
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,ClO2被还原成Cl-,写出该反应的离子方程式:
(2)来实验小组设计了如图所示的实验装置用于制取ClO2

①氮气不参与反应,通入氮气的主要作用有2个,一是可以起到搅排作用,二是
②装置A用于制备ClO2气体,同时还有生成另种一种无色无味的气体,该反应的离子方程式为
③装置B的作用是
(3)ClO2也可用亚氯酸钠和稀盐酸为原料制备,化学方程式为: 5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O,该反应的氧化剂与还原剂个数之比为:
更新时间:2022-12-26 09:14:58
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】高纯碘化钠晶体是核医学、大型安防设备、暗物质探测等领域的核心材料。某研究小组在实验室制备高纯NaI的简化流程如图:

已知:①I2(s)+I-(aq) I
I (aq)。
(aq)。
②水合肼(N2H4·H2O)具有强还原性,可将各种价态的碘还原为I-,氧化产物为N2。
③NaI易被氧化,易溶于水、酒精,在酒精中的溶解度随温度的升高增加不大。
回答下列问题:
(1)①步骤Ⅰ,I2与Na2CO3溶液同时发生两个反应,生成物除NaI外,还分别生成NaIO和NaIO3,一个反应为:I2+Na2CO3=NaI+NaIO+CO2↑,另一个反应为:___________ 。
②I2与Na2CO3溶液的反应很慢,加入NaI固体能使开始反应时的速率明显加快,原因可能是___________ 。
(2)步骤Ⅱ,水合肼与IO 反应的离子方程式为
反应的离子方程式为___________ 。
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。
上述①②③操作中,调整pH时依次加入的试剂为___________ 、___________ 、___________ 。
A.NaOH B.HI C.NH3•H2O D.高纯水
(4)步骤Ⅳ,蒸发操作为减压蒸发。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有___________ 。
A.直形冷凝管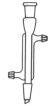 B.球形冷凝管
B.球形冷凝管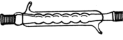
C.烧杯 D.抽气泵
D.抽气泵
②采用“减压蒸发”的优点有:减小压强,降低沸点,利于水的蒸发;___________ 。
(5)将制备的NaI•2H2O粗品以无水乙醇为溶剂进行重结晶。请选择合理的操作并排序:加热乙醇→___________ →___________ →___________ →___________ →纯品(选填序号)。
①高纯水洗涤 ②减压蒸发结晶 ③真空干燥 ④NaI•2H2O粗品溶解 ⑤趁热过滤 ⑥降温结晶

已知:①I2(s)+I-(aq)
 I
I (aq)。
(aq)。②水合肼(N2H4·H2O)具有强还原性,可将各种价态的碘还原为I-,氧化产物为N2。
③NaI易被氧化,易溶于水、酒精,在酒精中的溶解度随温度的升高增加不大。
回答下列问题:
(1)①步骤Ⅰ,I2与Na2CO3溶液同时发生两个反应,生成物除NaI外,还分别生成NaIO和NaIO3,一个反应为:I2+Na2CO3=NaI+NaIO+CO2↑,另一个反应为:
②I2与Na2CO3溶液的反应很慢,加入NaI固体能使开始反应时的速率明显加快,原因可能是
(2)步骤Ⅱ,水合肼与IO
 反应的离子方程式为
反应的离子方程式为(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。
上述①②③操作中,调整pH时依次加入的试剂为
A.NaOH B.HI C.NH3•H2O D.高纯水
(4)步骤Ⅳ,蒸发操作为减压蒸发。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有
A.直形冷凝管
 B.球形冷凝管
B.球形冷凝管
C.烧杯
 D.抽气泵
D.抽气泵
②采用“减压蒸发”的优点有:减小压强,降低沸点,利于水的蒸发;
(5)将制备的NaI•2H2O粗品以无水乙醇为溶剂进行重结晶。请选择合理的操作并排序:加热乙醇→
①高纯水洗涤 ②减压蒸发结晶 ③真空干燥 ④NaI•2H2O粗品溶解 ⑤趁热过滤 ⑥降温结晶
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】汽车尾气中的有害气体主要有NO、碳氢化合物及CO,某校同学设计实验将模拟汽车尾气转化为无害气体。回答下列问题;

(1)为了配制模拟尾气,甲组同学用上图所示装置分别制备NO、乙烯及CO三袋气体。
①用装置A制取NO,分液漏斗中盛放的是___ (填试剂名称)。
②用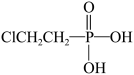 (乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为
(乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为______ (磷转化为Na3 PO4)。
③用H2 C2 O4与浓硫酸制取CO(化学方程式为H2C2O4 CO+CO2+H2O并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为
CO+CO2+H2O并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为___ →g(气流从左至右),其中装置D中盛放的药品是___
(2)乙组同学将甲组制得的气体与空气按适当比例混合形成模拟尾气(NO,CO,C2 H4及空气),按如图所示 装置进行尾气转化并检验。

①为检验催化反应后的气体中是否有CO2生成和乙烯的残留,G、H中盛放的试剂依次是_________ (填标号)。
a. NaOH溶液 b.酸性KMnO4溶液
c.澄清石灰水 d. Br2/CCl4溶液
②通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是___ ;写出其中CO与NO完全转化为无害气体的化学方程式:___

(1)为了配制模拟尾气,甲组同学用上图所示装置分别制备NO、乙烯及CO三袋气体。
①用装置A制取NO,分液漏斗中盛放的是
②用
 (乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为
(乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为③用H2 C2 O4与浓硫酸制取CO(化学方程式为H2C2O4
 CO+CO2+H2O并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为
CO+CO2+H2O并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为(2)乙组同学将甲组制得的气体与空气按适当比例混合形成模拟尾气(NO,CO,C2 H4及空气),按如图所示 装置进行尾气转化并检验。

①为检验催化反应后的气体中是否有CO2生成和乙烯的残留,G、H中盛放的试剂依次是
a. NaOH溶液 b.酸性KMnO4溶液
c.澄清石灰水 d. Br2/CCl4溶液
②通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:________________________ 。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。
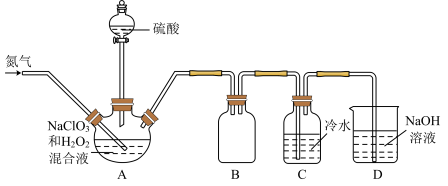
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是____________________ 。
②装置B的作用是__________________ 。
③装置A用于生成ClO2气体,该反应的化学方程式为__________________ 。
④当看到装置C中导管液面上升时应进行的操作是______________________ 。
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入_______________________ 作指示剂,用0.1000mol·L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2+2S2O32- = 2I- +S4O62-),当看到____________________________ 现象时,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为________ mol·L-1。
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。

①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是
②装置B的作用是
③装置A用于生成ClO2气体,该反应的化学方程式为
④当看到装置C中导管液面上升时应进行的操作是
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】从铝土矿(主要成分为Al2O3,还有少量杂质)中提取铝的工艺流程及步骤如下:

试回答下列问题:
(1)试剂X为__________ ;
(2)写出试剂X溶解Al2O3的化学方程式________
(3)操作Ⅰ、操作Ⅱ均为_________ (填操作名称);
(4)金属铝与氧化铁混合在高温下,会发生剧烈的反应,该反应的化学方程式为_______ ;
(5)反应Ⅱ的离子方程式为______ ;
(6)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是________ g。

试回答下列问题:
(1)试剂X为
(2)写出试剂X溶解Al2O3的化学方程式
(3)操作Ⅰ、操作Ⅱ均为
(4)金属铝与氧化铁混合在高温下,会发生剧烈的反应,该反应的化学方程式为
(5)反应Ⅱ的离子方程式为
(6)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
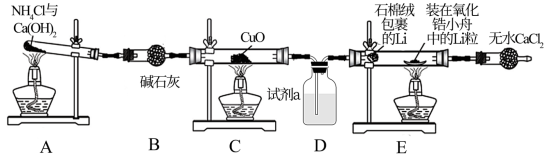
【推荐2】金属锂与干燥、纯净的N2左500℃左右反应生成氮化锂(Li3N),该物质是一种优良的贮氢材料。一种制名氮化锂的方法及装置如下(部分夹持装置略) :
查阅资料:
回答下列问题:
(1)装置A中发生反应的化学方程式为___________
(2)仪器B、F的名称为___________ ;两者所盛装的试剂___________ (填“能”或“不能”)交换。
(3) D中所装试剂a为___________ ,作用是___________ 。
(4)经分析,若将装置D更换为下图所示的装置___________ (填序号)会更合理。
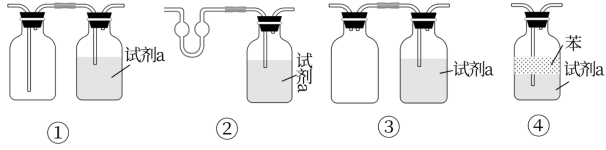
(5)装置E中石棉绒(透气且性质稳定)包裹Li的作用是吸收装置中残留的O2,装在氧化锆小舟中的Li粒不能直接放在反应管中的原因是___________ 。
(6)实验前将24.0 g金属锂置于质量为30.2 g的氧化锆小舟中,待反应一段时间后, 使产品在氮气氛围中充分冷却后再对氧化锆小舟进行称重,总质量为68.2 g,则Li3N的产率约为___________ %。

查阅资料:
| 物理性质 | 物理性质 | |
| 金属锂(Li) | 熔点180C,沸点1340C | 与氨气反应: 2Li+2NH3=2LiNH2+H2↑ |
| 氮化锂 (Li3N) | 红色晶状固体,能吸附H2 | ①易水解:Li3N+3H2O=3LiOH+NH3↑ ②高温时能腐蚀镍、铜、石英等 |
(1)装置A中发生反应的化学方程式为
(2)仪器B、F的名称为
(3) D中所装试剂a为
(4)经分析,若将装置D更换为下图所示的装置

(5)装置E中石棉绒(透气且性质稳定)包裹Li的作用是吸收装置中残留的O2,装在氧化锆小舟中的Li粒不能直接放在反应管中的原因是
(6)实验前将24.0 g金属锂置于质量为30.2 g的氧化锆小舟中,待反应一段时间后, 使产品在氮气氛围中充分冷却后再对氧化锆小舟进行称重,总质量为68.2 g,则Li3N的产率约为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
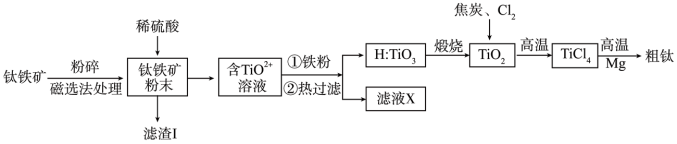
【推荐3】钛和钛的合金在航天领域有着广泛的应用,因而有“空间金属”之称;工业上用钛铁矿(主要成分为 ,含有
,含有 、
、 、
、 等杂质)为原料制备金属钛的工艺流程如下:
等杂质)为原料制备金属钛的工艺流程如下:
已知:① 易水解生成不溶于水的
易水解生成不溶于水的 ;
;
②高温下钛易与N2、H2等反应。
(1)钛铁矿酸浸前需要粉碎,其目的是_______ 。
(2)“滤渣I”的主要成分为_____ ;工业上用稀硫酸浸取时,温度不宜太高的原因是______ 。
(3)钛铁矿与硫酸发生非氧化还原反应,生成强电解质 ,试写出该反应的离子方程式
,试写出该反应的离子方程式__ 。
(4)写出高温下 转化为
转化为 的化学反应方程式
的化学反应方程式______ 。
(5)镁与 ,高温下反应制备粗钛时需加保护气,下列可作为保护气的是
,高温下反应制备粗钛时需加保护气,下列可作为保护气的是_______ (填标号)。
a.H2 b.Ar c.CO2 d.N2
(6)“粗钛”中含有Mg、 、
、 ,可采用蒸馏的方法分离得到,加热的温度范围
,可采用蒸馏的方法分离得到,加热的温度范围_______ 。
(7)利用氧化还原滴定法可测定 的含量。先取待测钛液
的含量。先取待测钛液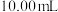 用水释至
用水释至 ,加过量铝粉。充分振荡,使
,加过量铝粉。充分振荡,使 还原为
还原为 ,过滤后,取无色滤液
,过滤后,取无色滤液 ,向其中滴加2~3滴KSCN溶液,用
,向其中滴加2~3滴KSCN溶液,用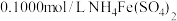 的标准液滴定。
的标准液滴定。 ,滴定终点时现象
,滴定终点时现象____ ,若用去了 溶液,待测钛液中
溶液,待测钛液中 的物质的量浓度是
的物质的量浓度是____  。
。
 ,含有
,含有 、
、 、
、 等杂质)为原料制备金属钛的工艺流程如下:
等杂质)为原料制备金属钛的工艺流程如下:
已知:①
 易水解生成不溶于水的
易水解生成不溶于水的 ;
;②高温下钛易与N2、H2等反应。
(1)钛铁矿酸浸前需要粉碎,其目的是
(2)“滤渣I”的主要成分为
(3)钛铁矿与硫酸发生非氧化还原反应,生成强电解质
 ,试写出该反应的离子方程式
,试写出该反应的离子方程式(4)写出高温下
 转化为
转化为 的化学反应方程式
的化学反应方程式(5)镁与
 ,高温下反应制备粗钛时需加保护气,下列可作为保护气的是
,高温下反应制备粗钛时需加保护气,下列可作为保护气的是a.H2 b.Ar c.CO2 d.N2
(6)“粗钛”中含有Mg、
 、
、 ,可采用蒸馏的方法分离得到,加热的温度范围
,可采用蒸馏的方法分离得到,加热的温度范围 |  |  |  | |
| 熔点/℃ |  | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
 的含量。先取待测钛液
的含量。先取待测钛液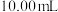 用水释至
用水释至 ,加过量铝粉。充分振荡,使
,加过量铝粉。充分振荡,使 还原为
还原为 ,过滤后,取无色滤液
,过滤后,取无色滤液 ,向其中滴加2~3滴KSCN溶液,用
,向其中滴加2~3滴KSCN溶液,用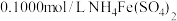 的标准液滴定。
的标准液滴定。 ,滴定终点时现象
,滴定终点时现象 溶液,待测钛液中
溶液,待测钛液中 的物质的量浓度是
的物质的量浓度是 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】回收利用废旧锂离子电池正极材料钴酸锂粗品来制备 产品,可实现资源的循环利用。其工艺流程如下。
产品,可实现资源的循环利用。其工艺流程如下。

已知:①氯化胆碱 是铵盐,熔点较低:
是铵盐,熔点较低: 熔点较高。
熔点较高。
② 在溶液中常以
在溶液中常以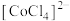 (蓝色)和
(蓝色)和 (粉红色)形式存在。
(粉红色)形式存在。
③常温下, 。
。
回答下列问题:
(1)废旧电池拆解提取正极材料前,需将其浸入NaCl溶液中,其目的是___________ 。
(2)“水浸”过程中溶液由蓝色逐渐变为粉红色,则“微波共熔”后获得的含Li、Co的化合物为___________ (填化学式)。“微波共熔”中氯化胆碱的作用是___________ 。
(3)“沉钴”过程发生反应的离子方程式为___________ 。常温下,钴离子恰好沉淀完全时溶液的
___________ [当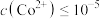 mol⋅L
mol⋅L 时可认为离子沉淀完全]。
时可认为离子沉淀完全]。
(4)“煅烧”过程生成 ,则消耗的
,则消耗的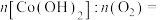
___________ 。
(5)“高温烧结”发生反应的化学方程式为___________ 。
 产品,可实现资源的循环利用。其工艺流程如下。
产品,可实现资源的循环利用。其工艺流程如下。
已知:①氯化胆碱
 是铵盐,熔点较低:
是铵盐,熔点较低: 熔点较高。
熔点较高。②
 在溶液中常以
在溶液中常以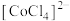 (蓝色)和
(蓝色)和 (粉红色)形式存在。
(粉红色)形式存在。③常温下,
 。
。回答下列问题:
(1)废旧电池拆解提取正极材料前,需将其浸入NaCl溶液中,其目的是
(2)“水浸”过程中溶液由蓝色逐渐变为粉红色,则“微波共熔”后获得的含Li、Co的化合物为
(3)“沉钴”过程发生反应的离子方程式为

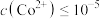 mol⋅L
mol⋅L 时可认为离子沉淀完全]。
时可认为离子沉淀完全]。(4)“煅烧”过程生成
 ,则消耗的
,则消耗的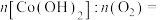
(5)“高温烧结”发生反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】Cl2O是黄棕色具有强烈刺激性气味的气体,熔点是-116℃,沸点是3.8℃;是一种强氧化剂,易溶于水且会与水反应生成次氯酸;高浓度的Cl2O易爆炸;Cl2O与有机物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2O的装置如图所示:
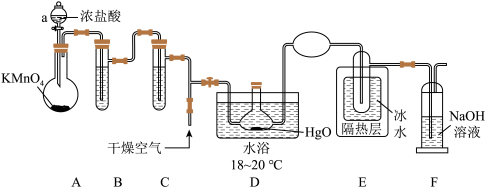
已知:①Cl2的熔点为-101℃,沸点是-34.6℃;②HgO+2Cl2=HgCl2+Cl2O
(1)仪器a的名称是___ ,装置A中制备Cl2的化学方程式为___ 。
(2)装置C的作用是___ 。
(3)通入干燥空气的目的是___ 。
(4)装置D与E之间不用橡胶管连接的原因是___ ,NaOH溶液的作用是___ (用离子反应方程式表示)。

已知:①Cl2的熔点为-101℃,沸点是-34.6℃;②HgO+2Cl2=HgCl2+Cl2O
(1)仪器a的名称是
(2)装置C的作用是
(3)通入干燥空气的目的是
(4)装置D与E之间不用橡胶管连接的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工业流程如下:
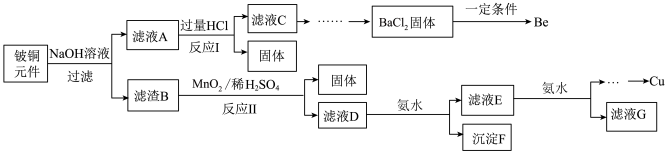
已知:i.铍、铝元素化学性质相似能形成BeO22-;ii.常温下部分难溶物的溶度积常数如下表:
(1)用NaOH溶液溶解铍铜元件步骤中提高溶解率的措施是_______ 。(至少写出两种)滤液A的主要成分除NaOH外,还有_____ (填化学式)。
(2)写出反应I中含铍化合物与过量盐酸反应的离子方程式_______ ,写出反应I中生成固体的化学方程式:________ 。
(3)滤液C中含NaCl、BeCl2和少量HCl。为提纯BeCl2,最合理的实验步骤顺序为____ (填字母)。
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH
d.加入适量的HCl e.洗涤 f.过滤
(4)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的化学方程式:______ 。
(5)该小组从1kg该种旧铍铜元件中回收得到433g Cu,则该流程Cu的产率为_______ (保留三位有效数字)。

已知:i.铍、铝元素化学性质相似能形成BeO22-;ii.常温下部分难溶物的溶度积常数如下表:
| 难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)用NaOH溶液溶解铍铜元件步骤中提高溶解率的措施是
(2)写出反应I中含铍化合物与过量盐酸反应的离子方程式
(3)滤液C中含NaCl、BeCl2和少量HCl。为提纯BeCl2,最合理的实验步骤顺序为
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH
d.加入适量的HCl e.洗涤 f.过滤
(4)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的化学方程式:
(5)该小组从1kg该种旧铍铜元件中回收得到433g Cu,则该流程Cu的产率为
您最近一年使用:0次



