已知反应H2SO3+Br2+H2O=H2SO4+2HBr。将0.1mol Cl2通入100mL含等物质的量的HBr和H2SO3的混合液中,有一半的HBr被氧化。则下列说法正确的是
| A.物质的还原性强弱:HBr>H2SO3>HCl |
| B.HBr和H2SO3的物质的量浓度为0.8mol·L-1 |
| C.通入0.1molCl2发生的离子反应:4H2SO3+5Cl2+2Br-=Br2+10Cl-+4H2SO4 |
| D.若再通入0.05molCl2恰好能将HBr和H2SO3完全氧化 |
更新时间:2022-12-21 18:35:18
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】根据表中信息,判断下列叙述中正确的是
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2(足量) | FeBr2 | / | Fe3+、Br2 | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A.氧化性强弱比较:KClO3>Fe3+>Cl2>Br2 |
| B.反应①中,发生反应2Cl2+2Fe2++2Br-=2Fe3++Br2+4Cl- |
| C.反应②中的Cl2既是氧化产物又是还原产物 |
D.③中反应的离子方程式为2MnO +3H2O2+6H+=2Mn2++4O2↑+6H2O +3H2O2+6H+=2Mn2++4O2↑+6H2O |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】化学上常用标准电极电势 (氧化型/还原型)比较物质氧化能力。
(氧化型/还原型)比较物质氧化能力。 值越高,氧化型物质的氧化能力越强,
值越高,氧化型物质的氧化能力越强, 值与体系的pH有关,根据表格数据分析,下列说法中正确的是
值与体系的pH有关,根据表格数据分析,下列说法中正确的是
 (氧化型/还原型)比较物质氧化能力。
(氧化型/还原型)比较物质氧化能力。 值越高,氧化型物质的氧化能力越强,
值越高,氧化型物质的氧化能力越强, 值与体系的pH有关,根据表格数据分析,下列说法中正确的是
值与体系的pH有关,根据表格数据分析,下列说法中正确的是| 氧化型/还原型 | 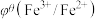 | 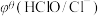 |
| 酸性介质 | 0.77 V | 1.49 V |
| 氧化型/还原型 | 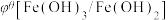 |  |
| 碱性介质 | -0.56 V | x |
| 氧化型/还原型 |  | 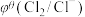 |
| 碱性介质 | 0.72 V | 1.63 V |
| A.表格数据分析,氧化性:Cl2>HClO |
| B.Fe2O3与浓盐酸发生反应:Fe2O3+2Cl-+6H+=2Fe2++Cl2↑+3H2O |
| C.从图中数据可知,氧化型物质的氧化性随着溶液酸性增强而减弱 |
| D.若x=0.81 V,碱性条件下可发生反应:Fe(OH)2+2NaClO+2NaOH=Fe2FeO4+2NaCl+2H2O |
您最近一年使用:0次
单选题
|
适中
(0.64)
【推荐1】在bLFeBr2溶液中通入amolCl2时,使溶液中50%的Br-氧化为Br2,则原FeBr2的物质的量浓度为
A.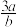 mol.L-1 mol.L-1 | B.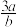 mol.L-1 mol.L-1 | C.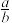 mol.L-1 mol.L-1 | D.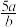 mol.L-1 mol.L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】从矿物学资料查得,一定条件下自然界存在如下反应: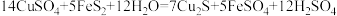 ,下列说法正确的是
,下列说法正确的是
(提示:化学反应中,元素化合价升高说明原子失去电子被氧化,元素化合价降低说明原子得到电子被还原;原子之间得失电子叫做电子的转移)
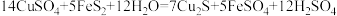 ,下列说法正确的是
,下列说法正确的是(提示:化学反应中,元素化合价升高说明原子失去电子被氧化,元素化合价降低说明原子得到电子被还原;原子之间得失电子叫做电子的转移)
| A.CuSO4在反应中会氧化FeS2 |
| B.Cu2S既是氧化产物又是还原产物 |
| C.每5个FeS2发生反应,有10个电子发生转移 |
| D.FeS2在反应中只得电子 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】“钛合金材料”被称为“二十一世纪金属材料”,某科研探究小组利用钛铁矿(主要成分为FeO-TiO2)提取金属钛,其主要流程如图所示。
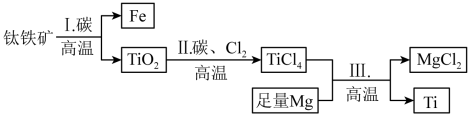
已知:①常温下钛( )与酸、碱均不反应,高温下能被空气氧化;
)与酸、碱均不反应,高温下能被空气氧化;
② 极为活泼,易水解,在空气中会与水蒸气形成烟雾。
极为活泼,易水解,在空气中会与水蒸气形成烟雾。
下列有关叙述错误的是

已知:①常温下钛(
 )与酸、碱均不反应,高温下能被空气氧化;
)与酸、碱均不反应,高温下能被空气氧化;②
 极为活泼,易水解,在空气中会与水蒸气形成烟雾。
极为活泼,易水解,在空气中会与水蒸气形成烟雾。下列有关叙述错误的是
| A.步骤I中粉碎钛铁矿和碳可使反应物充分接触以加速反应 |
B.步骤II中发生反应的化学方程式: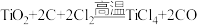 |
C.步骤III为镁粉与 溶液发生反应: 溶液发生反应: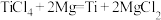 |
| D.可用稀硫酸或稀盐酸除去金属钛中的少量镁单质 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】实验室用严重锈蚀的废铁屑为原料制备硫酸亚铁晶体( ),流程如下:
),流程如下:

下列说法正确的是
 ),流程如下:
),流程如下:
下列说法正确的是
| A.上述流程中涉及的反应均属于氧化还原反应 |
B.“酸溶”时试剂 可用稀硫酸或稀盐酸 可用稀硫酸或稀盐酸 |
C.“还原”时发生反应的离子方程式为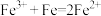 |
| D.“结晶”采用的方式是蒸发浓缩、冷却结晶 |
您最近一年使用:0次

 (VI)中间体。下图为水氧化过程中
(VI)中间体。下图为水氧化过程中 催化剂中
催化剂中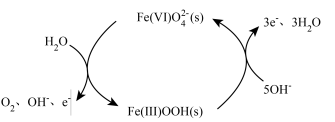
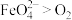
 增大
增大 固体投入
固体投入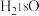 中:
中: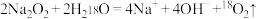
 溶液中:
溶液中: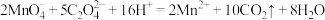
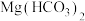 溶液与足量的
溶液与足量的 溶液反应:
溶液反应:
 溶液中滴加少量稀硫酸:
溶液中滴加少量稀硫酸:


