球上99%的溴存在于海水中,故溴也被称为海洋元素,溴主要用于制造汽油抗爆剂、药品、试剂和农药等。以海水提盐后得到的苦卤为原料,提取溴的流程如图所示。
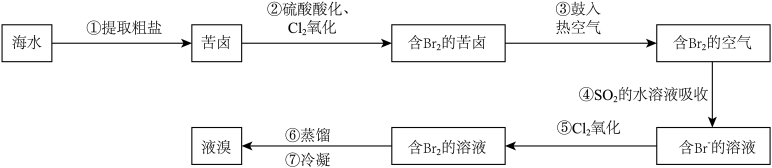
已知:Br2+SO2+2H2O= H2SO4+2HBr。
(1)苦卤可用作提取溴的原料的原因是:_______ 。
(2)写出步骤②中通入Cl2反应的离子方程式:_______ 。
(3)步骤③用热空气将溴吹出制成粗溴,是因为_______(填编号)。
(4)步骤④将Br2转化为Br-,是利用了SO2的_______ 性。
(5)设计一个简单实验,说明溴的活动性大于碘单质:_______ 。

已知:Br2+SO2+2H2O= H2SO4+2HBr。
(1)苦卤可用作提取溴的原料的原因是:
(2)写出步骤②中通入Cl2反应的离子方程式:
(3)步骤③用热空气将溴吹出制成粗溴,是因为_______(填编号)。
| A.Br2的化学性质稳定 | B.Br2沸点低,易挥发 |
| C.Br2易升华 | D.Br2不溶于水 |
(5)设计一个简单实验,说明溴的活动性大于碘单质:
更新时间:2023-01-20 23:46:06
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】盐卤中除含有Mg2+、Cl﹣外,还含有少量Na+、Fe2+、Fe3+、SO42﹣和CO(NH2)2等.从海水提取食盐和Br2后的盐卤中可以提取MgCl2、MgO、Mg(OH)2等物质,制备流程如图所示:

(1)从MgCl2溶液得到MgCl2.6H2O晶体的过程中所需的基本操作顺序依次为__________ ;
A 加热蒸馏 B 加热浓缩 C 冷却结晶 D 趁热过滤 E 过滤洗涤
(2)制取无水氯化镁必须在氯化氢存在的条件下进行,原因是___________ (用适当的文字结合化学用语说明).
(3)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为___________ ;加入NaClO的另一个作用是___________ .
(4)Mg(OH)2是制镁盐、耐火材料和阻燃剂的重要原料。
已知25℃时Ksp[Mg(OH)2]=5.6×10﹣12,且Mg(OH)2(s)═MgO(s)+H2O(s)△H=+81.5kJ/mol。
①下列叙述正确的是______
A.从盐卤或海水中获得Mg(OH)2,工业上选择NaOH作沉淀剂
B.Mg(OH)2能作阻燃剂的原因是它分解吸热且生成MgO覆盖可燃物
C.可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁
②酸碱指示剂百里酚蓝变色的pH范围如下:
25℃时,在Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为___________ .

(1)从MgCl2溶液得到MgCl2.6H2O晶体的过程中所需的基本操作顺序依次为
A 加热蒸馏 B 加热浓缩 C 冷却结晶 D 趁热过滤 E 过滤洗涤
(2)制取无水氯化镁必须在氯化氢存在的条件下进行,原因是
(3)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为
(4)Mg(OH)2是制镁盐、耐火材料和阻燃剂的重要原料。
已知25℃时Ksp[Mg(OH)2]=5.6×10﹣12,且Mg(OH)2(s)═MgO(s)+H2O(s)△H=+81.5kJ/mol。
①下列叙述正确的是
A.从盐卤或海水中获得Mg(OH)2,工业上选择NaOH作沉淀剂
B.Mg(OH)2能作阻燃剂的原因是它分解吸热且生成MgO覆盖可燃物
C.可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁
②酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,在Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】镉(Cd)可用于制作某些发光电子组件。一种用铜镉废渣(含Cd、Zn、Cu、Fe等单质)为原料制备镉的工艺流程如图。

已知相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol•L﹣1计算):
回答下列问题:
(1)“步骤Ⅱ”需隔绝氧气的原因是___________ 。
(2)“氧化”时KMnO4的还原产物是MnO2,“步骤Ⅳ”中除铁发生的离子方程式为___________ 。废渣的成分有___________ 。
(3)“置换”时镉置换率与 的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。
的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。

①实际生产中 比值最佳为1.3,不宜超过该比值的原因是
比值最佳为1.3,不宜超过该比值的原因是___________ 。
②若需置换出112kgCd,且使镉置换率达到98%,Zn的理论用量为___________ kg(计算结果保留一位小数,下同),实际加入的Zn应为___________ kg。
(4)“置换”后滤液溶质主要成分是___________ 。(填化学式)
(5)“熔炼”时,海绵镉(含Cd和Zn)与NaOH在反应釜中混合反应,反应的化学方程式是___________ 。当反应釜内无明显气泡产生时停止加热,利用Ca与Na2ZnO2的___________ 不同,将Cd从反应釜下口放出,以达到分离的目的。

已知相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol•L﹣1计算):
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)“步骤Ⅱ”需隔绝氧气的原因是
(2)“氧化”时KMnO4的还原产物是MnO2,“步骤Ⅳ”中除铁发生的离子方程式为
(3)“置换”时镉置换率与
 的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。
的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。
①实际生产中
 比值最佳为1.3,不宜超过该比值的原因是
比值最佳为1.3,不宜超过该比值的原因是②若需置换出112kgCd,且使镉置换率达到98%,Zn的理论用量为
(4)“置换”后滤液溶质主要成分是
(5)“熔炼”时,海绵镉(含Cd和Zn)与NaOH在反应釜中混合反应,反应的化学方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】实验室模拟用工业废弃固体(含有Cu2S、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(FeSO4·7H2O)和明矾[KAl(SO4)2·12H2O]的操作流程如下:
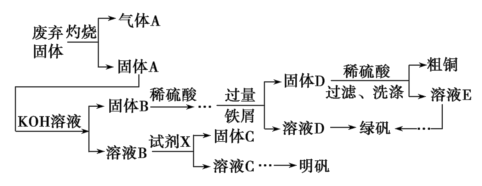
(1)试剂X是________ (写化学式)。
(2)配平下列方程式:_____  +
+_____ SO2+_____ H2O===_____ Mn2++____  +
+____ H+
(3)为了分析产品(绿矾)中铁元素的含量,某同学称取 20.0 g样品配成100 mL溶液,移取25.00 mL于锥形瓶中,用0.100 0 mol·L-1的KMnO4标准溶液进行滴定( 被还原为Mn2+)。
被还原为Mn2+)。
请回答下列问题:
①滴定时,KMnO4标准溶液应盛放在_______ 中(填仪器名称)。
②若到达滴定终点消耗KMnO4标准溶液的体积为25.00 mL,则该产品中铁元素的质量分数为__ 。

(1)试剂X是
(2)配平下列方程式:
 +
+ +
+(3)为了分析产品(绿矾)中铁元素的含量,某同学称取 20.0 g样品配成100 mL溶液,移取25.00 mL于锥形瓶中,用0.100 0 mol·L-1的KMnO4标准溶液进行滴定(
 被还原为Mn2+)。
被还原为Mn2+)。请回答下列问题:
①滴定时,KMnO4标准溶液应盛放在
②若到达滴定终点消耗KMnO4标准溶液的体积为25.00 mL,则该产品中铁元素的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】硫酸亚铁在工农业生产中具有广泛的应用。该物质不稳定,受热易分解产生氧化物,具有较强的还原性。
Ⅰ.某学习小组利用如下装置探究FeSO4受热分解的产物。

(1)甲组同学利用“A 接B 接C”的装置来验证产物中含有SO2气体。
①连接好装置后,接下来的操作是____________________ 。
②仪器a 的名称是_______________ ;其作用是____________________ 。
(2)乙组同学查阅资料得:硫酸亚铁分解的气体产物中除SO2 外还有SO3;SO3 的熔点为16.8℃,沸点是46.8℃,溶于水放出大量的然,易形成酸雾。为此设计了“A接D接C”的装置验证产物中含有SO3 。
①装置D中的现象是_________________ ,BaCl2 溶液不能用Ba (NO3)2溶液代替的原因是______________________ 。
②装置A 中固体变为红棕色,结合两组同学的实验,写出硫酸亚铁分解的化学方程式______________________ 。
③取硫酸亚铁样品18.20g,加热分解至恒重时测得固体质量为11.00g( 假设杂质不反应),该硫酸亚铁样品的纯度为__________ % (保留小数点后两位,下同),样品中铁元素的质量分数为_____________ %。
Ⅱ.用硫酸亚铁碱性试纸可检验食品中是否含有CN-,方案如下:

已知:蓝色染料普鲁士蓝的合成方法如下:

(3)若试纸变蓝则证明食品中含有CN-,基于普鲁士蓝的合成原理,请解释检测时试纸变蓝的原因______________________ 。
Ⅰ.某学习小组利用如下装置探究FeSO4受热分解的产物。

(1)甲组同学利用“A 接B 接C”的装置来验证产物中含有SO2气体。
①连接好装置后,接下来的操作是
②仪器a 的名称是
(2)乙组同学查阅资料得:硫酸亚铁分解的气体产物中除SO2 外还有SO3;SO3 的熔点为16.8℃,沸点是46.8℃,溶于水放出大量的然,易形成酸雾。为此设计了“A接D接C”的装置验证产物中含有SO3 。
①装置D中的现象是
②装置A 中固体变为红棕色,结合两组同学的实验,写出硫酸亚铁分解的化学方程式
③取硫酸亚铁样品18.20g,加热分解至恒重时测得固体质量为11.00g( 假设杂质不反应),该硫酸亚铁样品的纯度为
Ⅱ.用硫酸亚铁碱性试纸可检验食品中是否含有CN-,方案如下:

已知:蓝色染料普鲁士蓝的合成方法如下:

(3)若试纸变蓝则证明食品中含有CN-,基于普鲁士蓝的合成原理,请解释检测时试纸变蓝的原因
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某同学设计了如下装置用于制取 SO2 和验证 SO2 的性质。
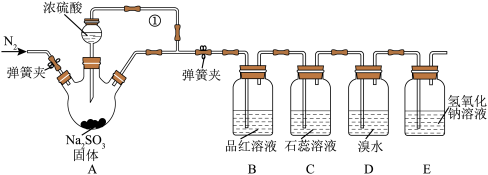
试回答以下问题:
(1)装置 A 中反应的化学方程式为___________________________________ 。
(2)导管①的作用是___________________ ,最左侧通N2的主要作用 是___________________
(3)装置 B 中的现象体现出 SO2_______________ 性。
(4)装置 D 中溴水褪色,体现出 SO2_________________ 性。
(5)E 装置的作用是______________ ,发生反应的离子方程式为_____________________ 。

试回答以下问题:
(1)装置 A 中反应的化学方程式为
(2)导管①的作用是
(3)装置 B 中的现象体现出 SO2
(4)装置 D 中溴水褪色,体现出 SO2
(5)E 装置的作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某学习小组用如图所示的实验装置探究 能否被硝酸盐氧化(部分夹持仪器省略)。
能否被硝酸盐氧化(部分夹持仪器省略)。

回答下列问题:
(1)盛装浓硫酸的仪器名称是___________ ,该仪器使用的第一步操作是___________ 。
(2)将浓硫酸滴加至三颈烧瓶中的操作是___________ 。
(3)实验时,先打开弹簧夹通一段时间 ,再滴加70%浓硫酸,目的是
,再滴加70%浓硫酸,目的是___________ 。
(4)装置A中发生反应的化学方程式为___________ 。
(5)开始实验后装置C中产生白色沉淀,实验结束后装置D试管中收集到的气体遇空气变为红棕色,则实验初期装置C中发生反应的离子方程式是___________ 。
(6)若D中试管收集到标准状况下0.224L气体,再向其中通入标准状况下______ LO2,可使试管内充满液体。
(7)测定反应后装置B溶液中 的浓度时,只考虑
的浓度时,只考虑 与
与 的反应。用0.10
的反应。用0.10 酸性
酸性 溶液与20.00mLB中溶液中的
溶液与20.00mLB中溶液中的 反应,共消耗
反应,共消耗 溶液18.00mL,则B中
溶液18.00mL,则B中 为
为___________ (保留两位小数)。
 能否被硝酸盐氧化(部分夹持仪器省略)。
能否被硝酸盐氧化(部分夹持仪器省略)。
回答下列问题:
(1)盛装浓硫酸的仪器名称是
(2)将浓硫酸滴加至三颈烧瓶中的操作是
(3)实验时,先打开弹簧夹通一段时间
 ,再滴加70%浓硫酸,目的是
,再滴加70%浓硫酸,目的是(4)装置A中发生反应的化学方程式为
(5)开始实验后装置C中产生白色沉淀,实验结束后装置D试管中收集到的气体遇空气变为红棕色,则实验初期装置C中发生反应的离子方程式是
(6)若D中试管收集到标准状况下0.224L气体,再向其中通入标准状况下
(7)测定反应后装置B溶液中
 的浓度时,只考虑
的浓度时,只考虑 与
与 的反应。用0.10
的反应。用0.10 酸性
酸性 溶液与20.00mLB中溶液中的
溶液与20.00mLB中溶液中的 反应,共消耗
反应,共消耗 溶液18.00mL,则B中
溶液18.00mL,则B中 为
为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】某学习小组按如下实验流程进行碘的制取,甲、乙两种实验方案如下:
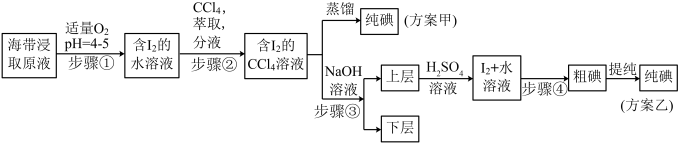
已知: ;酸性条件下,
;酸性条件下, 在水中的溶解度很小。
在水中的溶解度很小。
(1)步骤①中能代替 的最佳物质的电子式为
的最佳物质的电子式为________ 。
(2)步骤②中,萃取后分液漏斗内观察到的现象是________ 。
(3)下列有关步骤③的说法正确的是________(填序号)。
(4)方案乙中,上层液体中加入 溶液,反应的离子方程式为
溶液,反应的离子方程式为________ ,其中步骤④操作的名称是________ ;方案甲中采用蒸馏效果不佳,理由是________ 。

已知:
 ;酸性条件下,
;酸性条件下, 在水中的溶解度很小。
在水中的溶解度很小。(1)步骤①中能代替
 的最佳物质的电子式为
的最佳物质的电子式为(2)步骤②中,萃取后分液漏斗内观察到的现象是
(3)下列有关步骤③的说法正确的是________(填序号)。
| A.应控制NaOH溶液的浓度和体积 | B.将碘转化成离子进入水层 |
| C.主要目的是除去浸取原液中的有机杂质 | D.NaOH溶液可由乙醇代替 |
(4)方案乙中,上层液体中加入
 溶液,反应的离子方程式为
溶液,反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】紫菜与海带类似,是一种富含生物碘的海洋植物。商品紫菜轻薄松脆、比海带更易被焙烧成灰实验室里从紫菜中提取碘的流程如下图:
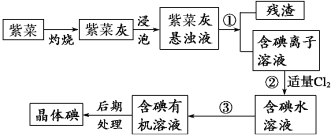
(1)实验室焙烧紫菜,需要下列仪器中的________ (填序号)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①________ ,③______ 。
(3)提取碘的过程中,可选择的有机试剂是( )
A.酒精 B.苯 C.乙酸 D.食盐水
选择该试剂的理由是___________________________________ 。
(4)为使紫菜灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有______________ 、________________ 。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,观察下面实验装置图改正其中的错误之处:

①_________________________________________ ;
②_________________________________________ ;
③_________________________________________ 。
(6)进行上述蒸馏操作时,使用水浴加热,最后晶态碘在____ 里聚集。

(1)实验室焙烧紫菜,需要下列仪器中的
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①
(3)提取碘的过程中,可选择的有机试剂是
A.酒精 B.苯 C.乙酸 D.食盐水
选择该试剂的理由是
(4)为使紫菜灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,观察下面实验装置图改正其中的错误之处:

①
②
③
(6)进行上述蒸馏操作时,使用水浴加热,最后晶态碘在
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】海水是巨大的资源宝库。
Ⅰ.从海水中提取食盐和溴 海水中溴以溴化钠为主
海水中溴以溴化钠为主 的过程如下:
的过程如下:
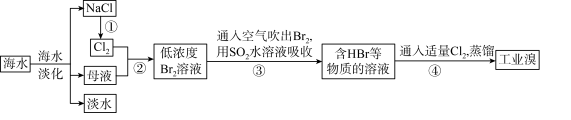
(1)工业上是利用步骤①所得的NaCl固体制备金属钠的化学方程式为:______ 。
(2)步骤②的离子方程式为:________ 。
(3)步骤③用 水溶液吸收
水溶液吸收 ,可制得两种强酸,化学方程式为:
,可制得两种强酸,化学方程式为:_____ 。
Ⅱ.海洋植物如海带、海藻中含有丰富的碘元素,燃烧的灰烬中碘元素以 的形式存在。实验室里从海藻中提取碘的流程如下:
的形式存在。实验室里从海藻中提取碘的流程如下:

(4)指出提取碘的过程中有关的实验操作名称:
①_____ ③_____ ④______
(5)提取碘的过程中,可供选择的有机试剂是_____ (填字母)。
A.苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、酒精
Ⅰ.从海水中提取食盐和溴
 海水中溴以溴化钠为主
海水中溴以溴化钠为主 的过程如下:
的过程如下:
(1)工业上是利用步骤①所得的NaCl固体制备金属钠的化学方程式为:
(2)步骤②的离子方程式为:
(3)步骤③用
 水溶液吸收
水溶液吸收 ,可制得两种强酸,化学方程式为:
,可制得两种强酸,化学方程式为:Ⅱ.海洋植物如海带、海藻中含有丰富的碘元素,燃烧的灰烬中碘元素以
 的形式存在。实验室里从海藻中提取碘的流程如下:
的形式存在。实验室里从海藻中提取碘的流程如下: 
(4)指出提取碘的过程中有关的实验操作名称:
①
(5)提取碘的过程中,可供选择的有机试剂是
A.苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、酒精
您最近一年使用:0次



