前四周期元素X、Y、Z、W、Q、R、T的原子序数依次增大,X元素原子的L层上s电子数等于p电子数,Y元素原子核外的L层有3个未成对电子,W单质暗处遇H2发生爆炸,Q元素单质常温、常压下是气体,Q原子的M层上有1个未成对的p电子,R元素价电子层各能级处于半充满状态,T元素的正三价离子的3d轨道为半充满。
回答下列问题:
(1)基态R原子的价电子排布式为_______ ,基态T原子中,两种自旋状态的电子数之比_______ 。
(2)基态X原子有_______ 种空间运动状态不同的电子,基态Z原子的电子占据最高能级的电子云轮廓图为_______ 形。
(3)Y、Z、Q原子半径由大到小的顺序是_______ (填元素符号)。
(4)同周期中第一电离能小于Y元素有_______ 种,上述元素中电负性最大的为_______ (填元素符号)。
回答下列问题:
(1)基态R原子的价电子排布式为
(2)基态X原子有
(3)Y、Z、Q原子半径由大到小的顺序是
(4)同周期中第一电离能小于Y元素有
更新时间:2023-02-10 11:20:38
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
【推荐1】下表列出了①~⑥六种元素在周期表中的位置。
回答下列问题(用化学用语填空):
(1)元素①的一种核素中,含有1个质子和1个中子,表示该核素组成的符号是___________ 。
(2)上述元素中,原子半径最大的是___________ (填元素符号)。
(3)由元素①、⑥组成的化合物的电子式为___________ 。
(4)元素⑤和⑥最高价氧化物对应的水化物酸性由强到弱的顺序是___________ (填化学式)。
(5)金属性:③___________ ④(填“>”或“<”),它们的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(6)下列说法正确的是___________ (填序号)。
a.元素②、③组成的化合物只有一种
b.元素②的气态氢化物稳定性高于元素⑤的气态氢化物
c.元素⑥在化合物中呈现的最高化合价为+7价
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ |
(1)元素①的一种核素中,含有1个质子和1个中子,表示该核素组成的符号是
(2)上述元素中,原子半径最大的是
(3)由元素①、⑥组成的化合物的电子式为
(4)元素⑤和⑥最高价氧化物对应的水化物酸性由强到弱的顺序是
(5)金属性:③
(6)下列说法正确的是
a.元素②、③组成的化合物只有一种
b.元素②的气态氢化物稳定性高于元素⑤的气态氢化物
c.元素⑥在化合物中呈现的最高化合价为+7价
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
(1)原子半径最小的元素是___________ (填元素名称);非金属性最强的是___________ (填元素符号)。
(2)②与④形成的原子个数比为1:2的化合物的结构式为___________ 。
(3)⑥与④形成的淡黄色固体,电子式为___________ ,与水反应的离子方程式为___________ 。
(4)③、④、⑥的离子半径由大到小的顺序为___________ (用离子符号表示)。
(5)②、③、⑤分别与氢气化合,形成简单气态氢化物的稳定性由强到弱的顺序为___________ (用分子式表示)。
(6)⑥的最高价氧化物对应的水化物与⑧的最高价氧化物对应的水化物反应的离子方程式为___________ 。
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(2)②与④形成的原子个数比为1:2的化合物的结构式为
(3)⑥与④形成的淡黄色固体,电子式为
(4)③、④、⑥的离子半径由大到小的顺序为
(5)②、③、⑤分别与氢气化合,形成简单气态氢化物的稳定性由强到弱的顺序为
(6)⑥的最高价氧化物对应的水化物与⑧的最高价氧化物对应的水化物反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
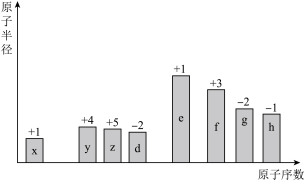
【推荐3】随着原子序数的递增,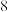 种短周期元素(用字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示。
种短周期元素(用字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示。
请回答下列问题:
(1) 在元素周期表中的位置是
在元素周期表中的位置是_______ 。
(2)比较 、
、 常见离子的半径大小:
常见离子的半径大小:_______ >_______ ;比较 、
、 的最高价氧化物的水化物的酸性强弱:
的最高价氧化物的水化物的酸性强弱:_______ >_______ 。(用化学式表示,下同)
(3) 、
、 的单质分别与
的单质分别与 的单质化合时,较容易的是
的单质化合时,较容易的是_______ ,形成的化合物热稳定性较差的是_______ 。
(4) 元素的原子间连接方式多样,两个原子间可通过共用电子对形成
元素的原子间连接方式多样,两个原子间可通过共用电子对形成_______ 键、_______ 键或_______ 键;多个原子之间可以通过共价键彼此结合形成_______ ,也可以连接形成_______ ,这也是有机化合物种类繁多的原因之一。
(5)任选上述元素形成一种四原子共价化合物,写出其电子式:_______ 。
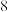 种短周期元素(用字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示。
种短周期元素(用字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示。
请回答下列问题:
(1)
 在元素周期表中的位置是
在元素周期表中的位置是(2)比较
 、
、 常见离子的半径大小:
常见离子的半径大小: 、
、 的最高价氧化物的水化物的酸性强弱:
的最高价氧化物的水化物的酸性强弱:(3)
 、
、 的单质分别与
的单质分别与 的单质化合时,较容易的是
的单质化合时,较容易的是(4)
 元素的原子间连接方式多样,两个原子间可通过共用电子对形成
元素的原子间连接方式多样,两个原子间可通过共用电子对形成(5)任选上述元素形成一种四原子共价化合物,写出其电子式:
您最近一年使用:0次
【推荐1】原子是肉眼和一般仪器都看不到的微粒,科学家们是根据可观察、可测量的宏观实验事实,经过分析和推理,揭示了原子结构的奥秘。
(1)下列说法中正确的个数是__________。
①同一原子中,s电子的能量总是低于p电子的能量
②任何s轨道形状均是球形,只是能层不同,球的半径大小不同而己
③2p、3p、4p能级的轨道数依次增多
④原子核外电子排布,先排满K层再排L层,排满M层再排N层
⑤基态碳原子的轨道表示式: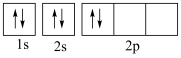
⑥ⅢB族到ⅡB族的10个纵列的元素都是金属元素
⑦用电子式表示 的形成过程:
的形成过程: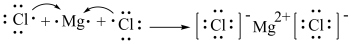
⑧基态钒原子的结构示意图为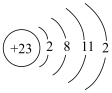
(2)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为__________ 、__________ 。
A.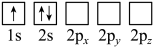 B.
B.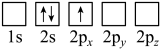
C.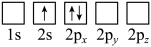 D.
D.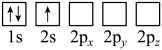
(3)研究发现,正离子的颜色与未成对电子数有关,例如: 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是__________ (从微粒结构的角度进行描述)。
(4)钠在火焰上灼烧产生的黄光是一种原子__________ 光谱(选填“发射”或“吸收”)。
(5)第四周期的元素形成的化合物在生产生活中有着重要的用途。
①镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为__________ ,按照电子排布式,镍元素在周期表中位于__________ 区。
②“玉兔二号”月球车通过砷化镓 太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为
太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为__________ 形。砷的电负性比镓__________ (填“大”或“小”)。
(6)随着科技的不断发展,人类对原子结构的认识不断深入,新型材料层出不穷。表中列出了第三周期的几种元素的部分性质:
①预测x值的区间:______ ~______ 。
②表中五种元素的第一电离能由大到小的顺序是__________ (写元素符号)。
(1)下列说法中正确的个数是__________。
①同一原子中,s电子的能量总是低于p电子的能量
②任何s轨道形状均是球形,只是能层不同,球的半径大小不同而己
③2p、3p、4p能级的轨道数依次增多
④原子核外电子排布,先排满K层再排L层,排满M层再排N层
⑤基态碳原子的轨道表示式:

⑥ⅢB族到ⅡB族的10个纵列的元素都是金属元素
⑦用电子式表示
 的形成过程:
的形成过程:
⑧基态钒原子的结构示意图为

| A.2 | B.3 | C.4 | D.5 |
(2)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(3)研究发现,正离子的颜色与未成对电子数有关,例如:
 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是(4)钠在火焰上灼烧产生的黄光是一种原子
(5)第四周期的元素形成的化合物在生产生活中有着重要的用途。
①镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为
②“玉兔二号”月球车通过砷化镓
 太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为
太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为(6)随着科技的不断发展,人类对原子结构的认识不断深入,新型材料层出不穷。表中列出了第三周期的几种元素的部分性质:
元素编号 | a | b | c | d | e |
电负性 | 3.0 | 2.5 | x | 1.5 | 0.9 |
主要化合价 |
|
|
|
|
|
②表中五种元素的第一电离能由大到小的顺序是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】主族元素碳、氧、氮、氟、磷、硒及副族元素镍、铜元素在化学中有很重要的地位,回答下列问题:
(1)在基态14C原子中,核外存在________ 对自旋相反的电子,基态氮原子的价层电子排布图为________ 。
(2)将F2通入稀NaOH溶液中可生成OF2,OF2分子构型为___ ,其中氧原子的杂化方式为_____ 。
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=_______ 。CO与N2结构相似,CO分子内σ键与π键个数之比为_________ 。
(4)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是______ 。
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释H2SeO4比H2SeO3酸性强的原因:__________ ;
(6)已知Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有__________ 个铜原子。
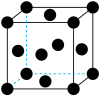
(7)用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00 g·cm-3,Cu的原子半径为________ cm(阿伏伽德罗常数为NA,只要求列式表示)。
(1)在基态14C原子中,核外存在
(2)将F2通入稀NaOH溶液中可生成OF2,OF2分子构型为
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=
(4)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释H2SeO4比H2SeO3酸性强的原因:
(6)已知Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有
(7)用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00 g·cm-3,Cu的原子半径为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铜、铬、锰均为过渡元素,其单质及化合物在工业、科技和生产中有着广泛的应用。
(1)Cu2S可用作制防污涂料、污水处理剂、催化剂等。
①灼烧Cu2S时,铜的焰色为_______ (填序号)。
A.黄色 B.洋红色 C.紫色 D.绿色
②用CuS、Cu2S处理酸性废水中的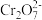 时发生的反应如下:
时发生的反应如下:
Ⅰ.CuS+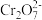 +H+→Cu2++
+H+→Cu2++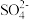 +Cr3++H2O
+Cr3++H2O
Ⅱ.Cu2S+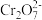 +H+→Cu2++
+H+→Cu2++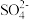 +Cr3++H2O
+Cr3++H2O
当消耗的CuS、Cu2S的物质的量相同时,两者去除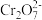 的物质的量比为
的物质的量比为_______ 。
(2)蛋氨酸铬(Ⅲ)配合物是一种治疗Ⅱ型糖尿病的药物,其结构简式如图1,请回答:

①基态Cr原子的价电子排布图:_______ 。
②该配合物中心铬离子的配位数为_______ ;第一电离能最大的元素是_______ ;碳原子的杂化轨道类型有_______ 。
(3)Mn2+能形成配离子为八面体的配合物MnClm∙nNH3,在该配合物的配离子中,Mn2+位于八面体的中心,其结构如下图所示(其中数字处的小圆圈表示NH3分子或Cl-):

若含1 mol该配合物的溶液与足量AgNO3溶液作用可生成1 mol AgCl沉淀,该配合物的化学式为_______ 。
(4)锰与硒形成的某种化合物具有优异的光电性能,其晶胞结构如下图所示。若该晶体的晶胞边长为a pm(1 pm=10-10cm),阿伏加德罗常数的值为NA,则该晶体的密度为_______ g/cm3(列出表达式即可)。

(1)Cu2S可用作制防污涂料、污水处理剂、催化剂等。
①灼烧Cu2S时,铜的焰色为
A.黄色 B.洋红色 C.紫色 D.绿色
②用CuS、Cu2S处理酸性废水中的
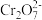 时发生的反应如下:
时发生的反应如下:Ⅰ.CuS+
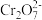 +H+→Cu2++
+H+→Cu2++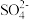 +Cr3++H2O
+Cr3++H2OⅡ.Cu2S+
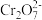 +H+→Cu2++
+H+→Cu2++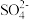 +Cr3++H2O
+Cr3++H2O当消耗的CuS、Cu2S的物质的量相同时,两者去除
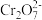 的物质的量比为
的物质的量比为(2)蛋氨酸铬(Ⅲ)配合物是一种治疗Ⅱ型糖尿病的药物,其结构简式如图1,请回答:

①基态Cr原子的价电子排布图:
②该配合物中心铬离子的配位数为
(3)Mn2+能形成配离子为八面体的配合物MnClm∙nNH3,在该配合物的配离子中,Mn2+位于八面体的中心,其结构如下图所示(其中数字处的小圆圈表示NH3分子或Cl-):

若含1 mol该配合物的溶液与足量AgNO3溶液作用可生成1 mol AgCl沉淀,该配合物的化学式为
(4)锰与硒形成的某种化合物具有优异的光电性能,其晶胞结构如下图所示。若该晶体的晶胞边长为a pm(1 pm=10-10cm),阿伏加德罗常数的值为NA,则该晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】很多物质中具有六元环的结构,回答下列问题。
(1)六氯环三磷腈分子中包含一个六元环, 是橡胶生产中的重要中间体,其结构如图所示,其熔点为113℃,在减压下,50 ℃即可升华。 在有机溶剂中,六氯环三磷腈可由五氯化磷与氯化铵反应制得,反应的方程式为: 3PCl5+ 3NH4Cl= P3N3Cl6+ 12HCl。

①比较P元素和Cl元素的第一电离能: P_______ _Cl(填“> ”或“<”)。
②在上述反应中断裂的化学键有_______ (填序号)。
A.离子键 B.配位键 C.极性键 D.非极性键 E. 氢键
③P3N3Cl6的晶体类型为_______ 。
(2)1,3-戊二酮通过两步变化,也可以形成六元环,增加了分子的稳定性,其变化如图所示:

①由A转化为B时,π键数目_______ (填“增加”、 “减少”或“不变”)。
②由B转化为C时,C比B多增加了一种微粒间作用力,该作用力是_______ 。
(3)S和Ge可构成(Ge4S10)4-,Ge和S原子也联结成六边形结构,如图所示。

①基态Ge原子的简化电子排布式为_______ 。
②图中涂黑的微粒代表_______ 元素。
(4)立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示,其最小环也是六边形结构。其晶胞结构与金刚石相似,则一个硼原子与相邻氮原子构成的空间构型为_______ 。若氮化硼晶胞边长a pm,则B-N键的键长为_______ pm。

(1)六氯环三磷腈分子中包含一个六元环, 是橡胶生产中的重要中间体,其结构如图所示,其熔点为113℃,在减压下,50 ℃即可升华。 在有机溶剂中,六氯环三磷腈可由五氯化磷与氯化铵反应制得,反应的方程式为: 3PCl5+ 3NH4Cl= P3N3Cl6+ 12HCl。

①比较P元素和Cl元素的第一电离能: P
②在上述反应中断裂的化学键有
A.离子键 B.配位键 C.极性键 D.非极性键 E. 氢键
③P3N3Cl6的晶体类型为
(2)1,3-戊二酮通过两步变化,也可以形成六元环,增加了分子的稳定性,其变化如图所示:

①由A转化为B时,π键数目
②由B转化为C时,C比B多增加了一种微粒间作用力,该作用力是
(3)S和Ge可构成(Ge4S10)4-,Ge和S原子也联结成六边形结构,如图所示。

①基态Ge原子的简化电子排布式为
②图中涂黑的微粒代表
(4)立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示,其最小环也是六边形结构。其晶胞结构与金刚石相似,则一个硼原子与相邻氮原子构成的空间构型为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰: 4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH。
(1)Mn3+基态价层电子排布图为________ 。
(2)Mn(NO3)2·6H2O中非金属元素第一电离能从大到小的顺序__________ 。从电子云重叠的方式看N中存在的化学键类型有__________ 。
(3)与NO2-互为等电子体的一种分子的化学式为________ 。
(4)1molCH3COOH中含有的σ键数目为___________ 。CH3COOH分子通过氢键形成环状二聚物,写出含氢键表示的环状二聚物的结构简式___________ 。
(5)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为_________ 。镁铝合金密度为ρg/cm3,则该晶胞的边长为__________ nm(阿伏加 德罗常数的值为N)。
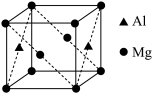
(1)Mn3+基态价层电子排布图为
(2)Mn(NO3)2·6H2O中非金属元素第一电离能从大到小的顺序
(3)与NO2-互为等电子体的一种分子的化学式为
(4)1molCH3COOH中含有的σ键数目为
(5)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】W、X、Y、Z、N是原子序数依次增大的五种短周期元素,其元素性质或原子结构如下。
回答下列问题。
(1)X的电子排布式是_______ 。
(2)Z、N的最高价氧化物对应的水化物酸性更强的是_______ (填化学式);该化合物中心原子杂化轨道类型为_______ ,该酸根离子空间构型为_______ ,W、X和N可以形成多种化合物,其中水溶液 是
是_______ (填化学式)。
(3)W的简单氢化物和Z同主族短周期元素的简单氢化物键角,更大的是(用化学式回答)_______ ,原因为:_______ 。
(4)从原子结构的角度解释元素Y的第一电离能高于同周期相邻元素的原因_______ 。
(5)W的氢化物的沸点比同主族相邻元素的氢化物的沸点_______ (填高或低),原因是_______ 。
| 元素 | 元素性质或原子结构 |
| W | 原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能低于同周期相邻元素 |
| X | 在同周期元素中,原子半径最大、第一电离能最小 |
| Y | 电离能 数据: 数据: , , ; ; ; ; …… …… |
| Z | 其价电子中,在不同形状的原子轨道中运动的电子数相等 |
| N | 只有一个不成对电子 |
(1)X的电子排布式是
(2)Z、N的最高价氧化物对应的水化物酸性更强的是
 是
是(3)W的简单氢化物和Z同主族短周期元素的简单氢化物键角,更大的是(用化学式回答)
(4)从原子结构的角度解释元素Y的第一电离能高于同周期相邻元素的原因
(5)W的氢化物的沸点比同主族相邻元素的氢化物的沸点
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
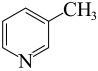
【推荐1】硼、碳、氮元素形成的化合物极为丰富。
(1)吡啶( )是一种常见的配体,其中含有与苯类似的大
)是一种常见的配体,其中含有与苯类似的大 键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。
键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。
(2) 、
、 、
、 均可作为配体,则三者中配位能力最弱的是
均可作为配体,则三者中配位能力最弱的是__________ ,其原因为__________ 。
(3)某种新型储氢材料的晶胞如图所示,其中八面体中心为 ,顶点均为配体
,顶点均为配体 ;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则
;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则__________ ,晶体类型是__________ , 与硼原子间的最短距离为
与硼原子间的最短距离为__________ cm(用含a代数式表示)。
(4)下列有关说法正确的是__________。
(1)吡啶(
 )是一种常见的配体,其中含有与苯类似的大
)是一种常见的配体,其中含有与苯类似的大 键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。
键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。A. 轨道 轨道 | B. 轨道 轨道 | C. 杂化轨道 杂化轨道 | D. 杂化轨道 杂化轨道 |
(2)
 、
、 、
、 均可作为配体,则三者中配位能力最弱的是
均可作为配体,则三者中配位能力最弱的是(3)某种新型储氢材料的晶胞如图所示,其中八面体中心为
 ,顶点均为配体
,顶点均为配体 ;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则
;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则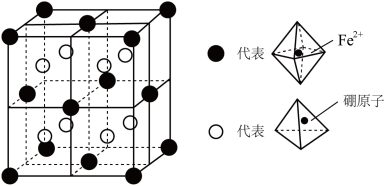
 与硼原子间的最短距离为
与硼原子间的最短距离为(4)下列有关说法正确的是__________。
| A.电负性:N>H>B | B.沸点:吡啶>苯 |
| C.第一电离能:N>C>O | D.基态 的简化电子排布式: 的简化电子排布式: |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。回答下列问题:
(1)基态Ti原子的核外电子排布式为___________ 。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是___________ 。
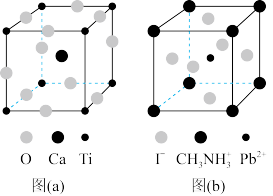
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是___________ ;金属离子与氧离子间的作用力为___________ ,Ca2+的配位数是___________ 。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH ,其晶胞如图(b)所示,其中Pb2+与图(a)中
,其晶胞如图(b)所示,其中Pb2+与图(a)中___________ 的空间位置相同。有机碱CH3NH 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是___________ 。若晶胞参数为a nm,则晶体密度为___________ g·cm-3(列出计算式)。
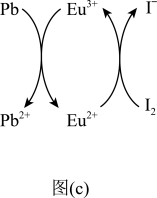
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该过程的总反应:___________ ,Eu3+在反应中的功能___________ 。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH
 ,其晶胞如图(b)所示,其中Pb2+与图(a)中
,其晶胞如图(b)所示,其中Pb2+与图(a)中 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该过程的总反应:

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】铜是人类最早发现并广泛使用的一种金属。黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:
(1)Cu的价电子排布式为___________ ,CuFeS2中三种元素的电负性从大到小的顺序为___________ (用元素符号表示)。
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是___________ ,中心原子杂化类型为___________ 。
②X的沸点比水的沸点低,主要原因是___________ 。
(3)血红素是铁卟啉化合物,是血红蛋白的组成部分,其结构如图所示,该化合物中的化学键有___________ (填标号)
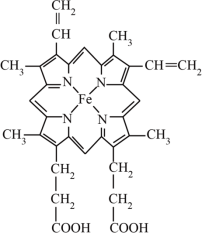
A.范德华力 B. 键 C.
键 C. 键 D.氢键 E.配位键
键 D.氢键 E.配位键
(4)某镍白铜合金的立方晶胞结构如图所示:
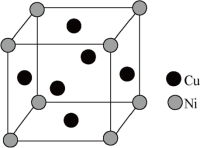
①晶胞中铜原子与镍原子的数目之比为___________ 。
②若该合金的晶胞边长为a nm,则该合金的密度为___________ g·cm-3(设NA为阿伏加德罗常数的值)
(1)Cu的价电子排布式为
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是
②X的沸点比水的沸点低,主要原因是
(3)血红素是铁卟啉化合物,是血红蛋白的组成部分,其结构如图所示,该化合物中的化学键有

A.范德华力 B.
 键 C.
键 C. 键 D.氢键 E.配位键
键 D.氢键 E.配位键(4)某镍白铜合金的立方晶胞结构如图所示:

①晶胞中铜原子与镍原子的数目之比为
②若该合金的晶胞边长为a nm,则该合金的密度为
您最近一年使用:0次

 ,
,
 ,
,
 ,
,




