硫代硫酸钠(Na2S2O3)是中学常用试剂。某小组针对硫代硫酸钠展开探究:
实验(一)探究影响化学反应速率的因素。
甲设计如下实验方案:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+ H2O
实验结果:b>a>c。
(1)V=_______ 。
(2)上述实验方案可以探究影响化学反应速率的外界因素有_______ 。
(3)对照实验I、III得出实验结论是_______ 。
实验(二)测定 Na2S2O3 样品纯度。
乙设计实验测定硫代硫酸钠样品纯度:
步骤1:称取10.0g样品溶于水配制成250mL溶液。
步骤2:用碱式滴定管准确量取20. 00 mL配制溶液于仪器A中,滴几滴溶液B。
步骤3:用仪器C盛装标准0.1 mol·L-1 I2溶液并滴定步骤2中溶液至终点,做三次平行实验,测得消耗滴定液平均体积为25. 00 mL。已知:滴定反应为2 Na2S2O3+I2=2NaI+ Na2S4O6。
(4)仪器A是_______ (填名称,下同),溶液B是_______ 。仪器C是_______ 。
(5)滴定终点的现象是_______ 。
(6)该样品中Na2S2O3的纯度为_______ %(结果保留四位有效数字)。如果其他操作都正确,仪器C没有用待装液润洗,测得结果会_______ (填“偏高”“偏低”或“无影响”)。
实验(一)探究影响化学反应速率的因素。
甲设计如下实验方案:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+ H2O
| 实验 | 0.1 mol·L-1 Na2 S2O3 (aq)/mL | 0.1 mol·L-1 H2SO4 (aq)/mL | 蒸馏水/mL | 温度/°C | 出现浑浊 时间/s |
| I | 10.0 | 10.0 | 0 | 25 | a |
| II | 10.0 | 5.0 | V | 25 | b |
| III | 10.0 | 10.0 | 0 | 35 | c |
(1)V=
(2)上述实验方案可以探究影响化学反应速率的外界因素有
(3)对照实验I、III得出实验结论是
实验(二)测定 Na2S2O3 样品纯度。
乙设计实验测定硫代硫酸钠样品纯度:
步骤1:称取10.0g样品溶于水配制成250mL溶液。
步骤2:用碱式滴定管准确量取20. 00 mL配制溶液于仪器A中,滴几滴溶液B。
步骤3:用仪器C盛装标准0.1 mol·L-1 I2溶液并滴定步骤2中溶液至终点,做三次平行实验,测得消耗滴定液平均体积为25. 00 mL。已知:滴定反应为2 Na2S2O3+I2=2NaI+ Na2S4O6。
(4)仪器A是
(5)滴定终点的现象是
(6)该样品中Na2S2O3的纯度为
更新时间:2023-02-11 16:50:25
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某研究性学习小组为探究锌与盐酸反应,取同质量、同体积大小的锌片、同浓度盐酸(过量)做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
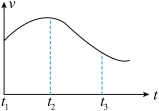
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是_______ ,t2~t3速率变化的主要原因是________ 。
(2)实验②放出氢气的量减少的原因是_______ 。
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:

实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是
(2)实验②放出氢气的量减少的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】影响化学反应速率的因素有很多方面。请回答下列问题:
(一)某学习小组同学根据影响化学反应速率的因素进行实验验证,其设计的实验方案如下:请你帮他们把表填写完整,并做出评价。
(1)甲同学验证还原性:I->Br-
(评价)甲同学设计的实验方案是____ (填“合理”或“不合理”),理由是____ 。
(2)乙同学验证固体反应物的颗粒大小对反应速率影响
实验步骤:在试管①中加入1g粉末状大理石,加入4mol/L盐酸20mL(过量);在试管②中加入2g颗粒状大理石,加入4mol/L盐酸20mL(过量)。他根据实验过程,绘制出的生成CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图,你认为____ 是符合的。
(二)控制变量法是化学探究的重要方法,明明同学利用1.0mol·L-1稀硫酸与铁反应,探究响化学反应速率的因素时得到如表实验数据:
分析上述数据,回答下列问题:
(3)实验1和2表明,影响反应速率因素是____ 。表中x=____ ,判断依据为____ 。
(4)表明反应物浓度对化学反应速率影响的实验组是____ (填实验序号)。
(5)本实验中影响反应速率的因素还有____ 。
(6)实验3中若在铁片上放一只碳棒,金属消失的时间会远小于125s,其原因是____ 。
(一)某学习小组同学根据影响化学反应速率的因素进行实验验证,其设计的实验方案如下:请你帮他们把表填写完整,并做出评价。
(1)甲同学验证还原性:I->Br-
| 实验步骤 | 实验现象 | 实验结论及离子反应式 |
 | 逐滴加入的同时振荡,观察CCl4层的颜色: 甲 乙 乙中CCl4层颜色明显变化的快。 | 离子方程式: 甲 乙 结论:验证成立,还原性,I->Br- |
(2)乙同学验证固体反应物的颗粒大小对反应速率影响
实验步骤:在试管①中加入1g粉末状大理石,加入4mol/L盐酸20mL(过量);在试管②中加入2g颗粒状大理石,加入4mol/L盐酸20mL(过量)。他根据实验过程,绘制出的生成CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图,你认为
A. | B.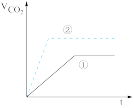 |
C. | D. |
(二)控制变量法是化学探究的重要方法,明明同学利用1.0mol·L-1稀硫酸与铁反应,探究响化学反应速率的因素时得到如表实验数据:
| 实验序号 | 铁的质量/g | 铁的形状 | V(H2SO4)/mL | V(H2O)/mL | 初始溶液的温度/℃ | 金属消失的时间/s |
| 1 | 0.10 | 铁片 | 40 | 10 | 20 | 200 |
| 2 | 0.10 | 铁粉 | 40 | x | 20 | 25 |
| 3 | 0.10 | 铁片 | 50 | 0 | 20 | 125 |
| 4 | 0.10 | 铁片 | 50 | 0 | 35 | 50 |
(3)实验1和2表明,影响反应速率因素是
(4)表明反应物浓度对化学反应速率影响的实验组是
(5)本实验中影响反应速率的因素还有
(6)实验3中若在铁片上放一只碳棒,金属消失的时间会远小于125s,其原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】小组同学探究镁与银氨溶液反应的产物及影响其反应速率的因素。
I.探究镁与银氨溶液反应的产物
【实验1】向 溶液中逐滴加入
溶液中逐滴加入 氨水,最终得到无色透明溶液。
氨水,最终得到无色透明溶液。
【实验2】

(1)实验1中,反应的离子方程式是___________ 。
(2)由实验2-2可证明2-1中有Ag生成,则2-2中加入过量稀硝酸后可观察到的现象是_____ 。
(3)由实验2-3可证明2-1中有 生成,则试剂甲、乙分别为
生成,则试剂甲、乙分别为___________ 、___________ (填字母)。
a.稀硝酸 b.稀盐酸 c. 溶液 d.
溶液 d. 溶液
溶液
(4)经检验,实验2-1中产生的气体有 和
和 。
。
①检验产生气体中有 的操作及现象:将湿润的红色石蕊试纸置于试管口处,观察到
的操作及现象:将湿润的红色石蕊试纸置于试管口处,观察到_________ 。
②生成 、
、 、
、 的反应可表示为:
的反应可表示为: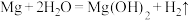 、
、___________ 。
II.探究影响镁与银氨溶液反应生成 速率的因素
速率的因素
【实验3】用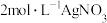 溶液、
溶液、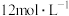 氨水按照下表所示用量配制好银氨溶液后,放入等量打磨过的镁条,记录收集
氨水按照下表所示用量配制好银氨溶液后,放入等量打磨过的镁条,记录收集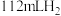 所用时间。
所用时间。
(5)实验3-3中,a=___________ 。
(6)根据上述实验分析,银氨溶液中 浓度越大,产生
浓度越大,产生 的速率越快的主要原因是
的速率越快的主要原因是___________ 。
III.实验结论与反思
(7)综合上述实验,可知Mg与银氨溶液反应后的产物有Ag、 、
、 、
、 、
、 等;小组同学推测氨水浓度也是影响Mg与银氨溶液反应生成Ag的速率的因素。他们的推测
等;小组同学推测氨水浓度也是影响Mg与银氨溶液反应生成Ag的速率的因素。他们的推测___________ (填“合理”或“不合理”),理由是___________ 。
I.探究镁与银氨溶液反应的产物
【实验1】向
 溶液中逐滴加入
溶液中逐滴加入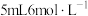 氨水,最终得到无色透明溶液。
氨水,最终得到无色透明溶液。【实验2】

(1)实验1中,反应的离子方程式是
(2)由实验2-2可证明2-1中有Ag生成,则2-2中加入过量稀硝酸后可观察到的现象是
(3)由实验2-3可证明2-1中有
 生成,则试剂甲、乙分别为
生成,则试剂甲、乙分别为a.稀硝酸 b.稀盐酸 c.
 溶液 d.
溶液 d. 溶液
溶液(4)经检验,实验2-1中产生的气体有
 和
和 。
。①检验产生气体中有
 的操作及现象:将湿润的红色石蕊试纸置于试管口处,观察到
的操作及现象:将湿润的红色石蕊试纸置于试管口处,观察到②生成
 、
、 、
、 的反应可表示为:
的反应可表示为: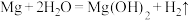 、
、II.探究影响镁与银氨溶液反应生成
 速率的因素
速率的因素【实验3】用
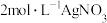 溶液、
溶液、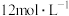 氨水按照下表所示用量配制好银氨溶液后,放入等量打磨过的镁条,记录收集
氨水按照下表所示用量配制好银氨溶液后,放入等量打磨过的镁条,记录收集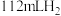 所用时间。
所用时间。| 序号 | 配制银氨溶液所用试剂 | 配好的银氨溶液的组成 | 时间 s | |||
 体积 体积mL |  溶液体积 溶液体积mL | 氨水体积 mL |  浓度 浓度 | 氨水浓度 | ||
| 3-1 | 6.00 | 1.00 | 1.00 | 0.25 | 1.00 | 600 |
| 3-2 | 4.00 | 2.50 | 1.50 | 0.625 | 1.00 | 300 |
| 3-3 | 2.00 | 4.00 | a | 1.00 | 1.00 | 60 |
(5)实验3-3中,a=
(6)根据上述实验分析,银氨溶液中
 浓度越大,产生
浓度越大,产生 的速率越快的主要原因是
的速率越快的主要原因是III.实验结论与反思
(7)综合上述实验,可知Mg与银氨溶液反应后的产物有Ag、
 、
、 、
、 、
、 等;小组同学推测氨水浓度也是影响Mg与银氨溶液反应生成Ag的速率的因素。他们的推测
等;小组同学推测氨水浓度也是影响Mg与银氨溶液反应生成Ag的速率的因素。他们的推测
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】I.(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。写出反应的离子方程式:_______________________ 。
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0 mol/L的H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是________________________________________________ 。
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是_________________________________________ 。
Ⅱ.生活污水中的磷和氮主要以磷酸盐和铵盐形式存在。
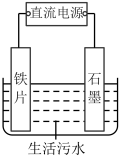
(1)除磷的原理如上图所示,利用电解法将PO43-转化为Fe3(PO4)2沉淀除去。铁作___________ ,(填“阴极”“阳极”),用化学用语表示产生Fe2+的主要过程:__________________________ 。
(2)有Cl-存在时,除氮原理如图所示,主要依靠电解产生的有效氯(HClO、ClO-)将NH4+或NH3氧化为N2.当pH<7时,主要发生HClO氧化NH4+的反应,其离子方程式为:_________________________________ 。

(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0 mol/L的H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| 温 度(T) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率×10-3mol·L-1·min-1 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是
Ⅱ.生活污水中的磷和氮主要以磷酸盐和铵盐形式存在。

(1)除磷的原理如上图所示,利用电解法将PO43-转化为Fe3(PO4)2沉淀除去。铁作
(2)有Cl-存在时,除氮原理如图所示,主要依靠电解产生的有效氯(HClO、ClO-)将NH4+或NH3氧化为N2.当pH<7时,主要发生HClO氧化NH4+的反应,其离子方程式为:

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某组同学为探究草酸浓度对该反应速率的影响,设计下列对照实验:
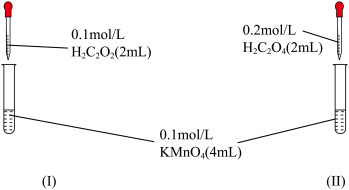
(1)写出上述反应的离子方程式____________ 。
(2)根据所学知识,你预期的实验现象是:_______ (填“l”或“Ⅱ”)中紫色先褪去
(3)实验时,他们发现反应速率的变化从开始后的一段时间内,变化趋势如图,已知反应过程中温度基本不变,分析:
①反应开始时,速度加块的原因为________ ;
②后期反应速度下降的原因为________ 。

(1)写出上述反应的离子方程式
(2)根据所学知识,你预期的实验现象是:
(3)实验时,他们发现反应速率的变化从开始后的一段时间内,变化趋势如图,已知反应过程中温度基本不变,分析:
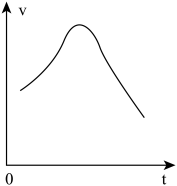
①反应开始时,速度加块的原因为
②后期反应速度下降的原因为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】从某工业废水中获取的砷滤饼的主要成分有As2S3、CuS、Bi2S3。采用硫化钠浸出砷-硫酸沉淀砷的工艺可回收砷滤饼中的铜和铋并制得砷酸(H3AsO4),工艺流程如下:
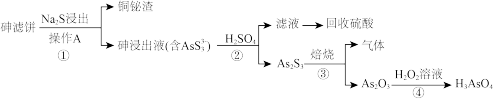
回答下列问题:
(1)操作A的名称是_______ 。
(2)步骤②发生非氧化还原反应,离子方程式为_______ 。
(3)步骤③“焙烧”反应中氧化剂与还原剂的物质的量之比为_______ ,吸收“焙烧”生成的气体的试剂是_______ 。
(4)步骤④的化学方程式为_______ 。
(5)为确定最优工艺条件,采用单因素实验考查硫化钠浸出砷和硫酸沉淀砷的影响因素。
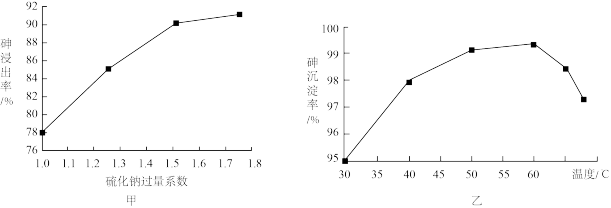
①控制反应温度为35℃,反应时间为1.5 h,硫化钠过量系数对砷浸出率的影响的实验结果如图甲。实际选取硫化钠过量系数为1.5,原因是_______ 。
②反应温度对硫酸沉淀砷的影响实验结果如图乙。结合步骤②的反应,说明砷沉淀率在60 ℃之前随温度升高而增大可能的原因:_______ 。
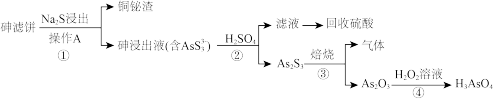
回答下列问题:
(1)操作A的名称是
(2)步骤②发生非氧化还原反应,离子方程式为
(3)步骤③“焙烧”反应中氧化剂与还原剂的物质的量之比为
(4)步骤④的化学方程式为
(5)为确定最优工艺条件,采用单因素实验考查硫化钠浸出砷和硫酸沉淀砷的影响因素。

①控制反应温度为35℃,反应时间为1.5 h,硫化钠过量系数对砷浸出率的影响的实验结果如图甲。实际选取硫化钠过量系数为1.5,原因是
②反应温度对硫酸沉淀砷的影响实验结果如图乙。结合步骤②的反应,说明砷沉淀率在60 ℃之前随温度升高而增大可能的原因:
您最近一年使用:0次



