下图所示转化关系中,A、B均为单质,F为酸性氧化物,C为日常生活中最常见的无色无味液体,D、E、G、H均为含A元素的化合物,H常用作膨松剂(其他与题目无关的生成物均已略去)。
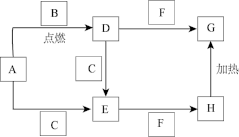
回答下列问题:
(1)A在空气中久置易变质,最终生成_______ (填化学式)。
(2)C+D→E的离子方程式为_______ ;
(3)H→G的化学方程式为_______ 。
(4)E与F反应可以生成H,也可以生成G,生成H的离子方程式为_______ ;除去H溶液中混有的G的试剂是_______ (填化学式)。

回答下列问题:
(1)A在空气中久置易变质,最终生成
(2)C+D→E的离子方程式为
(3)H→G的化学方程式为
(4)E与F反应可以生成H,也可以生成G,生成H的离子方程式为
更新时间:2023/03/15 08:05:23
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】硫酰氯(SO2Cl2)是一种重要的化工试剂,氯化法是合成硫酰氯(SO2Cl2)的常用方法。实验室合成硫酰氯的实验装置如图所示(部分夹持装置未画出):
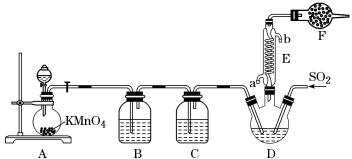
已知:①SO2(g)+Cl2(g)=SO2Cl2(l) ΔH=-97.3 kJ•mol-1。
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”。
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1)装置A中发生反应的离子方程式为____ 。
(2)装置B的作用为____ ,若缺少装置C,装置D中SO2与Cl2还可能发生反应的化学方程式为_____ 。
(3)E中冷凝水的入口是____ (填“a”或“b”),F的作用为____ 。
(4)当装置A中排出氯气1.12 L(已折算成标准状况)时,最终得到5.4 g纯净的硫酰氯,则硫酰氯的产率为____ ,为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有____ (填序号)。
①先通冷凝水,再通气
②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温
④加热三颈烧瓶
(5)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯2ClSO3H=SO2Cl2+H2SO4,分离产物的方法是____ 。
(6)长期存放的硫酰氯会发黄,其原因可能为____ 。

已知:①SO2(g)+Cl2(g)=SO2Cl2(l) ΔH=-97.3 kJ•mol-1。
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”。
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1)装置A中发生反应的离子方程式为
(2)装置B的作用为
(3)E中冷凝水的入口是
(4)当装置A中排出氯气1.12 L(已折算成标准状况)时,最终得到5.4 g纯净的硫酰氯,则硫酰氯的产率为
①先通冷凝水,再通气
②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温
④加热三颈烧瓶
(5)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯2ClSO3H=SO2Cl2+H2SO4,分离产物的方法是
| A.重结晶 | B.过滤 | C.蒸馏 | D.萃取 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】卤素是典型的非金属元素。为探究卤素中Cl、Br、I的性质,某同学依次设计了如下的实验。
(1)某同学向无色的KI溶液中滴加少量氯水,发现无色溶液变为___________ 色,写出该反应的离子方程式___________ 。
(2)还需要再设计___________ 个类似于(1)的简单实验(填“1”、“2”或“3”,“4”),根据(1)、(2)所有的实验现象可以得到规律:氧化性Cl2>Br2>I2。
(3)根据___________ (填写实验操作和现象或者化学性质),可以判断非金属性F>Cl。
(4)因此,非金属性F>Cl>Br>I.在元素周期表中,同主族元素从上到下,___________ 数不变,___________ 依次增多,___________ 逐渐增大,___________ 能力逐渐减弱。所以,非金属性逐渐减弱。
(1)某同学向无色的KI溶液中滴加少量氯水,发现无色溶液变为
(2)还需要再设计
(3)根据
(4)因此,非金属性F>Cl>Br>I.在元素周期表中,同主族元素从上到下,
您最近一年使用:0次
【推荐3】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
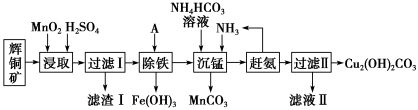
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
② Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有__________ (任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:______________ 。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_________ ,若加 A 后溶液的 pH调为4.0,则溶液中 Fe3+的浓度为_________ mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:_________________________ 。
(5)“赶氨”时,最适宜的操作方法是________________ 。
(6)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是________________ 。

已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
② Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:
(5)“赶氨”时,最适宜的操作方法是
(6)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】在四个无标签的试剂瓶中,分别盛有盐酸、Ba(OH)2 溶液、Na2CO3溶液、AgNO3溶液。为了确定各瓶试剂,将它们分别编号为A、B、C、D,分别取样两两混合,其实验现象为: A+B→无色气体 B+C→白色沉淀 A+D→白色沉淀 A+C→无明显现象 (1)由此推断各试剂瓶中所盛试剂为(填化学式)
A:________ B:________ C:________ D:__________
(2)写出下列反应的离子方程式
①A+C:_________________________________________________
②A+D:_________________________________________________
A:
(2)写出下列反应的离子方程式
①A+C:
②A+D:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】已知A是一种具有磁性、银白色的金属单质,B的摩尔质量为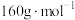 ,F的粒子直径在
,F的粒子直径在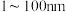 之间。有关A的一些转化如下图所示:
之间。有关A的一些转化如下图所示:
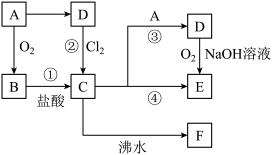
回答下列问题:
(1)B和D的化学式分别为_______ 、_______ 。
(2)①~④中属于化合反应的是_______ (填序号)。
(3)反应③的离子方程式为_______ 。
(4)写出反应①的化学方程式为_______ 。
(5)将C的饱和溶液滴入沸水中,并继续煮沸至红褐色,停止加热制得的分散系F是_______ (填“胶体”或“溶液”),它与C和E的本质区别是_______ 。
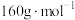 ,F的粒子直径在
,F的粒子直径在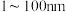 之间。有关A的一些转化如下图所示:
之间。有关A的一些转化如下图所示:
回答下列问题:
(1)B和D的化学式分别为
(2)①~④中属于化合反应的是
(3)反应③的离子方程式为
(4)写出反应①的化学方程式为
(5)将C的饱和溶液滴入沸水中,并继续煮沸至红褐色,停止加热制得的分散系F是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X和H是固体,B和G是液体,其余均为气体,1 mol X分解得到A、B、C各1 mol。

试回答下列各题:
(1)写出下列物质的化学式:X______________ ,B______________ 。
(2)写出下列反应的化学方程式:
①G+H→A+F:_______________________________ 。
②C+D→E:__________________________________ 。
(3)写出下列反应的离子方程式:
G+Cu→E:___________________________________ 。
(4)工业上合成C,合成后采用_________________ 的方法从混合气体中分离出C,能用上述方法分离出C的原因是_______________________________ 。

试回答下列各题:
(1)写出下列物质的化学式:X
(2)写出下列反应的化学方程式:
①G+H→A+F:
②C+D→E:
(3)写出下列反应的离子方程式:
G+Cu→E:
(4)工业上合成C,合成后采用
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】下图中的各字母表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A是金属单质;B是淡黄色固体; C、D、E为无色气体,D能使湿润的红色石蕊试纸变蓝;H是无色液体。

(1)写出下列各物质的化学式:
B:____________________________ ;F:_______________________ 。
(2)写出D→E反应的化学方程式为:______________________ 。
(3)写出G→E反应的离子方程式:________________________________ ;若该反应中转移电子总数为9.03 ×1023 ,则被还原的G为___________________ g 。
(4)写出实验室制取D的化学方程式________________________________

(1)写出下列各物质的化学式:
B:
(2)写出D→E反应的化学方程式为:
(3)写出G→E反应的离子方程式:
(4)写出实验室制取D的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】碱金属广泛应用于电池、陶瓷、玻璃、润滑剂、制冷液、核工业以及光电等领域,它们的化学性质显示出十分明显的同系行为,根据所学知识回答下列问题:
(1)如图所示,先用弹簧夹夹住橡胶管,点燃钠(足量),迅速伸入瓶中并塞上瓶塞,发生反应的化学方程式为___________ ,产物的颜色是___________ ,待反应完全并冷却至原温度后,打开弹簧夹,则观察到的现象是___________ (假设装置的气密性良好)。
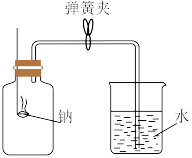
(2)按照实验研究和元素周期律推理,元素锂和水反应与钠和水反应比较,反应更剧烈的元素是___________ (填元素符号),锂与水反应的离子方程式是___________ ,锂还是一种重要的储氢材料,其吸氢原理如下: ,则该反应中还原剂是
,则该反应中还原剂是___________ ,每消耗 28g锂相当于可以储存氢气体积为___________ L(H2)密度 0.089g/L,保留到小数点后一位)。
(1)如图所示,先用弹簧夹夹住橡胶管,点燃钠(足量),迅速伸入瓶中并塞上瓶塞,发生反应的化学方程式为

(2)按照实验研究和元素周期律推理,元素锂和水反应与钠和水反应比较,反应更剧烈的元素是
 ,则该反应中还原剂是
,则该反应中还原剂是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】根据所学知识回答下列问题:

(1)将一小块新切的金属钠迅速放入平底烧瓶底部按图甲所示塞紧瓶塞。一段时间后可观察到的现象有_______ ,发生反应的化学方程式为_______ 。
(2)按图乙所示的装置,进行钠与水反应的实验,实验开始时,振动细铁丝使钠块掉入滴有酚酞的水溶液中,可观察到钠与水反应的现象,不同的现象反映钠的不同性质。
①能证明钠的密度比水的小的现象是_______ 。
②能证明钠的熔点低的现象是_______ 。
③能证明有氢氧化钠生成的现象是_______ 。
(3)少量 与
与 溶液可发生反应,其化学方程式为
溶液可发生反应,其化学方程式为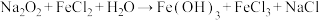 (未配平)。已知
(未配平)。已知 的化学计量数为6配平上述化学方程式,并用单线桥法标出电子转移的方向和数目:
的化学计量数为6配平上述化学方程式,并用单线桥法标出电子转移的方向和数目:_______ 。该反应中被还原的元素是_______ (填元素符号),氧化产物是_______ (填化学式)。
(4)向 中滴加浓盐酸试管壁发热,有刺激性气味的气体产生,反应后所得溶液呈浅黄绿色。推测产生该气体的反应的化学方程式为
中滴加浓盐酸试管壁发热,有刺激性气味的气体产生,反应后所得溶液呈浅黄绿色。推测产生该气体的反应的化学方程式为_______ 。

(1)将一小块新切的金属钠迅速放入平底烧瓶底部按图甲所示塞紧瓶塞。一段时间后可观察到的现象有
(2)按图乙所示的装置,进行钠与水反应的实验,实验开始时,振动细铁丝使钠块掉入滴有酚酞的水溶液中,可观察到钠与水反应的现象,不同的现象反映钠的不同性质。
①能证明钠的密度比水的小的现象是
②能证明钠的熔点低的现象是
③能证明有氢氧化钠生成的现象是
(3)少量
 与
与 溶液可发生反应,其化学方程式为
溶液可发生反应,其化学方程式为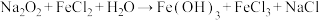 (未配平)。已知
(未配平)。已知 的化学计量数为6配平上述化学方程式,并用单线桥法标出电子转移的方向和数目:
的化学计量数为6配平上述化学方程式,并用单线桥法标出电子转移的方向和数目:(4)向
 中滴加浓盐酸试管壁发热,有刺激性气味的气体产生,反应后所得溶液呈浅黄绿色。推测产生该气体的反应的化学方程式为
中滴加浓盐酸试管壁发热,有刺激性气味的气体产生,反应后所得溶液呈浅黄绿色。推测产生该气体的反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】已知A、B、C、D、E、F、G为中学化学中常见的化合物,其中A是淡黄色固体,G为红褐色沉淀。常温下甲、乙、丙为气态非金属单质,丙呈黄绿色;丁、戊为常见金属单质,其中戊是当前用量最大的金属。它们之间的转化关系如图所示(有的反应部分产物已经略去)。请根据以上信息回答下列问题:________ ,其阴阳离子个数比________ 。
(2)工业上用丙通入C溶液中,所得溶液的用途是________ 。
(3)F转化为G总的化学方程式是____________ ;若反应生成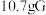 ,转移电子的数目为
,转移电子的数目为_________ (用表示 阿伏伽德罗常数的值)。
阿伏伽德罗常数的值)。
(4)写出②中反应的离子方程式:______ 。
(5)用酸性高锰酸钾溶液能否检验 中有
中有 ,
,______ (填“能”或“否”)若填“否”,原因是_________ (用离子方程式表示)。

(2)工业上用丙通入C溶液中,所得溶液的用途是
(3)F转化为G总的化学方程式是
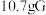 ,转移电子的数目为
,转移电子的数目为 阿伏伽德罗常数的值)。
阿伏伽德罗常数的值)。(4)写出②中反应的离子方程式:
(5)用酸性高锰酸钾溶液能否检验
 中有
中有 ,
,
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物。B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。请回答下列问题:

(1)甲__________ ;D__________ ;G__________ 。
(2)画出C中阳离子的结构示意图:__________ 。
(3)在空气中将C溶液滴入F溶液中,观察到的现象是____________________ 。
(4)反应①-⑤中,既属于化合反应又属于氧化还原反应的是__________ (填序号)。
(5)A与B反应的离子方程式为____________ 。
(6)实验室中存放氯化亚铁溶液,经常在其中放入表面除锈的铁钉,目的是______________ 。
(7)在配制G时,由于实验员失误,可能导致溶液中含有少量的F,为帮助实验员进行检验少量F的存在,请从下列物质中选择合适的试剂__________ 。
A KSCN溶液 B 稀盐酸 C KMnO4溶液 D NaOH溶液

(1)甲
(2)画出C中阳离子的结构示意图:
(3)在空气中将C溶液滴入F溶液中,观察到的现象是
(4)反应①-⑤中,既属于化合反应又属于氧化还原反应的是
(5)A与B反应的离子方程式为
(6)实验室中存放氯化亚铁溶液,经常在其中放入表面除锈的铁钉,目的是
(7)在配制G时,由于实验员失误,可能导致溶液中含有少量的F,为帮助实验员进行检验少量F的存在,请从下列物质中选择合适的试剂
A KSCN溶液 B 稀盐酸 C KMnO4溶液 D NaOH溶液
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某小组同学欲实验验证 的化学性质,探究催化氧化反应,按如图装置进行实验。A、B装置可选药品:浓氨水、
的化学性质,探究催化氧化反应,按如图装置进行实验。A、B装置可选药品:浓氨水、 、蒸馏水、
、蒸馏水、 固体、
固体、 ,C、D为干燥装置。
,C、D为干燥装置。
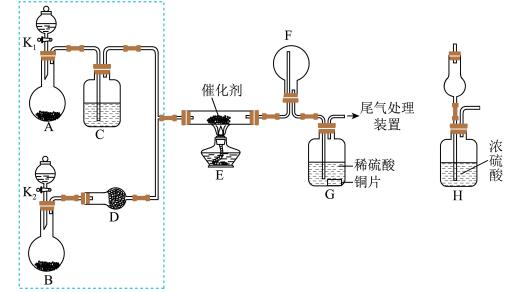
(1)装置A、B中产生气体的化学式分别是A:__________ ,B:_________ ,E中发生反应的化学方程式是___________________________________ 。
(2)甲乙两同学分别按上述装置进行实验,一段时间后,装置G中溶液都变成蓝色。甲观察到装置F中有红棕色气体,红棕色气体的成分是(写化学式)__________ ,乙观察到装置F中只有白烟生成,白烟的成分是(写化学式)__________ 。
(3)为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进。除了调节 和
和 控制A、B装置中的产气量外,还可以在装置E、F间增加一个H装置,理由是
控制A、B装置中的产气量外,还可以在装置E、F间增加一个H装置,理由是__________________________________ ,该装置采用空的干燥管,目的是________________________________ 。
(4)为实现该反应,也可用如下图所示的装置替换上述装置中虚线框部分,该气体发生装置涉及多个化学反应,如: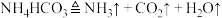 ,写出装置中还可能的化学方程式
,写出装置中还可能的化学方程式_________________________ (写出一个即可)。
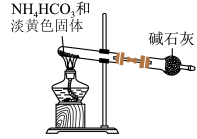
(5)运输氨时,不能使用铜及其合金制造的管道阀门,因为,在潮湿的环境中,金属铜在有 存在时能被空气中的
存在时能被空气中的 氧化,生成
氧化,生成 ,该反应的离子方程式为
,该反应的离子方程式为_______________________________ 。
 的化学性质,探究催化氧化反应,按如图装置进行实验。A、B装置可选药品:浓氨水、
的化学性质,探究催化氧化反应,按如图装置进行实验。A、B装置可选药品:浓氨水、 、蒸馏水、
、蒸馏水、 固体、
固体、 ,C、D为干燥装置。
,C、D为干燥装置。
(1)装置A、B中产生气体的化学式分别是A:
(2)甲乙两同学分别按上述装置进行实验,一段时间后,装置G中溶液都变成蓝色。甲观察到装置F中有红棕色气体,红棕色气体的成分是(写化学式)
(3)为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进。除了调节
 和
和 控制A、B装置中的产气量外,还可以在装置E、F间增加一个H装置,理由是
控制A、B装置中的产气量外,还可以在装置E、F间增加一个H装置,理由是(4)为实现该反应,也可用如下图所示的装置替换上述装置中虚线框部分,该气体发生装置涉及多个化学反应,如:
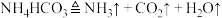 ,写出装置中还可能的化学方程式
,写出装置中还可能的化学方程式
(5)运输氨时,不能使用铜及其合金制造的管道阀门,因为,在潮湿的环境中,金属铜在有
 存在时能被空气中的
存在时能被空气中的 氧化,生成
氧化,生成 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次



