钛在医疗领域的应用非常广泛,如:制人造关节、主动心瓣等。 是制备金属钛的重要中间体,某小组同学利用如下装置在实验室制备
是制备金属钛的重要中间体,某小组同学利用如下装置在实验室制备 (夹持装置略)。
(夹持装置略)。
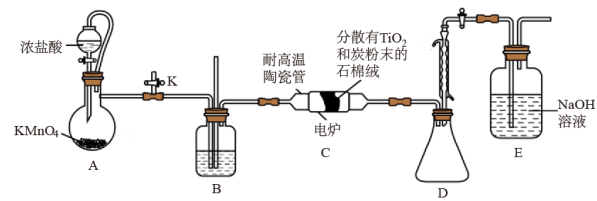
资料表明:室温下, 为无色液体,易挥发,高温时能与
为无色液体,易挥发,高温时能与 反应,与HCl不发生反应。其他相关信息如下表所示:
反应,与HCl不发生反应。其他相关信息如下表所示:
请回答下列问题:
(1)A中反应的离子方程式为_______ 。
(2)盛放 的仪器名称为
的仪器名称为_______ ,装置B中盛放的试剂是_______ (写名称)。
(3)加热装置C之前,先进行装置A中的反应,这样操作的目的是_______ 。
(4)装置C中除生成 外,同时还生成一种有毒气体,该反应的化学方程式为
外,同时还生成一种有毒气体,该反应的化学方程式为_______ 。
(5)该实验设计存在缺陷:一是无CO尾气处理装置;第二个缺陷的改进措施为_______ 。
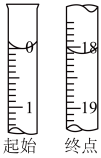
(6)利用如图装置测定所得 的纯度:将
的纯度:将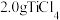 产品加入烧瓶,向安全漏斗中加入适量蒸馏水发生反应,待
产品加入烧瓶,向安全漏斗中加入适量蒸馏水发生反应,待 充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴指示剂,用
充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴指示剂,用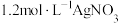 溶液滴定至终点,消耗滴定液25.00mL。
溶液滴定至终点,消耗滴定液25.00mL。
①在滴定管中装入 标准溶液的前一步应进行的操作为
标准溶液的前一步应进行的操作为_______ 。
②已知常温下, ,
,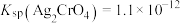 ,
,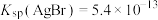 ,(
,( 呈砖红色,溴化银呈浅黄色),应选择的指示剂是
呈砖红色,溴化银呈浅黄色),应选择的指示剂是_______ 。
A.KCl B. C.KBr
C.KBr
③根据上述数据计算该产品的纯度为_______ %。
 是制备金属钛的重要中间体,某小组同学利用如下装置在实验室制备
是制备金属钛的重要中间体,某小组同学利用如下装置在实验室制备 (夹持装置略)。
(夹持装置略)。
资料表明:室温下,
 为无色液体,易挥发,高温时能与
为无色液体,易挥发,高温时能与 反应,与HCl不发生反应。其他相关信息如下表所示:
反应,与HCl不发生反应。其他相关信息如下表所示:| 物质 | 熔点/℃ | 沸点/℃ | 水溶性 |
 | -25 | 136.4 | 易水解成白色沉淀,能溶于有机溶剂 |
 | -23 | 76.8 | 难溶于水 |
(1)A中反应的离子方程式为
(2)盛放
 的仪器名称为
的仪器名称为(3)加热装置C之前,先进行装置A中的反应,这样操作的目的是
(4)装置C中除生成
 外,同时还生成一种有毒气体,该反应的化学方程式为
外,同时还生成一种有毒气体,该反应的化学方程式为(5)该实验设计存在缺陷:一是无CO尾气处理装置;第二个缺陷的改进措施为
(6)利用如图装置测定所得
 的纯度:将
的纯度:将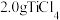 产品加入烧瓶,向安全漏斗中加入适量蒸馏水发生反应,待
产品加入烧瓶,向安全漏斗中加入适量蒸馏水发生反应,待 充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴指示剂,用
充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴指示剂,用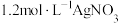 溶液滴定至终点,消耗滴定液25.00mL。
溶液滴定至终点,消耗滴定液25.00mL。
①在滴定管中装入
 标准溶液的前一步应进行的操作为
标准溶液的前一步应进行的操作为②已知常温下,
 ,
,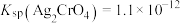 ,
,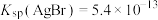 ,(
,( 呈砖红色,溴化银呈浅黄色),应选择的指示剂是
呈砖红色,溴化银呈浅黄色),应选择的指示剂是A.KCl B.
 C.KBr
C.KBr③根据上述数据计算该产品的纯度为
更新时间:2023-03-21 21:02:48
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】工业上常利用含硫废水生产 ,某小组同学用如下图装置(略去加热仪器等)模拟生产过程。
,某小组同学用如下图装置(略去加热仪器等)模拟生产过程。

已知:
i. 烧瓶 中发生反应如下:
中发生反应如下:
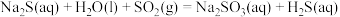
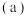
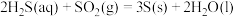


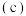
ii. 和
和 能被空气中的
能被空气中的 氧化。
氧化。
(1)与 离子互为等电子体的离子是
离子互为等电子体的离子是_______ , 离子的空间构型为
离子的空间构型为_______ 。
(2)为提高产品纯度,理论上应使烧瓶 中
中 和
和 恰好完全反应,则烧瓶
恰好完全反应,则烧瓶 中
中 和
和 物质的量之比为
物质的量之比为_______ 。
(3)模拟实验的操作步骤(说明:仪器中旋塞或玻璃塞的开或关不必叙述):_______ ,过滤洗涤、真空干燥,即得到产品 。
。
(4)反应终止后,烧瓶 中的溶液经蒸发浓缩冷却,过滤,洗涤,干燥,即得到粗产品(主要含有
中的溶液经蒸发浓缩冷却,过滤,洗涤,干燥,即得到粗产品(主要含有 和其他杂质)。某兴趣小组为测定该产品纯度,准确称取
和其他杂质)。某兴趣小组为测定该产品纯度,准确称取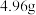 产品,用适量蒸馏水溶解,以淀粉作指示剂,用
产品,用适量蒸馏水溶解,以淀粉作指示剂,用 碘的标准溶液滴定。反应原理为:
碘的标准溶液滴定。反应原理为: ,滴定至终点时,滴定起始和终点的液面位置如图,则产品的纯度为
,滴定至终点时,滴定起始和终点的液面位置如图,则产品的纯度为_______ 。经仪器分析,该产品纯度为 ,分析该兴趣小组测定产品纯度偏差的原因(忽略人为误差)
,分析该兴趣小组测定产品纯度偏差的原因(忽略人为误差)_______ 。[已知: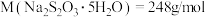 ]
]
 ,某小组同学用如下图装置(略去加热仪器等)模拟生产过程。
,某小组同学用如下图装置(略去加热仪器等)模拟生产过程。
已知:
i. 烧瓶
 中发生反应如下:
中发生反应如下: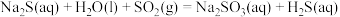
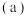
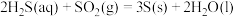


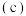
ii.
 和
和 能被空气中的
能被空气中的 氧化。
氧化。(1)与
 离子互为等电子体的离子是
离子互为等电子体的离子是 离子的空间构型为
离子的空间构型为(2)为提高产品纯度,理论上应使烧瓶
 中
中 和
和 恰好完全反应,则烧瓶
恰好完全反应,则烧瓶 中
中 和
和 物质的量之比为
物质的量之比为(3)模拟实验的操作步骤(说明:仪器中旋塞或玻璃塞的开或关不必叙述):
 。
。(4)反应终止后,烧瓶
 中的溶液经蒸发浓缩冷却,过滤,洗涤,干燥,即得到粗产品(主要含有
中的溶液经蒸发浓缩冷却,过滤,洗涤,干燥,即得到粗产品(主要含有 和其他杂质)。某兴趣小组为测定该产品纯度,准确称取
和其他杂质)。某兴趣小组为测定该产品纯度,准确称取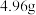 产品,用适量蒸馏水溶解,以淀粉作指示剂,用
产品,用适量蒸馏水溶解,以淀粉作指示剂,用 碘的标准溶液滴定。反应原理为:
碘的标准溶液滴定。反应原理为: ,滴定至终点时,滴定起始和终点的液面位置如图,则产品的纯度为
,滴定至终点时,滴定起始和终点的液面位置如图,则产品的纯度为 ,分析该兴趣小组测定产品纯度偏差的原因(忽略人为误差)
,分析该兴趣小组测定产品纯度偏差的原因(忽略人为误差)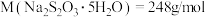 ]
]
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】实验室以 为原料,用两种方法制备高锰酸钾。已知:
为原料,用两种方法制备高锰酸钾。已知: 在浓强碱溶液中可稳定存在,溶液呈墨绿色,当溶液碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,溶液呈墨绿色,当溶液碱性减弱时易发生反应: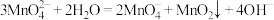
(1) 法。实验装置如图。
法。实验装置如图。

①反应一段时间后,用玻璃棒蘸取溶液滴在滤纸上,仅有紫红色而没有绿色痕迹,由此可知_______ 。
②停止通入 ,过滤除去
,过滤除去_______ (填化学式,下同),将滤液蒸发浓缩、冷却结晶,抽滤得到 粗品。若
粗品。若 通入过多,产品中可能混有的杂质是
通入过多,产品中可能混有的杂质是_______ 。
(2)电解法。实验装置如图。
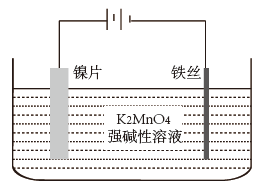
①阳极的电极反应式为_______ ,阴极产生的气体为_______ (填化学式)。
②与 法相比,电解法的主要优点是
法相比,电解法的主要优点是_______ (写一条)。
(3)高锰酸钾可用于测定软锰矿中 的含量,实验过程如下:
的含量,实验过程如下:
称取m g样品于锥形瓶中,加入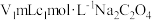 溶液,加稀
溶液,加稀 酸化,充分反应后,用
酸化,充分反应后,用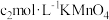 ,标准溶液滴定过量的
,标准溶液滴定过量的 ,消耗
,消耗 溶液
溶液 。
。
①滴定终点时溶液的颜色变化是_______ 。
②软锰矿中 的质量分数表达式为
的质量分数表达式为_______ 。
 为原料,用两种方法制备高锰酸钾。已知:
为原料,用两种方法制备高锰酸钾。已知: 在浓强碱溶液中可稳定存在,溶液呈墨绿色,当溶液碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,溶液呈墨绿色,当溶液碱性减弱时易发生反应: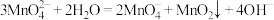
(1)
 法。实验装置如图。
法。实验装置如图。
①反应一段时间后,用玻璃棒蘸取溶液滴在滤纸上,仅有紫红色而没有绿色痕迹,由此可知
②停止通入
 ,过滤除去
,过滤除去 粗品。若
粗品。若 通入过多,产品中可能混有的杂质是
通入过多,产品中可能混有的杂质是(2)电解法。实验装置如图。

①阳极的电极反应式为
②与
 法相比,电解法的主要优点是
法相比,电解法的主要优点是(3)高锰酸钾可用于测定软锰矿中
 的含量,实验过程如下:
的含量,实验过程如下:称取m g样品于锥形瓶中,加入
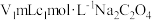 溶液,加稀
溶液,加稀 酸化,充分反应后,用
酸化,充分反应后,用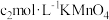 ,标准溶液滴定过量的
,标准溶液滴定过量的 ,消耗
,消耗 溶液
溶液 。
。①滴定终点时溶液的颜色变化是
②软锰矿中
 的质量分数表达式为
的质量分数表达式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】亚硝基硫酸(NOHSO4)常温下为颗粒状晶体,干燥时稳定,不溶于CCl4,在水溶液中难电离,制备原理为HNO3+SO2=NOHSO4.实验装置如图1。
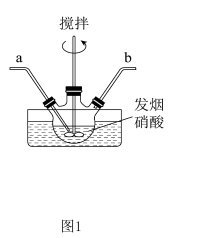
已知:I.制备NOHSO4过程中控制温度不高于59°C。
II.发烟硝酸为含硝酸90%~97.5%的液体。
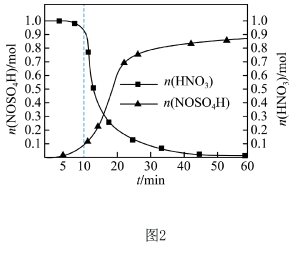
(1)NOHSO4的制备:反应过程中,NOHSO4和HNO3的物质的量随时间的变化如图2所示。生成NOHSO4的物质的量小于硝酸减少的物质的量,可能的原因是_____ 。
(2)结合图2,补充完整制取NOHSO4晶体的实验方案:b导管依次连接盛有_____ 和盛有_____ 的烧杯,烧杯内液面刚好接触倒扣的漏斗,经检查气密性良好,将净化后的SO2气体从装置a口通入盛有发烟硝酸的三颈烧瓶中,_____ ,将固体置于五氧化二磷干燥器中干燥(实验中须用的试剂和仪器:NaOH溶液、CCl4、P2O5的干燥管、玻璃砂芯漏斗)
(3)测定NOHSO4产品纯度的步骤:准确称取0.7000g产品于锥形瓶中,加入少量硫酸溶解,再加入0.1000mol·L-lKMnO4溶液40.00mL,充分反应。用0.2500mol·L-1Na2C2O4标准溶液滴定,消耗Na2C2O4标准溶液的体积为20.00mL。已知:2MnO +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O。
+16H+=2Mn2++10CO2↑+8H2O。
①NOHSO4与KMnO4反应有NO 、SO
、SO 和Mn2+生成,其离子方程式为
和Mn2+生成,其离子方程式为_____ 。
②计算NOHSO4产品的纯度(写出计算过程):_____ 。


已知:I.制备NOHSO4过程中控制温度不高于59°C。
II.发烟硝酸为含硝酸90%~97.5%的液体。
(1)NOHSO4的制备:反应过程中,NOHSO4和HNO3的物质的量随时间的变化如图2所示。生成NOHSO4的物质的量小于硝酸减少的物质的量,可能的原因是
(2)结合图2,补充完整制取NOHSO4晶体的实验方案:b导管依次连接盛有
(3)测定NOHSO4产品纯度的步骤:准确称取0.7000g产品于锥形瓶中,加入少量硫酸溶解,再加入0.1000mol·L-lKMnO4溶液40.00mL,充分反应。用0.2500mol·L-1Na2C2O4标准溶液滴定,消耗Na2C2O4标准溶液的体积为20.00mL。已知:2MnO
 +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O。
+16H+=2Mn2++10CO2↑+8H2O。①NOHSO4与KMnO4反应有NO
 、SO
、SO 和Mn2+生成,其离子方程式为
和Mn2+生成,其离子方程式为②计算NOHSO4产品的纯度(写出计算过程):
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。
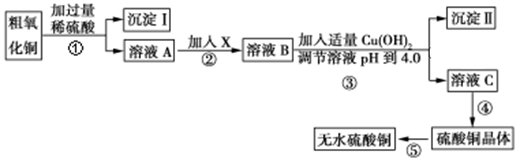
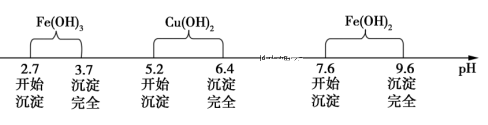
已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
请回答下列问题:
(1)已知25℃时,Cu (OH)2的Ksp=4.0×10-20调节溶液pH到4.0时,溶液C中Cu2+的最大浓度为____________ mol·L−1。
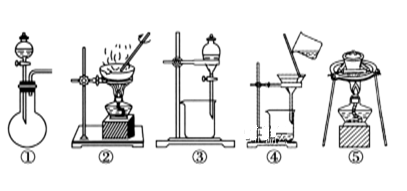
(2)在整个实验过程中,下列实验装置不可能用到的是________ (填序号)。
(3)溶液A中所含溶质为__________________________ ;物质X应选用________ (填序号)。
A.氯水 B.双氧水 C.铁粉 D.高锰酸钾
(4)从溶液C中制取硫酸铜晶体的实验操作为______________________________ 。
(5)用“间接碘量法”可以测定溶液A(不含能与I-发生反应的杂质)中Cu2+的浓度。过程如下:
第一步:移取10.00 mL溶液A于100 mL容量瓶中,加水定容至100 mL。
第二步:取稀释后溶液20.00 mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.050 00 mol·L-1的Na2S2O3标准溶液滴定,前后共测定三次,达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:
(已知:I2+2S2O32-===2I-+S4O62-)
①CuSO4溶液与KI反应的离子方程式为______________________________ 。
②滴定终点的现象是____________________________________________________________ 。
③溶液A中c(Cu2+)=________ mol·L-1。
(6)利用氧化铜和无水硫酸铜按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体且该液体有刺激性气味,则X气体是___________ (填序号),写出其在a处所发生的化学反应方程式___________________________________________ 。

A.H2
B.CH3CH2OH(气)
C.N2

已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:

请回答下列问题:
(1)已知25℃时,Cu (OH)2的Ksp=4.0×10-20调节溶液pH到4.0时,溶液C中Cu2+的最大浓度为
(2)在整个实验过程中,下列实验装置不可能用到的是

(3)溶液A中所含溶质为
A.氯水 B.双氧水 C.铁粉 D.高锰酸钾
(4)从溶液C中制取硫酸铜晶体的实验操作为
(5)用“间接碘量法”可以测定溶液A(不含能与I-发生反应的杂质)中Cu2+的浓度。过程如下:
第一步:移取10.00 mL溶液A于100 mL容量瓶中,加水定容至100 mL。
第二步:取稀释后溶液20.00 mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.050 00 mol·L-1的Na2S2O3标准溶液滴定,前后共测定三次,达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:
(已知:I2+2S2O32-===2I-+S4O62-)
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
②滴定终点的现象是
③溶液A中c(Cu2+)=
(6)利用氧化铜和无水硫酸铜按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体且该液体有刺激性气味,则X气体是

A.H2
B.CH3CH2OH(气)
C.N2
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】2019年诺贝尔化学奖授予对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法治金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
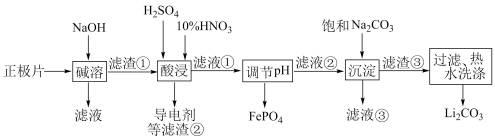
(1)“碱溶”时Al箔溶解过程中,氧化剂是______________ 。
(2)“酸浸”时生成NO的离子方程式是_________ 。(其他杂质不与HNO3反应)
(3)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率为90%,则加入饱Na2CO3 溶液中c(Na2CO3)=______ mol·L-1。[Ksp(Li2CO3)=1.6×10-3]
(4)磷酸亚铁锂电池总反应为:LiFePO4+6C Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,该电池的负极接电源的
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,该电池的负极接电源的_____ (填“正极”或“负极”);放电时,正极反应式为_______ 。
(5)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.20g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.020mol·L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是_________ 。
②磷酸亚铁锂电池中铁的含量为________ %。

(1)“碱溶”时Al箔溶解过程中,氧化剂是
(2)“酸浸”时生成NO的离子方程式是
(3)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率为90%,则加入饱Na2CO3 溶液中c(Na2CO3)=
(4)磷酸亚铁锂电池总反应为:LiFePO4+6C
 Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,该电池的负极接电源的
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,该电池的负极接电源的(5)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.20g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.020mol·L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是
②磷酸亚铁锂电池中铁的含量为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】铅蓄电池的拆解、回收和利用可以减少其对环境的污染,具有重要的可持续发展意义。利用废铅蓄电池的铅膏(主要成分为PbSO4、 PbO2), 还有少量Pb、Fe2O3、Al2O3)制备PbO的流程如下:

回答下列问题:
(1)步骤①将废铅膏研磨过筛的目的是___________ 。
(2)向废铅膏粉中加入NaOH溶液可将PbSO4转化为PbO, 反应的离子方程式是___________ 。
(3)溶液I中主要含有的阴离子有OH—、___________ 。
(4)加入CH3COOH溶液和H2O2溶液可将脱硫铅膏中的含铅物质转化为(CH3COO)2Pb。H2O2的电子式为___________ ,PbO2转化为(CH2COO)2Pb的化学方程式是___________ 。
(5)为使Pb2+完全沉淀并获得纯净的PbO, 需向溶液II中分两次加入NaOH溶液。第一次加入的目的是___________ ,过滤后,第二次加入NaOH溶液调节溶液的pH至少为___________ (已知:25°C,Ksp[Fe(OH)3]=4×10-38,Ksp[Pb(OH)2]= 1×10-16)。
(6)若废铅膏中铅元素的质量分数为69%,用上述流程对1 kg废铅膏进行处理,得到669 g PbO,则铅的回收率为___________ %。

回答下列问题:
(1)步骤①将废铅膏研磨过筛的目的是
(2)向废铅膏粉中加入NaOH溶液可将PbSO4转化为PbO, 反应的离子方程式是
(3)溶液I中主要含有的阴离子有OH—、
(4)加入CH3COOH溶液和H2O2溶液可将脱硫铅膏中的含铅物质转化为(CH3COO)2Pb。H2O2的电子式为
(5)为使Pb2+完全沉淀并获得纯净的PbO, 需向溶液II中分两次加入NaOH溶液。第一次加入的目的是
(6)若废铅膏中铅元素的质量分数为69%,用上述流程对1 kg废铅膏进行处理,得到669 g PbO,则铅的回收率为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】氯化亚锡和锡酸钠都可在印染行业用作媒染剂。校化学小组从电镀锡渣(主要成分为Sn、SnO,含有砷和难溶于酸碱的杂质)中制取二水合氯化亚锡和锡酸钠,工艺流程如图所示:
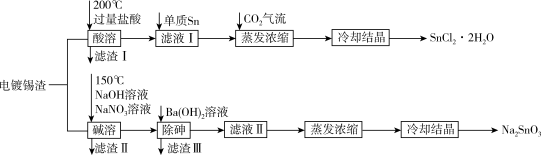
已知:
①Sn(II)具有还原性,可与Cl-形成[SnCl3]-
②As在碱溶时转化为Na3AsO4溶液
③20℃时,Ksp[Ba3(AsO4)2]=2.7×10-10
回答下列问题:
(1)Sn元素在周期表中的位置为_______ 。
(2)SnCl2溶液可用作电镀锡的电解液,阴极的电极反应式为_______ 。
(3)“酸溶”时SnO发生反应的离子方程式为_______ 。
(4)“碱溶”时的还原产物是空气的主要成分之一,写出Sn发生反应的化学方程式_______ 。
(5)“滤液I”中,需加入少量单质Sn,原因是_______ 。
(6)“除砷”时,若溶液中c(AsO )=2mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×10-3mol/L,则沉淀中的As元素占原As元素总量的
)=2mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×10-3mol/L,则沉淀中的As元素占原As元素总量的_______ 。
(7)蒸发浓缩“滤液II”前,可往体系中加入适量的NaOH溶液,目的是________ 。

已知:
①Sn(II)具有还原性,可与Cl-形成[SnCl3]-
②As在碱溶时转化为Na3AsO4溶液
③20℃时,Ksp[Ba3(AsO4)2]=2.7×10-10
回答下列问题:
(1)Sn元素在周期表中的位置为
(2)SnCl2溶液可用作电镀锡的电解液,阴极的电极反应式为
(3)“酸溶”时SnO发生反应的离子方程式为
(4)“碱溶”时的还原产物是空气的主要成分之一,写出Sn发生反应的化学方程式
(5)“滤液I”中,需加入少量单质Sn,原因是
(6)“除砷”时,若溶液中c(AsO
 )=2mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×10-3mol/L,则沉淀中的As元素占原As元素总量的
)=2mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×10-3mol/L,则沉淀中的As元素占原As元素总量的(7)蒸发浓缩“滤液II”前,可往体系中加入适量的NaOH溶液,目的是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】锡是大名鼎鼎的“五金”之一,早在远古时代人们便发现并加以利用。现从电镀锡渣(主要成分为Sn、SnO,含有砷和难溶于酸碱的杂质)中制取二水合氯化亚锡和锡酸钠,工艺流程如图所示:
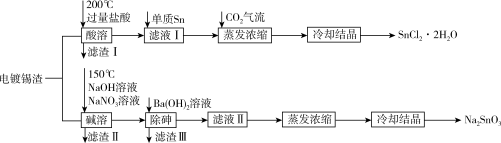
已知:①Sn(Ⅱ)具有还原性,可与Cl-形成[SnCl3]-;②As在碱溶时转化为Na3AsO4溶液;③20℃时,Ksp[Ba3(AsO4)2]=2.7×10-10
回答下列问题:
(1)在自然界中,锡很少以游离态存在但是远古时期人们已经会冶炼Sn,采用的方法是____ 。
(2)SnCl2溶液可用作电镀锡的电解液,阴极的电极反应式为_______ 。
(3)“酸溶”时SnO发生反应的离子方程式为____ 。在CO2气流中蒸发浓缩的目的是_____ 。
(4)“碱溶”时的还原产物是空气的主要成分之一,写出Sn在该步骤中发生反应的化学方程式_______ 。
(5)“滤液I”中,需加入少量单质Sn,原因除了防止Sn(Ⅱ)被氧化,还有_______ 。
(6)“除砷”时,若溶液中c( )=4mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×l0-3mol/L,则沉淀中的As元素占原As元素总量的百分数为
)=4mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×l0-3mol/L,则沉淀中的As元素占原As元素总量的百分数为_______ 。
(7)蒸发浓缩“滤液Ⅱ”前,可往体系中加入适量的NaOH溶液,目的是_______ 。

已知:①Sn(Ⅱ)具有还原性,可与Cl-形成[SnCl3]-;②As在碱溶时转化为Na3AsO4溶液;③20℃时,Ksp[Ba3(AsO4)2]=2.7×10-10
回答下列问题:
(1)在自然界中,锡很少以游离态存在但是远古时期人们已经会冶炼Sn,采用的方法是
(2)SnCl2溶液可用作电镀锡的电解液,阴极的电极反应式为
(3)“酸溶”时SnO发生反应的离子方程式为
(4)“碱溶”时的还原产物是空气的主要成分之一,写出Sn在该步骤中发生反应的化学方程式
(5)“滤液I”中,需加入少量单质Sn,原因除了防止Sn(Ⅱ)被氧化,还有
(6)“除砷”时,若溶液中c(
 )=4mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×l0-3mol/L,则沉淀中的As元素占原As元素总量的百分数为
)=4mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×l0-3mol/L,则沉淀中的As元素占原As元素总量的百分数为(7)蒸发浓缩“滤液Ⅱ”前,可往体系中加入适量的NaOH溶液,目的是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】氧化铋((Bi2O3)是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一,以下是一种用铋精矿(Bi2S3,含有FeS2、Cu2S、PbO2及不溶性杂质)制备Bi2O3的一种方法,其流程如图:

已知:①Fe(OH)3开始沉淀的pH值为2.7,沉淀完全时的pH值为3.7
②pH≥3时,BiCl3极易水解为白色的BiOCl沉淀。
请回答以下问题:
(1)铋原子价层电子排布式为:___________
(2)“加压浸取”过程中,Bi2S3转化为Bi2O3,FeS2转化为Fe2O3,而Cu2S溶解进入浸出液,且硫元素转化为SO ,请写出Cu2S在此过程中发生反应的离子方程式:
,请写出Cu2S在此过程中发生反应的离子方程式:___________ 。
(3)实验室灼烧(BiO)2CO3时用到的硅酸盐制品有___________ 、___________ 、酒精灯、玻璃棒。
(4)根据流程分析,盐酸羟胺(NH3OHCl)在流程中的作用是:①___________ ;②___________ 。
(5)流程中生成(BiO)2CO3的化学方程式为:___________ 。
(6)实际生产过程中温度保持在50℃左右(BiO)2CO3产率较高,请分析温度过低或过高时(BiO)2CO3产率较低的原因___________ 。

已知:①Fe(OH)3开始沉淀的pH值为2.7,沉淀完全时的pH值为3.7
②pH≥3时,BiCl3极易水解为白色的BiOCl沉淀。
请回答以下问题:
(1)铋原子价层电子排布式为:
(2)“加压浸取”过程中,Bi2S3转化为Bi2O3,FeS2转化为Fe2O3,而Cu2S溶解进入浸出液,且硫元素转化为SO
 ,请写出Cu2S在此过程中发生反应的离子方程式:
,请写出Cu2S在此过程中发生反应的离子方程式:(3)实验室灼烧(BiO)2CO3时用到的硅酸盐制品有
(4)根据流程分析,盐酸羟胺(NH3OHCl)在流程中的作用是:①
(5)流程中生成(BiO)2CO3的化学方程式为:
(6)实际生产过程中温度保持在50℃左右(BiO)2CO3产率较高,请分析温度过低或过高时(BiO)2CO3产率较低的原因
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】氯化亚铜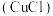 是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸;可溶于氯离子浓度较大的体系,形成
是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸;可溶于氯离子浓度较大的体系,形成 。在潮湿空气中迅速被氧化,见光则分解。右下图是实验室仿 工业制备氯化亚铜的流程进行的实验装置图。
。在潮湿空气中迅速被氧化,见光则分解。右下图是实验室仿 工业制备氯化亚铜的流程进行的实验装置图。
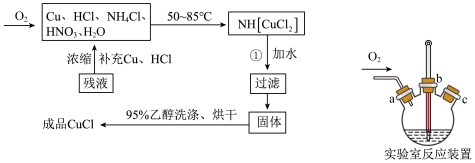
实验药品:铜丝 、氯化铵
、氯化铵 、65%硝酸
、65%硝酸 、20%盐酸
、20%盐酸 、水。
、水。
(1)质量分数为20%的盐酸密度为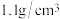 ,物质的量浓度为
,物质的量浓度为______ ;用浓盐酸配制20%盐酸需要的玻璃仪器有:______ 、烧杯、玻璃棒、胶头滴管。
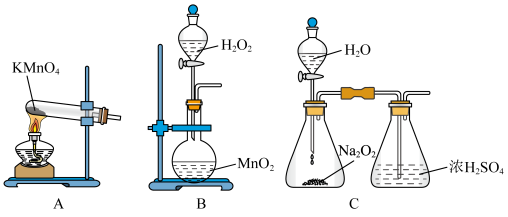
(2)实验室制备 过程如下:
过程如下:
①检查装置气密性,向三颈瓶中加入铜丝、氢化铵、硝酸、盐酸,关闭 。实验开始时,温度计显示反应液温度低于室温,主要原因是
。实验开始时,温度计显示反应液温度低于室温,主要原因是______ ;
②加热至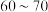 ℃,铜丝表面产生无色气泡,烧瓶上方气体颜色逐渐由无色为红棕色,气囊鼓起。打开
℃,铜丝表面产生无色气泡,烧瓶上方气体颜色逐渐由无色为红棕色,气囊鼓起。打开 ,通入氧气一段时间,将气囊变瘪,红棕色消失后关闭
,通入氧气一段时间,将气囊变瘪,红棕色消失后关闭 ,冷却至室温,制得
,冷却至室温,制得 。通入氧气的目的为
。通入氧气的目的为______ ;
三颈瓶中生成 的总的离子方程为
的总的离子方程为______ ;
将液体转移至烧杯中用足量蒸馏水稀释,产生白色沉淀,过滤得氧化亚铜粗品和滤液。
③粗品用95%乙醇洗涤、烘干得氧化亚铜。
(3)便于观察和控制产生 的速率,制备氧气的装置最好运用
的速率,制备氧气的装置最好运用______ (填字母)。
(4)下列说法不正确的是______
A.步骤Ⅰ中 可以省去,因为已经加入了
可以省去,因为已经加入了
B.步骤Ⅱ用去氧水稀释,目的是使 转化为
转化为 ,同时防止
,同时防止 被氧化
被氧化
C.当三颈烧瓶上方不出现红棕色气体时,可停止通入氧气
D.流程中可循环利用的物质只有氯化铵
(5)步骤Ⅲ用95%乙醇代替蒸馏水洗涤的主要目的是______ 、______ (答出两条)。
(6)氯化亚铜的定量分析:
①称取样品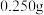 和
和 过量的
过量的 溶液于
溶液于 锥形瓶中,充分溶解;
锥形瓶中,充分溶解;
②用 硫酸[Ce(SO4)2]标准溶液测定。已知:
硫酸[Ce(SO4)2]标准溶液测定。已知:
已知:CuCl+FeCl3=CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+
三次平衡实验结果如下表(平衡实验结果相差不能超过1%):
则样品中 的纯度为
的纯度为______ (结果保留3位有效数字)。
误差分析:下列操作会使滴定结果偏高的是______ 。
A.锥形瓶中有少量蒸馏水 B.滴定终点读数时仰视滴定管刻度线
C.所取 溶液体积偏大 D.滴定前滴定管尖端有气泡,滴定后气泡消失
溶液体积偏大 D.滴定前滴定管尖端有气泡,滴定后气泡消失
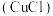 是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸;可溶于氯离子浓度较大的体系,形成
是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸;可溶于氯离子浓度较大的体系,形成 。在潮湿空气中迅速被氧化,见光则分解。右下图是实验室仿 工业制备氯化亚铜的流程进行的实验装置图。
。在潮湿空气中迅速被氧化,见光则分解。右下图是实验室仿 工业制备氯化亚铜的流程进行的实验装置图。
实验药品:铜丝
 、氯化铵
、氯化铵 、65%硝酸
、65%硝酸 、20%盐酸
、20%盐酸 、水。
、水。(1)质量分数为20%的盐酸密度为
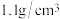 ,物质的量浓度为
,物质的量浓度为(2)实验室制备
 过程如下:
过程如下:①检查装置气密性,向三颈瓶中加入铜丝、氢化铵、硝酸、盐酸,关闭
 。实验开始时,温度计显示反应液温度低于室温,主要原因是
。实验开始时,温度计显示反应液温度低于室温,主要原因是②加热至
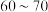 ℃,铜丝表面产生无色气泡,烧瓶上方气体颜色逐渐由无色为红棕色,气囊鼓起。打开
℃,铜丝表面产生无色气泡,烧瓶上方气体颜色逐渐由无色为红棕色,气囊鼓起。打开 ,通入氧气一段时间,将气囊变瘪,红棕色消失后关闭
,通入氧气一段时间,将气囊变瘪,红棕色消失后关闭 ,冷却至室温,制得
,冷却至室温,制得 。通入氧气的目的为
。通入氧气的目的为三颈瓶中生成
 的总的离子方程为
的总的离子方程为将液体转移至烧杯中用足量蒸馏水稀释,产生白色沉淀,过滤得氧化亚铜粗品和滤液。
③粗品用95%乙醇洗涤、烘干得氧化亚铜。
(3)便于观察和控制产生
 的速率,制备氧气的装置最好运用
的速率,制备氧气的装置最好运用
(4)下列说法不正确的是
A.步骤Ⅰ中
 可以省去,因为已经加入了
可以省去,因为已经加入了
B.步骤Ⅱ用去氧水稀释,目的是使
 转化为
转化为 ,同时防止
,同时防止 被氧化
被氧化C.当三颈烧瓶上方不出现红棕色气体时,可停止通入氧气
D.流程中可循环利用的物质只有氯化铵
(5)步骤Ⅲ用95%乙醇代替蒸馏水洗涤的主要目的是
(6)氯化亚铜的定量分析:
①称取样品
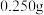 和
和 过量的
过量的 溶液于
溶液于 锥形瓶中,充分溶解;
锥形瓶中,充分溶解;②用
 硫酸[Ce(SO4)2]标准溶液测定。已知:
硫酸[Ce(SO4)2]标准溶液测定。已知:已知:CuCl+FeCl3=CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+
三次平衡实验结果如下表(平衡实验结果相差不能超过1%):
| 平衡实验次数 | 1 | 2 | 3 |
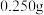 样品消耗硫酸锑标准溶液的体积 样品消耗硫酸锑标准溶液的体积 | 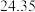 | 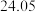 2 2 | 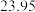 |
则样品中
 的纯度为
的纯度为误差分析:下列操作会使滴定结果偏高的是
A.锥形瓶中有少量蒸馏水 B.滴定终点读数时仰视滴定管刻度线
C.所取
 溶液体积偏大 D.滴定前滴定管尖端有气泡,滴定后气泡消失
溶液体积偏大 D.滴定前滴定管尖端有气泡,滴定后气泡消失
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】纳米级 广泛用于化妆品和功能纤维领域。实验室利用普通
广泛用于化妆品和功能纤维领域。实验室利用普通 制备纳米
制备纳米 并测定其组成(夹持装置略去)。
并测定其组成(夹持装置略去)。
已知:① 可发生反应
可发生反应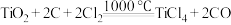 。
。
② 易挥发,沸点136.4℃,极易与水反应,与
易挥发,沸点136.4℃,极易与水反应,与 气体不反应。
气体不反应。
③ 在盐酸中的存在形式为
在盐酸中的存在形式为 ,可吸收
,可吸收 生成黑色颗粒
生成黑色颗粒 。
。
Ⅰ.制备
 时进行操作:(i)组装仪器,检验装置气密性;(ii)添加药品;(iii)
时进行操作:(i)组装仪器,检验装置气密性;(ii)添加药品;(iii)_____ ,_____ ,接通冷凝装置,开始实验。
(2)F中试剂为_______ ,发生反应的离子方程式为_______ 。
(3)该实验设计存在的缺陷是_______ 。
Ⅱ.制备
以 为载体,用
为载体,用 和水蒸气反应得到
和水蒸气反应得到 ,再控制温度生成纳米
,再控制温度生成纳米 。
。
Ⅲ.测定纳米 的组成
的组成
步骤i:取纳米 样品4.54g,用足量稀硫酸溶解得到
样品4.54g,用足量稀硫酸溶解得到 溶液,再用Al将
溶液,再用Al将 全部还原为
全部还原为 ,过滤、洗涤,将滤液和洗涤液注入500mL容量瓶,定容得到待测液。
,过滤、洗涤,将滤液和洗涤液注入500mL容量瓶,定容得到待测液。
步骤ii:取待测液25.00mL,用如图装置进行电位滴定。用 标准
标准 溶液滴定,将
溶液滴定,将 氧化为
氧化为 ,指示电极的电位随
,指示电极的电位随 浓度变化而变化,通过测量指示电极的电位变化确定滴定终点。
浓度变化而变化,通过测量指示电极的电位变化确定滴定终点。 表示指示电极的电位,
表示指示电极的电位, 表示标准溶液的体积,
表示标准溶液的体积, 表示指示电极的电位改变量,
表示指示电极的电位改变量,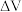 表示标准溶液体积的增量,下列所示滴定终点附近的图像正确的有
表示标准溶液体积的增量,下列所示滴定终点附近的图像正确的有_______ (填字母)。_______ (填化学式),若测定过程中加入Al不足,则导致
_______ (填“偏大”“偏小”或“无影响”)。
 广泛用于化妆品和功能纤维领域。实验室利用普通
广泛用于化妆品和功能纤维领域。实验室利用普通 制备纳米
制备纳米 并测定其组成(夹持装置略去)。
并测定其组成(夹持装置略去)。已知:①
 可发生反应
可发生反应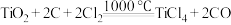 。
。②
 易挥发,沸点136.4℃,极易与水反应,与
易挥发,沸点136.4℃,极易与水反应,与 气体不反应。
气体不反应。③
 在盐酸中的存在形式为
在盐酸中的存在形式为 ,可吸收
,可吸收 生成黑色颗粒
生成黑色颗粒 。
。Ⅰ.制备


 时进行操作:(i)组装仪器,检验装置气密性;(ii)添加药品;(iii)
时进行操作:(i)组装仪器,检验装置气密性;(ii)添加药品;(iii)(2)F中试剂为
(3)该实验设计存在的缺陷是
Ⅱ.制备

以
 为载体,用
为载体,用 和水蒸气反应得到
和水蒸气反应得到 ,再控制温度生成纳米
,再控制温度生成纳米 。
。Ⅲ.测定纳米
 的组成
的组成步骤i:取纳米
 样品4.54g,用足量稀硫酸溶解得到
样品4.54g,用足量稀硫酸溶解得到 溶液,再用Al将
溶液,再用Al将 全部还原为
全部还原为 ,过滤、洗涤,将滤液和洗涤液注入500mL容量瓶,定容得到待测液。
,过滤、洗涤,将滤液和洗涤液注入500mL容量瓶,定容得到待测液。步骤ii:取待测液25.00mL,用如图装置进行电位滴定。用
 标准
标准 溶液滴定,将
溶液滴定,将 氧化为
氧化为 ,指示电极的电位随
,指示电极的电位随 浓度变化而变化,通过测量指示电极的电位变化确定滴定终点。
浓度变化而变化,通过测量指示电极的电位变化确定滴定终点。
 表示指示电极的电位,
表示指示电极的电位, 表示标准溶液的体积,
表示标准溶液的体积, 表示指示电极的电位改变量,
表示指示电极的电位改变量,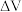 表示标准溶液体积的增量,下列所示滴定终点附近的图像正确的有
表示标准溶液体积的增量,下列所示滴定终点附近的图像正确的有

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】高技术领域常使用高纯试剂。纯磷酸(熔点为 ,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于
,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于 易形成
易形成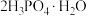 (熔点为
(熔点为 ),高于
),高于 则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):

回答下列问题:
(1)A的名称是___________ 。B的进水口为___________ (填“a”或“b”)。
(2) 的作用是
的作用是___________ 。
(3)空气流入毛细管的主要作用是防止___________ ,还具有搅拌和加速水逸出的作用。
(4)升高温度能提高除水速度,实验选用水浴加热的目的是___________ 。
(5)磷酸易形成过饱和溶液,难以结晶,可向过饱和溶液中加入___________ 促进其结晶。
(6)过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为___________ (填标号)。
A. B.
B. C.
C.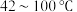
(7)磷酸中少量的水极难除去的原因是___________ 。
 ,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于
,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于 易形成
易形成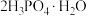 (熔点为
(熔点为 ),高于
),高于 则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
回答下列问题:
(1)A的名称是
(2)
 的作用是
的作用是(3)空气流入毛细管的主要作用是防止
(4)升高温度能提高除水速度,实验选用水浴加热的目的是
(5)磷酸易形成过饱和溶液,难以结晶,可向过饱和溶液中加入
(6)过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为
A.
 B.
B. C.
C.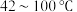
(7)磷酸中少量的水极难除去的原因是
您最近一年使用:0次



