氯化亚锡和锡酸钠都可在印染行业用作媒染剂。校化学小组从电镀锡渣(主要成分为Sn、SnO,含有砷和难溶于酸碱的杂质)中制取二水合氯化亚锡和锡酸钠,工艺流程如图所示:
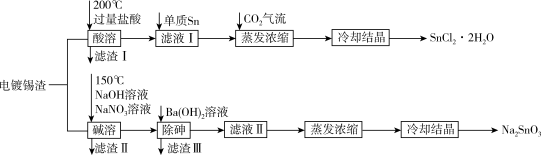
已知:
①Sn(II)具有还原性,可与Cl-形成[SnCl3]-
②As在碱溶时转化为Na3AsO4溶液
③20℃时,Ksp[Ba3(AsO4)2]=2.7×10-10
回答下列问题:
(1)Sn元素在周期表中的位置为_______ 。
(2)SnCl2溶液可用作电镀锡的电解液,阴极的电极反应式为_______ 。
(3)“酸溶”时SnO发生反应的离子方程式为_______ 。
(4)“碱溶”时的还原产物是空气的主要成分之一,写出Sn发生反应的化学方程式_______ 。
(5)“滤液I”中,需加入少量单质Sn,原因是_______ 。
(6)“除砷”时,若溶液中c(AsO )=2mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×10-3mol/L,则沉淀中的As元素占原As元素总量的
)=2mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×10-3mol/L,则沉淀中的As元素占原As元素总量的_______ 。
(7)蒸发浓缩“滤液II”前,可往体系中加入适量的NaOH溶液,目的是________ 。

已知:
①Sn(II)具有还原性,可与Cl-形成[SnCl3]-
②As在碱溶时转化为Na3AsO4溶液
③20℃时,Ksp[Ba3(AsO4)2]=2.7×10-10
回答下列问题:
(1)Sn元素在周期表中的位置为
(2)SnCl2溶液可用作电镀锡的电解液,阴极的电极反应式为
(3)“酸溶”时SnO发生反应的离子方程式为
(4)“碱溶”时的还原产物是空气的主要成分之一,写出Sn发生反应的化学方程式
(5)“滤液I”中,需加入少量单质Sn,原因是
(6)“除砷”时,若溶液中c(AsO
 )=2mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×10-3mol/L,则沉淀中的As元素占原As元素总量的
)=2mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×10-3mol/L,则沉淀中的As元素占原As元素总量的(7)蒸发浓缩“滤液II”前,可往体系中加入适量的NaOH溶液,目的是
更新时间:2022-04-22 09:49:55
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】铈是地壳中丰度最高的稀土元素,可用作催化剂、合金添加剂,也可用于医药、制革、玻璃、纺织等工业。氟碳铈矿的主要化学成分为CeFCO3,它是提取铈的重要矿物原料。氟碳铈矿的冶炼处理工艺已经发展到十数种,其中一种提取铈的工艺流程如下图所示。
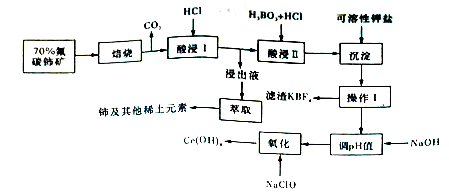
已知:焙烧后烧渣中含+4价的铈及十3 价的其他稀土氟化物和氧化物。
请回答下列问题:
(1)CeFCO3 中Ce元素的化合价为______ 。
(2)“焙烧”前将矿石粉碎成细颗粒的目的是___________________________________________ 。
(3)“酸浸I”步骤中CeO2 转化为Ce3+,且产生黄绿色气体,该过程的离子方程式为___________________ 。
(4)“酸浸1”步骤中CeF4 转化为难溶物Ce(BF4)3,加入可溶性钾盐的目的是__________________ 。
(5)“操作I”后,向溶液中加入NaOH溶液,调节溶液pH 可获得Ce(OH)3沉淀,利用pH 试纸测定溶液pH值的实验操作是__________________________________ 。当溶液中离子浓度小于1×10-6 mol/L 时视为沉淀完全,常温下,加入NaOH 调节溶液的pH应大于____ [已知Ce(OH)3 的Ksp=8.0×10-21,1g2=0.3]。
(6)写出“氧化”步骤的化学方程式:_________________________________________ 。

已知:焙烧后烧渣中含+4价的铈及十3 价的其他稀土氟化物和氧化物。
请回答下列问题:
(1)CeFCO3 中Ce元素的化合价为
(2)“焙烧”前将矿石粉碎成细颗粒的目的是
(3)“酸浸I”步骤中CeO2 转化为Ce3+,且产生黄绿色气体,该过程的离子方程式为
(4)“酸浸1”步骤中CeF4 转化为难溶物Ce(BF4)3,加入可溶性钾盐的目的是
(5)“操作I”后,向溶液中加入NaOH溶液,调节溶液pH 可获得Ce(OH)3沉淀,利用pH 试纸测定溶液pH值的实验操作是
(6)写出“氧化”步骤的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。

请回答下列问题:
(1)硫酸亚铁溶液加H2SO4酸化的主要目的是____________________________ ,滤渣A的主要成分是__________________ 。
(2)下列物质中最适合的氧化剂B是________________ ;反应的离子方程式______________ 。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲、乙的名称分别是:甲______________ ,乙___________________ 。
(4)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,所加试剂为_____________ (写名称),能否用酸性的KMnO4溶液?_____ (如果能,下问忽略),理由是:_______________________ 。(可用文字或方程式说明)
(5)检验硫酸铁铵中NH4+的方法是_____________________________________ 。
(6)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入0.05 mol Ba (NO3)2溶液,恰好完全反应。则该硫酸铁铵的化学式为______________________ 。

请回答下列问题:
(1)硫酸亚铁溶液加H2SO4酸化的主要目的是
(2)下列物质中最适合的氧化剂B是
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲、乙的名称分别是:甲
(4)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,所加试剂为
(5)检验硫酸铁铵中NH4+的方法是
(6)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入0.05 mol Ba (NO3)2溶液,恰好完全反应。则该硫酸铁铵的化学式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】一种从分银渣(含CuO、 、
、 、
、 、
、 、Ag、
、Ag、 等)回收金属资源的工艺流程如下:
等)回收金属资源的工艺流程如下:
Ⅰ.CuCl难溶于水,但溶于浓盐酸。
Ⅱ.“富锑铋铜液”中含 (铋离子)、
(铋离子)、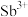 (锑离子)、
(锑离子)、 、
、 。
。
Ⅲ.该工艺条件下,有关金属离子沉淀时的相关pH见下表:
回答下列问题:
(1)写出分银渣中的Ag与盐酸、溶解氧反应的离子方程式:___________________ 。
(2)“酸浸”时,盐酸浓度对锑、铋、铜浸出率的影响如图1所示,温度对锑、铋、铜浸出率的影响如图2所示。______ ;浸出时温度以80℃为宜,其原因是_____________________ 。
(3)①已知“滤渣2”的主要成分是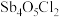 ,则“一次水解”时主要发生反应的化学方程式为
,则“一次水解”时主要发生反应的化学方程式为________ 。
②已知“滤渣3”的主要成分是BiOCl和 ,则“二次水解”时调节pH的范围应该是
,则“二次水解”时调节pH的范围应该是______ 。
(4)“滤渣1”中的AgCl可用硫酸-硫脲(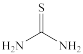 )浸出,生成配合物
)浸出,生成配合物 ,写出该反应的化学方程式:
,写出该反应的化学方程式:________________ ;该配合物中不存在__________ (填标号)。
A.离子键 B.极性共价键 C.配位键 D.范德华力 E.非极性共价键
(5)写出一种从“富铜溶液”中回收金属资源的方法:_________________ 。
(6)尖晶石属于立方晶系,其晶胞可视为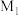 、
、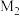 两种结构交替无隙并置而成(如图所示),其中
两种结构交替无隙并置而成(如图所示),其中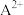 可以为
可以为 、
、 、
、 、
、 等,
等, 可以为
可以为 、
、 、
、 等。已知尖晶石型
等。已知尖晶石型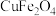 的晶胞参数为842pm,则该晶体的密度为
的晶胞参数为842pm,则该晶体的密度为________  。(列出计算式,阿伏加德罗常数的值为
。(列出计算式,阿伏加德罗常数的值为 )
)
 、
、 、
、 、
、 、Ag、
、Ag、 等)回收金属资源的工艺流程如下:
等)回收金属资源的工艺流程如下: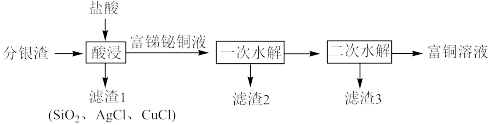
Ⅰ.CuCl难溶于水,但溶于浓盐酸。
Ⅱ.“富锑铋铜液”中含
 (铋离子)、
(铋离子)、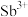 (锑离子)、
(锑离子)、 、
、 。
。Ⅲ.该工艺条件下,有关金属离子沉淀时的相关pH见下表:
金属离子 |
|
|
|
|
开始沉淀时( | 0.5 | 1.5 | 4.7 | 1.5 |
完全沉淀时( | 1.4 | 2.5 | 6.7 | 3.2 |
(1)写出分银渣中的Ag与盐酸、溶解氧反应的离子方程式:
(2)“酸浸”时,盐酸浓度对锑、铋、铜浸出率的影响如图1所示,温度对锑、铋、铜浸出率的影响如图2所示。
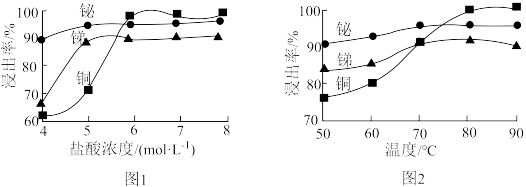
(3)①已知“滤渣2”的主要成分是
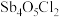 ,则“一次水解”时主要发生反应的化学方程式为
,则“一次水解”时主要发生反应的化学方程式为②已知“滤渣3”的主要成分是BiOCl和
 ,则“二次水解”时调节pH的范围应该是
,则“二次水解”时调节pH的范围应该是(4)“滤渣1”中的AgCl可用硫酸-硫脲(
 )浸出,生成配合物
)浸出,生成配合物 ,写出该反应的化学方程式:
,写出该反应的化学方程式:A.离子键 B.极性共价键 C.配位键 D.范德华力 E.非极性共价键
(5)写出一种从“富铜溶液”中回收金属资源的方法:
(6)尖晶石属于立方晶系,其晶胞可视为
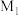 、
、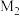 两种结构交替无隙并置而成(如图所示),其中
两种结构交替无隙并置而成(如图所示),其中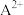 可以为
可以为 、
、 、
、 、
、 等,
等, 可以为
可以为 、
、 、
、 等。已知尖晶石型
等。已知尖晶石型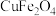 的晶胞参数为842pm,则该晶体的密度为
的晶胞参数为842pm,则该晶体的密度为 。(列出计算式,阿伏加德罗常数的值为
。(列出计算式,阿伏加德罗常数的值为 )
)
您最近一年使用:0次
【推荐1】铁的化合物在生产生活和科学实验中应用广泛。请按要求回答下列问题:
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。已知:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH2=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.0kJ/mol
①反应Fe2O3(s)+3CH4(g) 2Fe(s)+3CO(g)+6H2(g)的ΔH=
2Fe(s)+3CO(g)+6H2(g)的ΔH=_____________ 。
②若该反应在5 L的密闭容器中进行5 min 后达到平衡,测得体系中固体质量减少0.96 g,则该段时间内CO的平均反应速率为________________ 。
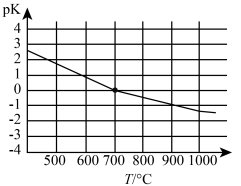
③该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如图。试用平衡移动原理解释该曲线的变化规律:______________ 。若700°C时测得平衡时,H2浓度为1.0 mol·L-1,则CH4的平衡转化率为____________ 。
(2)常温下FeCO3的溶度积常数为Ksp(FeCO3),H2CO3的一级电离常数和二级电离常数分别为Ka1和Ka2。已知菱铁矿的主要成分是FeCO3,实验室中可以通过FeSO4与足量NaHCO3溶液混合制得FeCO3,常温下该反应的平衡常数K=__________ [用含有Ksp(FeCO3)、Ka1和Ka2的代数式表示]。
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备,请写出阳极的电极反应式:__________________ 。
(4)铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物立方晶胞结构如图所示。
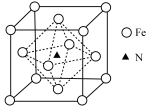
①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置是____________ 。
②该化合物晶胞中距离最近的铁原子和氮原子的距离为a pm,阿伏加德罗常数的值为NA,则该晶胞的密度为___________ g·cm-3(列式计算即可)。
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。已知:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH2=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.0kJ/mol
①反应Fe2O3(s)+3CH4(g)
 2Fe(s)+3CO(g)+6H2(g)的ΔH=
2Fe(s)+3CO(g)+6H2(g)的ΔH=②若该反应在5 L的密闭容器中进行5 min 后达到平衡,测得体系中固体质量减少0.96 g,则该段时间内CO的平均反应速率为
③该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如图。试用平衡移动原理解释该曲线的变化规律:

(2)常温下FeCO3的溶度积常数为Ksp(FeCO3),H2CO3的一级电离常数和二级电离常数分别为Ka1和Ka2。已知菱铁矿的主要成分是FeCO3,实验室中可以通过FeSO4与足量NaHCO3溶液混合制得FeCO3,常温下该反应的平衡常数K=
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备,请写出阳极的电极反应式:
(4)铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物立方晶胞结构如图所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置是
②该化合物晶胞中距离最近的铁原子和氮原子的距离为a pm,阿伏加德罗常数的值为NA,则该晶胞的密度为
您最近一年使用:0次
【推荐2】利用 、
、 用为原料合成
用为原料合成 可有效降低空气中二氧化碳的含量,其中涉及的主要反应如下:
可有效降低空气中二氧化碳的含量,其中涉及的主要反应如下:
Ⅰ.
Ⅱ.
回答下列问题:
(1)利用 计算
计算 时,还需要利用
时,还需要利用___________ 反应的 。
。
(2)使用新型催化剂,将 和
和 在1L密闭容器中进行反应,
在1L密闭容器中进行反应, 的平衡转化率和甲醇的选择率随温度的变化趋势如图所示。(甲醇的选择率:转化的
的平衡转化率和甲醇的选择率随温度的变化趋势如图所示。(甲醇的选择率:转化的 中生成甲醇的物质的量分数)
中生成甲醇的物质的量分数)
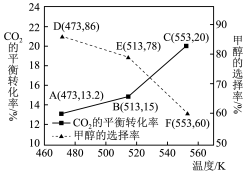
①达到平衡时,反应体系内甲醇的产量最高的是___________ (填“D”、“E”或“F”)。
②553K时,反应Ⅰ的平衡常数
___________ 。
③随着温度的升高, 的平衡转化率增加,甲醇的选择率降低,其原因为
的平衡转化率增加,甲醇的选择率降低,其原因为___________ 。
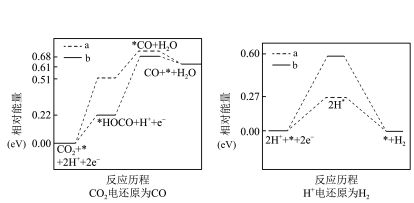
(3)研究表明,在电解质溶液中, 可以被电化学还原。
可以被电化学还原。
① 在碱性介质中电还原为甲醇的电极反应式为
在碱性介质中电还原为甲醇的电极反应式为___________ 。
②两种不同催化剂a、b上, 电还原为
电还原为 的反应进程中(
的反应进程中( 电还原为
电还原为 同时发生)相对能量变化如下图。由此判断,更易催化
同时发生)相对能量变化如下图。由此判断,更易催化 电还原为
电还原为 的催化剂是
的催化剂是___________ (填“a”或“b”),理由是___________ 。
 、
、 用为原料合成
用为原料合成 可有效降低空气中二氧化碳的含量,其中涉及的主要反应如下:
可有效降低空气中二氧化碳的含量,其中涉及的主要反应如下:Ⅰ.

Ⅱ.

回答下列问题:
(1)利用
 计算
计算 时,还需要利用
时,还需要利用 。
。(2)使用新型催化剂,将
 和
和 在1L密闭容器中进行反应,
在1L密闭容器中进行反应, 的平衡转化率和甲醇的选择率随温度的变化趋势如图所示。(甲醇的选择率:转化的
的平衡转化率和甲醇的选择率随温度的变化趋势如图所示。(甲醇的选择率:转化的 中生成甲醇的物质的量分数)
中生成甲醇的物质的量分数)
①达到平衡时,反应体系内甲醇的产量最高的是
②553K时,反应Ⅰ的平衡常数

③随着温度的升高,
 的平衡转化率增加,甲醇的选择率降低,其原因为
的平衡转化率增加,甲醇的选择率降低,其原因为(3)研究表明,在电解质溶液中,
 可以被电化学还原。
可以被电化学还原。①
 在碱性介质中电还原为甲醇的电极反应式为
在碱性介质中电还原为甲醇的电极反应式为②两种不同催化剂a、b上,
 电还原为
电还原为 的反应进程中(
的反应进程中( 电还原为
电还原为 同时发生)相对能量变化如下图。由此判断,更易催化
同时发生)相对能量变化如下图。由此判断,更易催化 电还原为
电还原为 的催化剂是
的催化剂是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】氟化镨(PrF3)常用于电弧碳棒添加剂。利用方镨矿精矿(Pr2S3,难溶于水)制备氟化镨的流程如下:
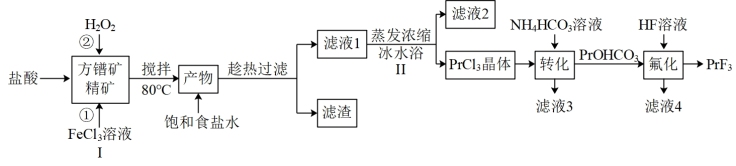
已知:① ;
;
② 、
、 以氢氧化物的形式完全沉淀时,溶液的pH分别为3.2、10.1。
以氢氧化物的形式完全沉淀时,溶液的pH分别为3.2、10.1。
(1)步骤I中加入 溶液后生成
溶液后生成 和S,该反应中氧化剂与还原剂的物质的量之比为
和S,该反应中氧化剂与还原剂的物质的量之比为_______ ,加入盐酸的另一个目的是控制pH在0.5~1.0,原因是_______ 。
(2)请用离子方程式解释反应②中加入 的作用:
的作用:_______ 。
(3)请用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因:_______ 。
(4)完成 溶液转化为
溶液转化为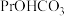 沉淀的离子方程式:□
沉淀的离子方程式:□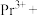 □
□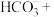 □
□ □
□ □
□ 。
。_______
(5)滤液3可用作_______ 。
(6)镨蓄电池具有稳定性高等有点,充电后两个电极上沉积的 分别转化为
分别转化为 和Pr,充电时阴极的电极反应式为
和Pr,充电时阴极的电极反应式为_______ 。

已知:①
 ;
;②
 、
、 以氢氧化物的形式完全沉淀时,溶液的pH分别为3.2、10.1。
以氢氧化物的形式完全沉淀时,溶液的pH分别为3.2、10.1。(1)步骤I中加入
 溶液后生成
溶液后生成 和S,该反应中氧化剂与还原剂的物质的量之比为
和S,该反应中氧化剂与还原剂的物质的量之比为(2)请用离子方程式解释反应②中加入
 的作用:
的作用:(3)请用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因:
(4)完成
 溶液转化为
溶液转化为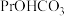 沉淀的离子方程式:□
沉淀的离子方程式:□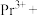 □
□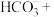 □
□ □
□ □
□ 。
。(5)滤液3可用作
(6)镨蓄电池具有稳定性高等有点,充电后两个电极上沉积的
 分别转化为
分别转化为 和Pr,充电时阴极的电极反应式为
和Pr,充电时阴极的电极反应式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】回答以下关于元素及其化合物的问题。
(1)Na原子核外有________ 种不同能量的电子,其离子最外层电子的轨道表示式________ 。
(2)相同压强下,部分元素氟化物的熔点见下表:
①试解释上表中氟化物熔点差异的原因:___________ 。
② 分子的空间构型为
分子的空间构型为___________ , 中Si—F键间的键角是
中Si—F键间的键角是___________ 。
(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的___________ (填“金属性”或“非金属性”)越强。写出能说明O、F两元素该性质强弱的化学方程式___________ 。
②根据图B预测,整个周期表中位置最低的元素应位于___________ (放射性元素除外)。图B所示第二周期主族元素中,某元素该性质反常偏高,则该元素原子核外电子排布式为___________ 。
③图C表示的意义是___________ 。
(4)元素周期表中,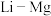 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
(1)Na原子核外有
(2)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 |  |  |  |
| 熔点/℃ | 1266 | 1534 | 183 |
②
 分子的空间构型为
分子的空间构型为 中Si—F键间的键角是
中Si—F键间的键角是(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的
②根据图B预测,整个周期表中位置最低的元素应位于
③图C表示的意义是
(4)元素周期表中,
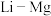 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。A. 易溶于水 易溶于水 | B. |
C. 熔点高 熔点高 | D.晶体硼为分子晶体 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】Ⅰ.金属单质及其化合物的应用非常广泛。
(1)铁元素在元素周期表中位置为___________ 。
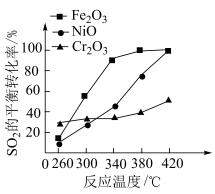
(2)反应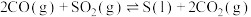
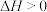 ,其他条件相同,催化剂不同时,反应相同时间
,其他条件相同,催化剂不同时,反应相同时间 的转化率随反应温度的变化如图所示,260℃条件下选择
的转化率随反应温度的变化如图所示,260℃条件下选择___________ (填“ ”“
”“ ”或“
”或“ ”),作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择
”),作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择 作催化剂的优势是
作催化剂的优势是___________ 。
(3)上述反应的正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应的速率常数,只受温度影响,
分别为正、逆反应的速率常数,只受温度影响,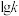 (速率常数的对数)与温度(T)的关系符合图中的两条线,其中表示
(速率常数的对数)与温度(T)的关系符合图中的两条线,其中表示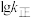 的是
的是___________ (填序号)。

(4)泡沫灭火器灭火时发生反应的离子方程式是___________ 。
(5)要使 溶液中
溶液中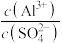 的比值增大,可加入的物质是___________。
的比值增大,可加入的物质是___________。
(1)铁元素在元素周期表中位置为
(2)反应
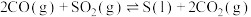
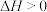 ,其他条件相同,催化剂不同时,反应相同时间
,其他条件相同,催化剂不同时,反应相同时间 的转化率随反应温度的变化如图所示,260℃条件下选择
的转化率随反应温度的变化如图所示,260℃条件下选择 ”“
”“ ”或“
”或“ ”),作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择
”),作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择 作催化剂的优势是
作催化剂的优势是
(3)上述反应的正反应速率方程为
 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应的速率常数,只受温度影响,
分别为正、逆反应的速率常数,只受温度影响,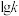 (速率常数的对数)与温度(T)的关系符合图中的两条线,其中表示
(速率常数的对数)与温度(T)的关系符合图中的两条线,其中表示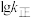 的是
的是
(4)泡沫灭火器灭火时发生反应的离子方程式是
(5)要使
 溶液中
溶液中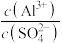 的比值增大,可加入的物质是___________。
的比值增大,可加入的物质是___________。| A.少量硫酸 | B.少量NaOH溶液 |
C.少量 固体 固体 | D.适量蒸馏水 |
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】下图是周期表的一部分,回答下列问题:
(1)A的原子结构示意图是_________________ ;
(2)E在周期表的位置为_________________________ ;与E同族的下一周期元素的原子序数为___________ ;
(3)表中元素形成气态氢化物最稳定的是___________ (填化学式,下同),最高价氧化物对应水化物酸性最强的是________________ ;
(4)下列不能用来对比C和D金属性强弱的是_________
a.C单质的熔点比D低
b.C的阳离子的氧化性弱于D的阳离子的氧化性
c.C单质与水反应比D单质与水反应剧烈
d.C最高价氧化物对应水化物的碱性比D强
(5)元素A与H分别与H形成的18电子分子Q和W(常用作火箭燃料)可以发生氧化还原反应,生成H单质和A的另一种氢化物。请写出该反应的方程式:______________________ 。
| H | A | B | ||||||
| C | D | E | F | G | ||||
(2)E在周期表的位置为
(3)表中元素形成气态氢化物最稳定的是
(4)下列不能用来对比C和D金属性强弱的是
a.C单质的熔点比D低
b.C的阳离子的氧化性弱于D的阳离子的氧化性
c.C单质与水反应比D单质与水反应剧烈
d.C最高价氧化物对应水化物的碱性比D强
(5)元素A与H分别与H形成的18电子分子Q和W(常用作火箭燃料)可以发生氧化还原反应,生成H单质和A的另一种氢化物。请写出该反应的方程式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】镓是制作高性能半导体的重要原料。工业上常从锌矿冶炼的废渣中回收镓。已知某锌矿渣主要含Zn、Si、Pb、Fe、Ga的氧化物,利用该矿渣制镓的工艺流程如下:
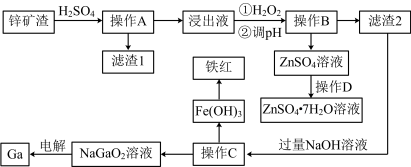
已知:①镓在元素周期表中位于第四周期第ⅢA,化学性质与铝相似。
②lg2=0.3,lg3=0.48。
③部分物质的Ksp如F表所示
(1)滤渣1的主要成分是_________ (写化学式)。
(2)加入H2O2的目的是(用离子方程式表示)___________ 。
(3)调pH的目的是______ ;室温条件下,若浸出液中各阳离子的浓度均为0.01 mol/L,当溶液中某种离子浓度小于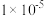 mol/L时即认为该离子已完全除去,则pH应调节的范围为
mol/L时即认为该离子已完全除去,则pH应调节的范围为_______ 。
(4)操作D包括:__________ 过滤、洗涤、干燥。
(5)制备、精炼金属Ga。
①电解法制备金属镓。用惰性电极电解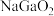 溶液即可制得金属镓,写出阴极电极反应式
溶液即可制得金属镓,写出阴极电极反应式_________ 。
②电解法精炼金属镓(粗镓含Zn、Fe、Cu等杂质,已知氧化性:
下列有关电解精炼金属镓的说法正确的是_______ (填字母序号)。
A .电解精炼镓时粗镓与电源的正极相连
B. 电解精炼过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,Cu和Fe沉积在电解槽底部形成阳极泥
D. 若用甲烷燃料电池电解精炼金属镓,当阴极有56.0 g镓析出时,电池负极最多消耗标准状况下的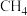 6.72 L
6.72 L

已知:①镓在元素周期表中位于第四周期第ⅢA,化学性质与铝相似。
②lg2=0.3,lg3=0.48。
③部分物质的Ksp如F表所示
| 物质 |  |  |  |  |
| Ksp | 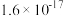 | 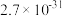 | 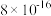 |  |
(2)加入H2O2的目的是(用离子方程式表示)
(3)调pH的目的是
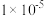 mol/L时即认为该离子已完全除去,则pH应调节的范围为
mol/L时即认为该离子已完全除去,则pH应调节的范围为(4)操作D包括:
(5)制备、精炼金属Ga。
①电解法制备金属镓。用惰性电极电解
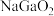 溶液即可制得金属镓,写出阴极电极反应式
溶液即可制得金属镓,写出阴极电极反应式②电解法精炼金属镓(粗镓含Zn、Fe、Cu等杂质,已知氧化性:

下列有关电解精炼金属镓的说法正确的是
A .电解精炼镓时粗镓与电源的正极相连
B. 电解精炼过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,Cu和Fe沉积在电解槽底部形成阳极泥
D. 若用甲烷燃料电池电解精炼金属镓,当阴极有56.0 g镓析出时,电池负极最多消耗标准状况下的
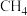 6.72 L
6.72 L
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】某研究性学习小组以一种工业废料制备高纯MgO,设计了流程如下。
请回答下列问题。
(1)步骤①中生成Mg2+的离子方程式为______________
(2)下列物质可用于代替步骤②中H2O2的是__________
A.NaCl B.Cl2 C.铁粉 D.KMnO4
(3)步骤③中采用如图所示装置除去Fe3+
ⅰ.实验装置图中仪器A的名称为________________
ⅱ.充分振荡并静置分层,打开仪器A上口的玻璃塞后,上、下层分离的正确操作是:________________
ⅲ.图中存在的错误是:________________
(4)步骤④中NaOH加入的量是______________ (填“少量”或“过量”)
(5)实验中,取工业废料40.0g( MgCO3的含量为42%),得到4.0g高纯氧化镁。该实验中高纯氧化镁的产率为____________ (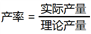 )
)
(6)高纯氧化镁可能具有如下性质和用途,正确的是____________
A.耐酸 B.耐碱 C.制耐火坩埚 D.制信号弹和焰火材料
请回答下列问题。
(1)步骤①中生成Mg2+的离子方程式为
(2)下列物质可用于代替步骤②中H2O2的是
A.NaCl B.Cl2 C.铁粉 D.KMnO4
(3)步骤③中采用如图所示装置除去Fe3+
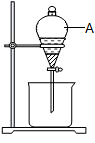
ⅰ.实验装置图中仪器A的名称为
ⅱ.充分振荡并静置分层,打开仪器A上口的玻璃塞后,上、下层分离的正确操作是:
ⅲ.图中存在的错误是:
(4)步骤④中NaOH加入的量是
(5)实验中,取工业废料40.0g( MgCO3的含量为42%),得到4.0g高纯氧化镁。该实验中高纯氧化镁的产率为
 )
)(6)高纯氧化镁可能具有如下性质和用途,正确的是
A.耐酸 B.耐碱 C.制耐火坩埚 D.制信号弹和焰火材料
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】碲(Te)属于氧族元素,广泛应用于冶金、能源、化工等行业。碲化亚铜渣中主要含有Cu和Te元素,并以Cu2Te、Cu及Te的形式存在,此外还含少量Au、Ag等元素。以碲化亚铜渣为原料制备TeO2及胆矾的流程如图:
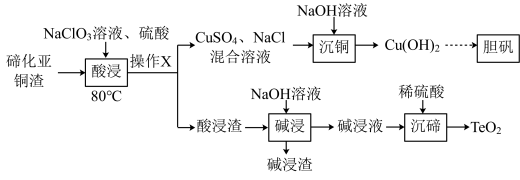
已知:①TeO2是两性氧化物,难溶于水;
②“酸浸”过程中Te元素先生成H2TeO3,随着溶液pH的提高,生成TeO2进入酸浸渣中。
回答下列问题:
(1)H2TeO3的化学名称为___________ 。
(2)“酸浸”时,适宜的控温方式为_________ ,写出该步骤Cu发生反应的离子方程式:_________ ;碲化亚铜发生反应中,参加反应的氧化剂与还原剂的物质的量之比为_________ 。
(3)实验室中,“操作X”用到的玻璃仪器有玻璃棒、___________ 。
(4)写出“碱浸”时,TeO2与NaOH反应的化学方程式:___________ 。
(5)“沉碲”时,控制溶液的pH为4.5~5.0,生成TeO2沉淀。酸性不能过强的原因是________ ;防止局部酸度过大的操作方法是_________ 。

已知:①TeO2是两性氧化物,难溶于水;
②“酸浸”过程中Te元素先生成H2TeO3,随着溶液pH的提高,生成TeO2进入酸浸渣中。
回答下列问题:
(1)H2TeO3的化学名称为
(2)“酸浸”时,适宜的控温方式为
(3)实验室中,“操作X”用到的玻璃仪器有玻璃棒、
(4)写出“碱浸”时,TeO2与NaOH反应的化学方程式:
(5)“沉碲”时,控制溶液的pH为4.5~5.0,生成TeO2沉淀。酸性不能过强的原因是
您最近一年使用:0次

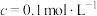 )的pH
)的pH )的pH
)的pH

