一种从分银渣(含CuO、 、
、 、
、 、
、 、Ag、
、Ag、 等)回收金属资源的工艺流程如下:
等)回收金属资源的工艺流程如下:
Ⅰ.CuCl难溶于水,但溶于浓盐酸。
Ⅱ.“富锑铋铜液”中含 (铋离子)、
(铋离子)、 (锑离子)、
(锑离子)、 、
、 。
。
Ⅲ.该工艺条件下,有关金属离子沉淀时的相关pH见下表:
回答下列问题:
(1)写出分银渣中的Ag与盐酸、溶解氧反应的离子方程式:___________________ 。
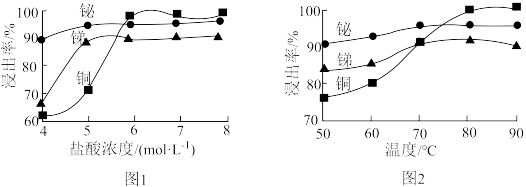
(2)“酸浸”时,盐酸浓度对锑、铋、铜浸出率的影响如图1所示,温度对锑、铋、铜浸出率的影响如图2所示。______ ;浸出时温度以80℃为宜,其原因是_____________________ 。
(3)①已知“滤渣2”的主要成分是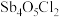 ,则“一次水解”时主要发生反应的化学方程式为
,则“一次水解”时主要发生反应的化学方程式为________ 。
②已知“滤渣3”的主要成分是BiOCl和 ,则“二次水解”时调节pH的范围应该是
,则“二次水解”时调节pH的范围应该是______ 。
(4)“滤渣1”中的AgCl可用硫酸-硫脲(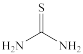 )浸出,生成配合物
)浸出,生成配合物 ,写出该反应的化学方程式:
,写出该反应的化学方程式:________________ ;该配合物中不存在__________ (填标号)。
A.离子键 B.极性共价键 C.配位键 D.范德华力 E.非极性共价键
(5)写出一种从“富铜溶液”中回收金属资源的方法:_________________ 。
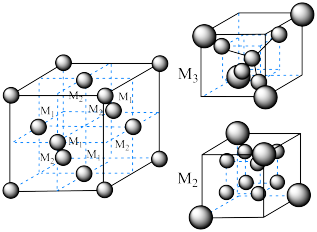
(6)尖晶石属于立方晶系,其晶胞可视为 、
、 两种结构交替无隙并置而成(如图所示),其中
两种结构交替无隙并置而成(如图所示),其中 可以为
可以为 、
、 、
、 、
、 等,
等, 可以为
可以为 、
、 、
、 等。已知尖晶石型
等。已知尖晶石型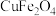 的晶胞参数为842pm,则该晶体的密度为
的晶胞参数为842pm,则该晶体的密度为________  。(列出计算式,阿伏加德罗常数的值为
。(列出计算式,阿伏加德罗常数的值为 )
)
 、
、 、
、 、
、 、Ag、
、Ag、 等)回收金属资源的工艺流程如下:
等)回收金属资源的工艺流程如下: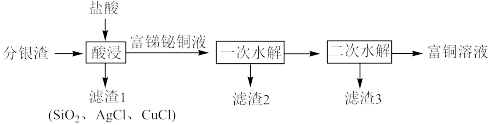
Ⅰ.CuCl难溶于水,但溶于浓盐酸。
Ⅱ.“富锑铋铜液”中含
 (铋离子)、
(铋离子)、 (锑离子)、
(锑离子)、 、
、 。
。Ⅲ.该工艺条件下,有关金属离子沉淀时的相关pH见下表:
金属离子 |
|
|
|
|
开始沉淀时( | 0.5 | 1.5 | 4.7 | 1.5 |
完全沉淀时( | 1.4 | 2.5 | 6.7 | 3.2 |
(1)写出分银渣中的Ag与盐酸、溶解氧反应的离子方程式:
(2)“酸浸”时,盐酸浓度对锑、铋、铜浸出率的影响如图1所示,温度对锑、铋、铜浸出率的影响如图2所示。
(3)①已知“滤渣2”的主要成分是
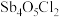 ,则“一次水解”时主要发生反应的化学方程式为
,则“一次水解”时主要发生反应的化学方程式为②已知“滤渣3”的主要成分是BiOCl和
 ,则“二次水解”时调节pH的范围应该是
,则“二次水解”时调节pH的范围应该是(4)“滤渣1”中的AgCl可用硫酸-硫脲(
 )浸出,生成配合物
)浸出,生成配合物 ,写出该反应的化学方程式:
,写出该反应的化学方程式:A.离子键 B.极性共价键 C.配位键 D.范德华力 E.非极性共价键
(5)写出一种从“富铜溶液”中回收金属资源的方法:
(6)尖晶石属于立方晶系,其晶胞可视为
 、
、 两种结构交替无隙并置而成(如图所示),其中
两种结构交替无隙并置而成(如图所示),其中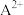 可以为
可以为 、
、 、
、 、
、 等,
等, 可以为
可以为 、
、 、
、 等。已知尖晶石型
等。已知尖晶石型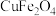 的晶胞参数为842pm,则该晶体的密度为
的晶胞参数为842pm,则该晶体的密度为 。(列出计算式,阿伏加德罗常数的值为
。(列出计算式,阿伏加德罗常数的值为 )
)
更新时间:2024-05-25 20:50:50
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
【推荐1】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
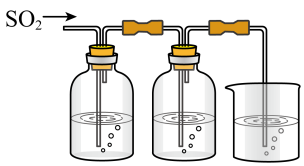
FeCl3溶液含有淀粉的碘水NaOH溶液
ABC
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在_________ 中,再加水稀释,这样操作的目的是_____________________________ 。
(2)装置C的作用是____________________________________________ 。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、__________ 、自然干燥,在这一系列操作中没有用到的仪器有________________________ (填序号)。
A.蒸发皿
B.石棉网
C.漏斗
D.烧杯
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式_____________________________ ;
②请设计实验方案检验有Fe2+生成____________________________________ ;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO 。该做法
。该做法_________ (填“合理”或“不合理”),理由是______________________ 。
(5)能表明I-的还原性弱于SO2的现象是_____________________________________________ 。

FeCl3溶液含有淀粉的碘水NaOH溶液
ABC
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在
(2)装置C的作用是
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、
A.蒸发皿
B.石棉网
C.漏斗
D.烧杯
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式
②请设计实验方案检验有Fe2+生成
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO
 。该做法
。该做法(5)能表明I-的还原性弱于SO2的现象是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】处理含铬[Cr(Ⅵ)]废水的方法有化学沉淀法、铝还原回收法等。已知 在溶液中存在如下平衡:
在溶液中存在如下平衡: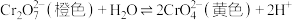 。
。
(1)钡盐沉铬法:向含 的酸性废水中加入钡盐,生成难溶于水的
的酸性废水中加入钡盐,生成难溶于水的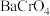 沉淀。使用
沉淀。使用 的沉铬效果要优于
的沉铬效果要优于 的原因是
的原因是_______ ,
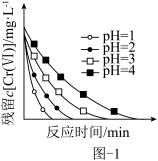
(2)亚硫酸氢钠-石灰乳还原沉淀法:向初始pH不等的几份酸性含铬废水中加入等量 ,使
,使 还原成
还原成 。测得废水中残留
。测得废水中残留 与反应时间的关系变化关系如图-1所示。
与反应时间的关系变化关系如图-1所示。
①写出 将
将 还原为
还原为 的离子方程式:
的离子方程式:_______ ,
②实际生产中,还原反应控制 为2.5左右的原因是
为2.5左右的原因是_______ 。
(3)还原回收 法:
法:
步骤I:向含 的酸性溶液中加入一定量的铝粉,充分反应,过滤。
的酸性溶液中加入一定量的铝粉,充分反应,过滤。
步骤Ⅱ:利用步骤I过滤后得到的溶液(含有 、
、 、
、 )制备
)制备 晶体。
晶体。
①研究发现,若步骤I中 偏低将会导致
偏低将会导致 的去除率下降,其原因是
的去除率下降,其原因是_______ 。
②步骤获得 晶体的实验方案为,向过滤后的溶液中
晶体的实验方案为,向过滤后的溶液中_______ ,冰水洗涤,干燥。(实验中须用到的试剂: 溶液、
溶液、 溶液、稀硫酸)
溶液、稀硫酸)
已知:i.碱性条件下 能被
能被 氧化为
氧化为 ;酸性条件下
;酸性条件下 能将
能将 还原为
还原为 。
。
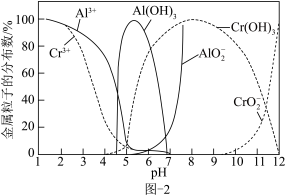
ii.常温下,体系中 、
、 微粒的分布分数随溶液pH的变化如图-2所示(部分无关粒子已略去)。
微粒的分布分数随溶液pH的变化如图-2所示(部分无关粒子已略去)。
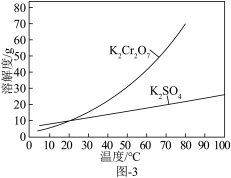
iii.不同温度下 和
和 的溶解度如图-3所示。
的溶解度如图-3所示。
 在溶液中存在如下平衡:
在溶液中存在如下平衡: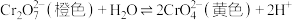 。
。(1)钡盐沉铬法:向含
 的酸性废水中加入钡盐,生成难溶于水的
的酸性废水中加入钡盐,生成难溶于水的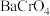 沉淀。使用
沉淀。使用 的沉铬效果要优于
的沉铬效果要优于 的原因是
的原因是(2)亚硫酸氢钠-石灰乳还原沉淀法:向初始pH不等的几份酸性含铬废水中加入等量
 ,使
,使 还原成
还原成 。测得废水中残留
。测得废水中残留 与反应时间的关系变化关系如图-1所示。
与反应时间的关系变化关系如图-1所示。
①写出
 将
将 还原为
还原为 的离子方程式:
的离子方程式:②实际生产中,还原反应控制
 为2.5左右的原因是
为2.5左右的原因是(3)还原回收
 法:
法:步骤I:向含
 的酸性溶液中加入一定量的铝粉,充分反应,过滤。
的酸性溶液中加入一定量的铝粉,充分反应,过滤。步骤Ⅱ:利用步骤I过滤后得到的溶液(含有
 、
、 、
、 )制备
)制备 晶体。
晶体。①研究发现,若步骤I中
 偏低将会导致
偏低将会导致 的去除率下降,其原因是
的去除率下降,其原因是②步骤获得
 晶体的实验方案为,向过滤后的溶液中
晶体的实验方案为,向过滤后的溶液中 溶液、
溶液、 溶液、稀硫酸)
溶液、稀硫酸)已知:i.碱性条件下
 能被
能被 氧化为
氧化为 ;酸性条件下
;酸性条件下 能将
能将 还原为
还原为 。
。ii.常温下,体系中
 、
、 微粒的分布分数随溶液pH的变化如图-2所示(部分无关粒子已略去)。
微粒的分布分数随溶液pH的变化如图-2所示(部分无关粒子已略去)。
iii.不同温度下
 和
和 的溶解度如图-3所示。
的溶解度如图-3所示。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:

(1)“酸浸”过程中主要反应的离子方程式为:_____________ 、________________ .
(2)“酸浸”时,提高浸出速率的具体措施有_________ 、_______ .(写出两个)
(3)“碱溶”的目的是_____________ .物质X的化学式为________ .
(4)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:__________________ .
(5)若根据过滤出的Fe(OH)3沉淀来推算煤矸石中Fe2O3的含量,须将沉淀清洗干净,检验沉淀是否洗干净的具体操作方法是_______________ .

(1)“酸浸”过程中主要反应的离子方程式为:
(2)“酸浸”时,提高浸出速率的具体措施有
(3)“碱溶”的目的是
(4)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:
(5)若根据过滤出的Fe(OH)3沉淀来推算煤矸石中Fe2O3的含量,须将沉淀清洗干净,检验沉淀是否洗干净的具体操作方法是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】甲硅烷 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。
(1)Si原子与H原子结合时,Si表现为正价,则电负性:Si___________ H(填“>”“<”或“=”), 分子的空间结构名称为
分子的空间结构名称为___________ 。
(2)利用 与
与 可制得氮化硅(
可制得氮化硅( )材料。
)材料。 中
中 的键角
的键角___________  中
中 的键角(填“>”“<”或“=”),其键角差异的原因是
的键角(填“>”“<”或“=”),其键角差异的原因是___________ 。
(3)利用 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。

①热稳定性:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②碳化硅晶体中每个Si原子周围距离最近的C原子数目为___________ ,SiC的晶体类型是___________ 。
③已知碳化硅的晶胞边长为a nm(1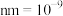 m),阿伏伽德罗常数为
m),阿伏伽德罗常数为 。则碳化硅晶体的密度为
。则碳化硅晶体的密度为___________ g⋅cm-3(列出计算式)。
④硅、金刚石和碳化硅晶体的熔点从高到低依次是___________ 。
(4)硅元素最高价氧化物对应的水化物为原硅酸( )。
)。
资料:原硅酸( )可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
)可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
①原硅酸钠( )溶液吸收空气中的
)溶液吸收空气中的 会生成
会生成 ,结合元素周期律解释原因:
,结合元素周期律解释原因:___________ 。
②从结构的角度解释 脱水后溶解度降低的原因:
脱水后溶解度降低的原因:___________ 。
 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。(1)Si原子与H原子结合时,Si表现为正价,则电负性:Si
 分子的空间结构名称为
分子的空间结构名称为(2)利用
 与
与 可制得氮化硅(
可制得氮化硅( )材料。
)材料。 中
中 的键角
的键角 中
中 的键角(填“>”“<”或“=”),其键角差异的原因是
的键角(填“>”“<”或“=”),其键角差异的原因是(3)利用
 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
①热稳定性:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②碳化硅晶体中每个Si原子周围距离最近的C原子数目为
③已知碳化硅的晶胞边长为a nm(1
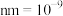 m),阿伏伽德罗常数为
m),阿伏伽德罗常数为 。则碳化硅晶体的密度为
。则碳化硅晶体的密度为④硅、金刚石和碳化硅晶体的熔点从高到低依次是
(4)硅元素最高价氧化物对应的水化物为原硅酸(
 )。
)。资料:原硅酸(
 )可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
)可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。①原硅酸钠(
 )溶液吸收空气中的
)溶液吸收空气中的 会生成
会生成 ,结合元素周期律解释原因:
,结合元素周期律解释原因:②从结构的角度解释
 脱水后溶解度降低的原因:
脱水后溶解度降低的原因:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐2】中科院首创的KBBF晶体在激光技术领域具有重要应用价值,KBBF的化学组成为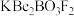
(1)氟原子激发态的电子排布式中能量从高到底的顺序是___________ 。(填标号)
a、 b、
b、 c、
c、 d、
d、
(2)KBBF晶体可将入射激光直接倍频产生深紫外激光,源于___________ (填选项符号)
A.分子热效应 B.晶体内化学反应焓变 C.原子核外电子在能级间的跃迁
(3)KBBF晶体生产原料纯化过程重要物质乙酸氧铍 分子为四面体对称结构,氧原子位于四面体中心,四个铍原子位于四面体的顶点,六个醋酸根离子则连接在四面体的六条棱边上:
分子为四面体对称结构,氧原子位于四面体中心,四个铍原子位于四面体的顶点,六个醋酸根离子则连接在四面体的六条棱边上:
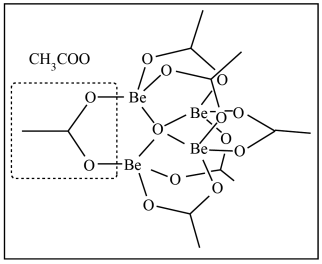
①分子中碳原子杂化类型为___________ 。
②六个甲基中的碳原子形成的空间构型为___________ 。
③1mol乙酸氧铍晶体中含有的配位键为___________ mol。
(4)超氧化钾( )晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是___________(填选项字母)。
)晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是___________(填选项字母)。
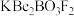
(1)氟原子激发态的电子排布式中能量从高到底的顺序是
a、
 b、
b、 c、
c、 d、
d、
(2)KBBF晶体可将入射激光直接倍频产生深紫外激光,源于
A.分子热效应 B.晶体内化学反应焓变 C.原子核外电子在能级间的跃迁
(3)KBBF晶体生产原料纯化过程重要物质乙酸氧铍
 分子为四面体对称结构,氧原子位于四面体中心,四个铍原子位于四面体的顶点,六个醋酸根离子则连接在四面体的六条棱边上:
分子为四面体对称结构,氧原子位于四面体中心,四个铍原子位于四面体的顶点,六个醋酸根离子则连接在四面体的六条棱边上:
①分子中碳原子杂化类型为
②六个甲基中的碳原子形成的空间构型为
③1mol乙酸氧铍晶体中含有的配位键为
(4)超氧化钾(
 )晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是___________(填选项字母)。
)晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是___________(填选项字母)。A. | B. | C. | D. |
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】镧系为元素周期表中第ⅢB族、原子序数为57~71的元素。
(1)镝(Dy)的基态原子电子排布式为[Xe]4f106s2,画出镝(Dy)原子外围电子排布图:_____________________ 。
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的电子排布式为_________________________ 。
(3)观察下面四种镧系元素的电离能(单位:kJ·mol-1)数据,判断最有可能显示+2价的元素是________ (填元素名称)。
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的非金属元素中,N、O第一电离能的大小关系为_____________________ (用元素符号表示)。
②写出氮的最简单气态氢化物水溶液中存在的氢键:____________ (任写2种)。
③元素Al也有类似成键情况,气态氯化铝分子表示为(AlCl3)2,分子中Al原子杂化方式为________ ,分子中所含化学键类型有________ (填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,则PrO2(二氧化镨)的晶胞中有________ 个氧原子;已知晶胞参数为a pm,密度为ρg·cm-3,NA=________ (用含a、ρ的代数式表示)。
(1)镝(Dy)的基态原子电子排布式为[Xe]4f106s2,画出镝(Dy)原子外围电子排布图:
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的电子排布式为
(3)观察下面四种镧系元素的电离能(单位:kJ·mol-1)数据,判断最有可能显示+2价的元素是
| 元素 | I1 | I2 | I3 | I4 |
| Yb(镱) | 604 | 1217 | 4494 | 5014 |
| Lu(镥) | 532 | 1390 | 4111 | 4987 |
| La(镧) | 538 | 1067 | 1850 | 5419 |
| Ce(铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的非金属元素中,N、O第一电离能的大小关系为
②写出氮的最简单气态氢化物水溶液中存在的氢键:
③元素Al也有类似成键情况,气态氯化铝分子表示为(AlCl3)2,分子中Al原子杂化方式为
a.离子键 b.极性键 c.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,则PrO2(二氧化镨)的晶胞中有
您最近一年使用:0次
【推荐1】钴酸锂废极片中钴回收的某种工艺流程如下图所示,其中废极片的主要成分为钴酸锂(LiCoO2)和金属铝,最终可得到Co2O3及锂盐。

(1) “还原酸浸”过程中,大部分LiCoO2可转化为CoSO4,请将该反应的化学方程式补充完整:2LiCoO2+3H2SO4+□ □CoSO4+□ +□ + □ 。
□CoSO4+□ +□ + □ 。__________
(2) “还原酸浸”过程中,Co、Al浸出率(进入溶液中的某元素质量占固体中该元素总质量的百分数)受硫酸浓度及温度(t)的影响分别如图1和图2所示。工艺流程中所选择的硫酸浓度为2 mol.L-1,温度为80 oC,推测其原因是________ 。
A. Co的浸出率较高 B. Co和Al浸出的速率较快
C. Al的浸出率较高 D. 双氧水较易分解


图1 图2
(3)加入(NH4)2C2O4后得CoC2O4沉淀。写出CoC2O4沉淀在空气中高温煅烧得到Co2O3的反应的化学方程式:________ 。
(4)若初始投入钴酸锂废极片的质量为1 kg,煅烧后获得Co2O3的质量为83 g,已知Co的浸出率为90%,则钴酸锂废极片中钴元素的质量分数约为________ (小数点后保留两位)。
(5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1 mol·L-1,部分锂盐的溶解度数据如下表所示。
结合数据分析,沉锂过程所用的试剂b是________ (写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,________ ,洗涤干燥。

(1) “还原酸浸”过程中,大部分LiCoO2可转化为CoSO4,请将该反应的化学方程式补充完整:2LiCoO2+3H2SO4+□
 □CoSO4+□ +□ + □ 。
□CoSO4+□ +□ + □ 。(2) “还原酸浸”过程中,Co、Al浸出率(进入溶液中的某元素质量占固体中该元素总质量的百分数)受硫酸浓度及温度(t)的影响分别如图1和图2所示。工艺流程中所选择的硫酸浓度为2 mol.L-1,温度为80 oC,推测其原因是
A. Co的浸出率较高 B. Co和Al浸出的速率较快
C. Al的浸出率较高 D. 双氧水较易分解


图1 图2
(3)加入(NH4)2C2O4后得CoC2O4沉淀。写出CoC2O4沉淀在空气中高温煅烧得到Co2O3的反应的化学方程式:
(4)若初始投入钴酸锂废极片的质量为1 kg,煅烧后获得Co2O3的质量为83 g,已知Co的浸出率为90%,则钴酸锂废极片中钴元素的质量分数约为
(5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1 mol·L-1,部分锂盐的溶解度数据如下表所示。
| 温度 | Li2SO4 | Li2CO3 |
| 0 oC | 36.1 g | 1.33 g |
| 100 oC | 24.0 g | 0.72 g |
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】CeO2是一种重要的稀土氧化物,可利用氟碳铈矿(主要成分为CeFCO3)来制备。其工艺流程如下:
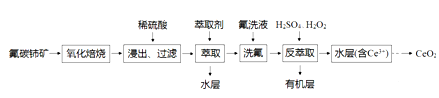
已知:I.Ce4+能与SO42-结合成[CeSO4]2+,与F-结合成[CeFx](4-x)+(0<x<4).
II.在硫酸体系中,Ce4+能被萃取剂萃取二Ce3+不能。
回答下列问题:
(1)“氧化焙烧”中“氧化”的目的是_________________ 。
(2)CeO2不溶于水和碱,微溶于酸,但“浸出”时却能溶解完全,原因是溶液中的_______ (填原子符号,下同)、__________ 、_____________ 促进了CeO2的溶解。
(3)“反萃取”时发生反应的离子方程式为____________________ 。
(4)若缺少“洗氟”这一环节,则所得产品的质量将___________ (填“偏大”“偏小”或“不变”)。

已知:I.Ce4+能与SO42-结合成[CeSO4]2+,与F-结合成[CeFx](4-x)+(0<x<4).
II.在硫酸体系中,Ce4+能被萃取剂萃取二Ce3+不能。
回答下列问题:
(1)“氧化焙烧”中“氧化”的目的是
(2)CeO2不溶于水和碱,微溶于酸,但“浸出”时却能溶解完全,原因是溶液中的
(3)“反萃取”时发生反应的离子方程式为
(4)若缺少“洗氟”这一环节,则所得产品的质量将
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
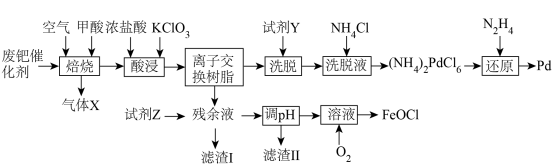
【推荐3】钯(Pd)见一种银白色过渡金属,质软、有良好的延展性和可塑性,他锻造、压延和拉丝。块状金属钯能吸收大量氢气,使体积显著胀大、变脆乃至破裂成碎片。一种从废钯催化剂(杂质主要含有机物、活性炭及少量Fe、Cu、Al等元素)中回收钯和类芬顿催化剂 的工艺流程如图所示:
的工艺流程如图所示:
已知:①常温下,钯不溶于盐酸;Pd易被氧化为难溶于酸的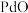 而失去催化活性;
而失去催化活性;
②阴、阳离子交换树脂的基本工作原理分别为 、
、 (R—表示树脂的有机成分);
(R—表示树脂的有机成分);
③常温下,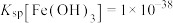 ;
;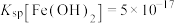 ;
;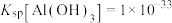 ;当溶液中某离子浓度小于等于
;当溶液中某离子浓度小于等于 时,可认为该离子沉淀完全;
时,可认为该离子沉淀完全;
④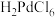 是一种二元强酸,
是一种二元强酸, 在溶液中存在配位平衡:
在溶液中存在配位平衡: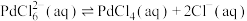
 ;
;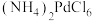 在水中溶解度小。
在水中溶解度小。
回答下列问题:
(1)废钯催化剂“焙烧”时,先通入空气进行逆流式焙烧,其主要目的是___________ ,再通入甲酸继续焙烧的目的是___________ 。
(2)“酸浸”过程需要升高温度至70℃左右,则主要反应的离子方程式为___________ ,实现浸取Pd的同时,还可能会存在的缺陷是___________ 。
(3)“洗脱”时,加入最佳“试剂Y”的名称是___________ ,“洗脱液”中要加入过量 的目的是
的目的是___________ 。
(4)“还原”过程中,不生成污染环境的气体,则被氧化的元素与被还原的元素物质的量之比为___________ 。“调pH”步骤中,若铁元素和铝元素浓度均为 ,则调pH的范围为
,则调pH的范围为___________ (lg2=0.3)。
 的工艺流程如图所示:
的工艺流程如图所示:
已知:①常温下,钯不溶于盐酸;Pd易被氧化为难溶于酸的
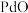 而失去催化活性;
而失去催化活性;②阴、阳离子交换树脂的基本工作原理分别为
 、
、 (R—表示树脂的有机成分);
(R—表示树脂的有机成分);③常温下,
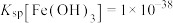 ;
;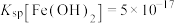 ;
;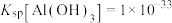 ;当溶液中某离子浓度小于等于
;当溶液中某离子浓度小于等于 时,可认为该离子沉淀完全;
时,可认为该离子沉淀完全;④
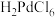 是一种二元强酸,
是一种二元强酸, 在溶液中存在配位平衡:
在溶液中存在配位平衡: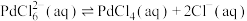
 ;
;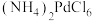 在水中溶解度小。
在水中溶解度小。回答下列问题:
(1)废钯催化剂“焙烧”时,先通入空气进行逆流式焙烧,其主要目的是
(2)“酸浸”过程需要升高温度至70℃左右,则主要反应的离子方程式为
(3)“洗脱”时,加入最佳“试剂Y”的名称是
 的目的是
的目的是(4)“还原”过程中,不生成污染环境的气体,则被氧化的元素与被还原的元素物质的量之比为
 ,则调pH的范围为
,则调pH的范围为
您最近一年使用:0次

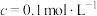 )的pH
)的pH )的pH
)的pH

