五种短周期元素的部分数据性质如下:
(1)X在元素周期表中的位置为___________ ,Z离子的结构示意图为___________ 。
(2)关于Y、Z两种元素,下列叙述正确的是___________ (填序号)。
a.简单离子的半径Y>Z
b.气态氢化物的稳定性Y比Z强
c.最高价氧化物对应水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物。某同学设计了下图所示装置(夹持仪器省略)进行实验

将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是___________ 。一段时间后,发生反应的离子方程式是___________ 。
(4)XO2是导致光化学烟雾的“罪魁祸首”之一、它被氢氧化钠溶液吸收的化学方程式是:2XO2+2NaOH=M+NaXO3+H2O(已配平),产物M中元素X的化合价为___________ 。
| 元素代号 | T | X | Y | Z | W |
| 原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
(2)关于Y、Z两种元素,下列叙述正确的是
a.简单离子的半径Y>Z
b.气态氢化物的稳定性Y比Z强
c.最高价氧化物对应水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物。某同学设计了下图所示装置(夹持仪器省略)进行实验

将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是
(4)XO2是导致光化学烟雾的“罪魁祸首”之一、它被氢氧化钠溶液吸收的化学方程式是:2XO2+2NaOH=M+NaXO3+H2O(已配平),产物M中元素X的化合价为
更新时间:2023-03-20 20:57:15
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】在分析化学中常用 作为基准物质测定酸性
作为基准物质测定酸性 溶液的浓度。回答下列问题:
溶液的浓度。回答下列问题:
(1)若将W g 配成100mL标准溶液,移取20.00mL置于锥形瓶中,则酸性
配成100mL标准溶液,移取20.00mL置于锥形瓶中,则酸性 溶液应装在
溶液应装在_______ (填“酸式”或“碱式”)滴定管中,判断滴定达到终点的现象是_______ 。
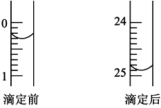
(2)如图表示某一次滴定前后50mL滴定管中液面的位置。该次滴定所用标准盐酸体积为_______ mL。
(3)该滴定反应的离子方程式_______ 。
(4)若用 溶液滴定至终点时,消耗
溶液滴定至终点时,消耗 溶液V mL,则
溶液V mL,则 溶液的物质的量浓度为
溶液的物质的量浓度为_______  (用含W、V的最简代数式表示)。
(用含W、V的最简代数式表示)。
 作为基准物质测定酸性
作为基准物质测定酸性 溶液的浓度。回答下列问题:
溶液的浓度。回答下列问题:(1)若将W g
 配成100mL标准溶液,移取20.00mL置于锥形瓶中,则酸性
配成100mL标准溶液,移取20.00mL置于锥形瓶中,则酸性 溶液应装在
溶液应装在(2)如图表示某一次滴定前后50mL滴定管中液面的位置。该次滴定所用标准盐酸体积为

(3)该滴定反应的离子方程式
(4)若用
 溶液滴定至终点时,消耗
溶液滴定至终点时,消耗 溶液V mL,则
溶液V mL,则 溶液的物质的量浓度为
溶液的物质的量浓度为 (用含W、V的最简代数式表示)。
(用含W、V的最简代数式表示)。
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】实验小组利用如下图所示的装置制备氯气及探究氯气的性质。
资料:单质碘 遇淀粉溶液变蓝,利用此现象可检验溶液中的
遇淀粉溶液变蓝,利用此现象可检验溶液中的 。
。
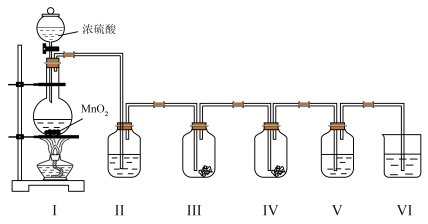
(1)Ⅰ中制备氯气时,发生反应的化学方程式是_______
(2)Ⅱ的目的是除去氯气中的水蒸气,则瓶中盛放的试剂是_______ 。
(3)利用Ⅲ、Ⅳ装置探究氯气与水反应的产物。
①实验前,向Ⅲ、Ⅳ中均放入干燥蓝色石蕊纸花,并向_______ 中滴少量水将纸花润湿。
②实验时,根据Ⅲ中的纸花不变色及_______ 现象,甲同学得出初步结论:氯气与水反应生成具有酸性及漂白性的物质。
③同学们分析后,认为用该实验装置不能得出“氯气与水反应有酸性物质生成”的结论,理由是_______ 。
(4)Ⅴ中盛有 淀粉溶液,随
淀粉溶液,随 通入,可获得
通入,可获得 具有氧化性的实验证据是
具有氧化性的实验证据是_______ 。
(5)Ⅵ中盛放的试剂是 溶液,其作用是
溶液,其作用是_______ ,发生反应的离子方程式是_______ 。
(6)利用如下装置也可以制取氯气,并利用氯气的氧化性制取 。
。
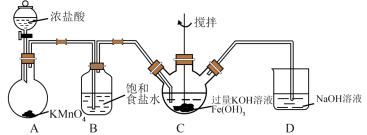
①装置A中, 被还原为
被还原为 ,写出反应的离子方程式:
,写出反应的离子方程式:_______ 。
②装置C中发生如下反应,将方程式配平:_______ 。
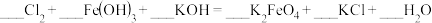
资料:单质碘
 遇淀粉溶液变蓝,利用此现象可检验溶液中的
遇淀粉溶液变蓝,利用此现象可检验溶液中的 。
。
(1)Ⅰ中制备氯气时,发生反应的化学方程式是
(2)Ⅱ的目的是除去氯气中的水蒸气,则瓶中盛放的试剂是
(3)利用Ⅲ、Ⅳ装置探究氯气与水反应的产物。
①实验前,向Ⅲ、Ⅳ中均放入干燥蓝色石蕊纸花,并向
②实验时,根据Ⅲ中的纸花不变色及
③同学们分析后,认为用该实验装置不能得出“氯气与水反应有酸性物质生成”的结论,理由是
(4)Ⅴ中盛有
 淀粉溶液,随
淀粉溶液,随 通入,可获得
通入,可获得 具有氧化性的实验证据是
具有氧化性的实验证据是(5)Ⅵ中盛放的试剂是
 溶液,其作用是
溶液,其作用是(6)利用如下装置也可以制取氯气,并利用氯气的氧化性制取
 。
。
①装置A中,
 被还原为
被还原为 ,写出反应的离子方程式:
,写出反应的离子方程式:②装置C中发生如下反应,将方程式配平:
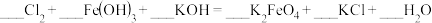
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】Ⅰ.某厂废水中含KCN,其浓度为0.01 mol·L-1,现用氯氧化法处理,发生如下反应(化合物中N化合价均为-3价):KCN+2KOH+Cl2=KOCN+2KCl+H2O
(1)被氧化的元素是_______ 。(用元素符号表示)
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:_______
____KOCN+_______Cl2 +_____KOH→_______K2CO3+_____N2+_____KCl+_____H2O
(3)若将10 L含KCN的浓度为0.01 mol·L-1的废水中KCN氧化除去,最少需要氯气_______ mol。
Ⅱ.某实验小组为了测定(3)中溶液多余Cl2的含量,常用Na2S2O3标准溶液进行定量测定。
(4)现实验室需用480 mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需要_______ 。
(5)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO ,因此Na2S2O3常用作脱氯剂,该反应的离子方程式为
,因此Na2S2O3常用作脱氯剂,该反应的离子方程式为_______ (碱性环境)。
(6)现取(3)中溶液20.00 mL,用a mol·L-1Na2S2O3溶液进行滴定,经过平行实验测得消耗Na2S2O3标准溶液b mL,计算废液中Cl2的浓度为_______ mol·L-1(用含a、b的表达式表示)。
(1)被氧化的元素是
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
____KOCN+_______Cl2 +_____KOH→_______K2CO3+_____N2+_____KCl+_____H2O
(3)若将10 L含KCN的浓度为0.01 mol·L-1的废水中KCN氧化除去,最少需要氯气
Ⅱ.某实验小组为了测定(3)中溶液多余Cl2的含量,常用Na2S2O3标准溶液进行定量测定。
(4)现实验室需用480 mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需要
(5)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO
 ,因此Na2S2O3常用作脱氯剂,该反应的离子方程式为
,因此Na2S2O3常用作脱氯剂,该反应的离子方程式为(6)现取(3)中溶液20.00 mL,用a mol·L-1Na2S2O3溶液进行滴定,经过平行实验测得消耗Na2S2O3标准溶液b mL,计算废液中Cl2的浓度为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】Al(OH)3是治疗胃酸过多的药物胃舒平的主要成分。某课外兴趣小组用铝、稀硫酸、烧碱为原料,制备一定量的Al(OH)3。他们分别设计了两种实验方案:
方案一:
方案二: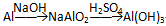
(1)从节约药品的角度思考,你认为哪一种方案好?_____________ ,方案一和方案二共同存在的问题是___________________
(2)请用相同的原料设计一个更为节约药品的方案,并写出有关反应的化学方程式。
方案一:

方案二:
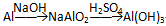
(1)从节约药品的角度思考,你认为哪一种方案好?
(2)请用相同的原料设计一个更为节约药品的方案,并写出有关反应的化学方程式。
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:

(1)I和Ⅱ步骤中分离溶液和沉淀的操作是:_____________ 。
(2)沉淀M中除含有泥沙外,一定还含有_________ (填化学式),生成固体N反应的化学方程式为_________ 。
(3)滤液X中,含铝元素的溶质的化学式为___________ ,它属于__________ (填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入___________ (填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为_________________ 。

(1)I和Ⅱ步骤中分离溶液和沉淀的操作是:
(2)沉淀M中除含有泥沙外,一定还含有
(3)滤液X中,含铝元素的溶质的化学式为
(4)实验室里常往AlCl3溶液中加入
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
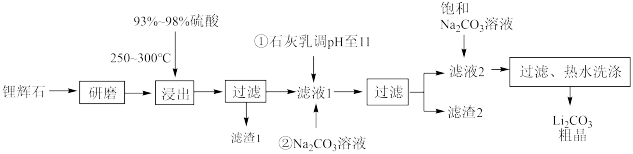
【推荐3】工业上以锂辉石为原料生产碳酸锂的部分工业流程如图所示:
已知:(1)锂辉石的主要成分为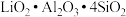 。其中含少量
。其中含少量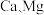 元素。
元素。
(2)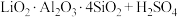 (浓)
(浓)

(3)某些物质的溶解度(S)如下表所示:
回答下列问题:
(1)从滤流1中分离出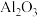 的流程如图所示:
的流程如图所示:

写出生成沉淀的离子方程式:_______ 。
(2)已知滤渣2的主要成分有_______ 。
(3)最后一个步骤中,用“热水洗涤”的目的是_______ 。
(4)工业上,将 粗品制备成高纯
粗品制备成高纯 的部分工艺如下:
的部分工艺如下:
a.将 溶于盐酸作电解槽的阳极液,
溶于盐酸作电解槽的阳极液,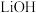 溶液作阴极液,两者用离子选择性透过膜隔开,用惰性电极电解。
溶液作阴极液,两者用离子选择性透过膜隔开,用惰性电极电解。
b.电解后向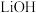 溶液中加入少量
溶液中加入少量 溶液并共热,过滤、烘干得高纯
溶液并共热,过滤、烘干得高纯 。
。
①a中电解时所用的是_______ (填“阳离子交换膜”或“阴离子交换膜”)。
②电解后,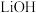 溶液浓度增大的原因是
溶液浓度增大的原因是_______  中生成
中生成 反应的化学方程式是
反应的化学方程式是_______
(5)磷酸亚铁锂电池总反应为FePO4+Li LiFePO4,电池中的固体电解质可传导
LiFePO4,电池中的固体电解质可传导 ,写出该电池放电时的正极反应:
,写出该电池放电时的正极反应:_______ 。

已知:(1)锂辉石的主要成分为
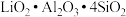 。其中含少量
。其中含少量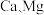 元素。
元素。(2)
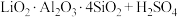 (浓)
(浓)

(3)某些物质的溶解度(S)如下表所示:
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
回答下列问题:
(1)从滤流1中分离出
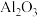 的流程如图所示:
的流程如图所示:
写出生成沉淀的离子方程式:
(2)已知滤渣2的主要成分有
(3)最后一个步骤中,用“热水洗涤”的目的是
(4)工业上,将
 粗品制备成高纯
粗品制备成高纯 的部分工艺如下:
的部分工艺如下:a.将
 溶于盐酸作电解槽的阳极液,
溶于盐酸作电解槽的阳极液,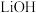 溶液作阴极液,两者用离子选择性透过膜隔开,用惰性电极电解。
溶液作阴极液,两者用离子选择性透过膜隔开,用惰性电极电解。b.电解后向
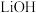 溶液中加入少量
溶液中加入少量 溶液并共热,过滤、烘干得高纯
溶液并共热,过滤、烘干得高纯 。
。①a中电解时所用的是
②电解后,
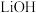 溶液浓度增大的原因是
溶液浓度增大的原因是 中生成
中生成 反应的化学方程式是
反应的化学方程式是(5)磷酸亚铁锂电池总反应为FePO4+Li
 LiFePO4,电池中的固体电解质可传导
LiFePO4,电池中的固体电解质可传导 ,写出该电池放电时的正极反应:
,写出该电池放电时的正极反应:
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C的简单离子和B的简单离子具有相同的电子层结构;A和B、D、E均能形成共价型化合物;A和B形成的化合物在水中呈碱性,C和E形成的化合物中阴阳离子的个数比为1:1,根据判断出的元素及相应化学式回答问题:
(1)五种元素中,金属性最强的是_______ (填元素名称),非金属性最强的元素是_____ (填元素名称)。
(2)由元素A分别和元素B、D、E所形成的共价型化合物中,热稳定性最差的是_________ (用化学式表示)。
(3)元素A和E形成的化合物与元素A和B形成的化合物反应,产物的电子式为________ ,其中存在的化学键类型为_______________ 。
(4)E离子的结构示意图是__________ ,单质E与水反应的离子方程式为_________ 。
(1)五种元素中,金属性最强的是
(2)由元素A分别和元素B、D、E所形成的共价型化合物中,热稳定性最差的是
(3)元素A和E形成的化合物与元素A和B形成的化合物反应,产物的电子式为
(4)E离子的结构示意图是
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】周期表前四周期的元素ab、c、d、e,f原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的外围电子排布式为 ,f的最外层只有一个电子,但次外层有18个电子。回答下列问题:
,f的最外层只有一个电子,但次外层有18个电子。回答下列问题:
(1)b、c两元素形成的化合物 ,俗名“笑气”,是人类最早应用于医疗的麻醉剂之一、它与
,俗名“笑气”,是人类最早应用于医疗的麻醉剂之一、它与 互为
互为___________ ,已知c只与一个b原子成键,则 的结构式为
的结构式为___________
(2)a、b、c、d四种元素形成的一种正盐,阴离子的立体构型呈三角锥形,则该正盐的化学式为___________ ,其阳离子与阴离子VSEPR模型___________ (填“相同”或“不相同”)
(3)e形成的简单离子中较稳定的是___________ (填离子符号),其原因是___________
(4)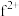 能与多种配体形成配位数为4的配合物。在
能与多种配体形成配位数为4的配合物。在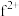 的硫酸盐溶液中加入过量KCN生成配合物的化学式是
的硫酸盐溶液中加入过量KCN生成配合物的化学式是___________ ,配体中共价键的类型有___________
(5)已知f的堆积方式是面心立方最密堆积,该晶胞中f原子的空间利用率为___________
 ,f的最外层只有一个电子,但次外层有18个电子。回答下列问题:
,f的最外层只有一个电子,但次外层有18个电子。回答下列问题:(1)b、c两元素形成的化合物
 ,俗名“笑气”,是人类最早应用于医疗的麻醉剂之一、它与
,俗名“笑气”,是人类最早应用于医疗的麻醉剂之一、它与 互为
互为 的结构式为
的结构式为(2)a、b、c、d四种元素形成的一种正盐,阴离子的立体构型呈三角锥形,则该正盐的化学式为
(3)e形成的简单离子中较稳定的是
(4)
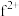 能与多种配体形成配位数为4的配合物。在
能与多种配体形成配位数为4的配合物。在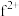 的硫酸盐溶液中加入过量KCN生成配合物的化学式是
的硫酸盐溶液中加入过量KCN生成配合物的化学式是(5)已知f的堆积方式是面心立方最密堆积,该晶胞中f原子的空间利用率为
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如图,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素。
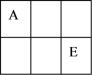
(1)D在元素周期表中的位置为___________ 。
(2)AE2的结构式为___________ 。
(3)C、E、F的简单氢化物的沸点最高的是___________ (填化学式)。
(4)C、D、E、F的简单离子半径由大到小的顺序是___________ (填离子符号)。
(5)实验室制取F2气体的主要方法的离子方程式为___________ 。
(6)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为___ 。
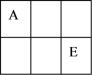
(1)D在元素周期表中的位置为
(2)AE2的结构式为
(3)C、E、F的简单氢化物的沸点最高的是
(4)C、D、E、F的简单离子半径由大到小的顺序是
(5)实验室制取F2气体的主要方法的离子方程式为
(6)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】2021年10月16日,神舟十三号载人飞船与“天和”核心舱成功径向交会对接。化学助力我国航天事业发展,借助元素周期表可以认识各种材料的组成、结构和性质。a~h8种元素在元素周期表中的位置如下:
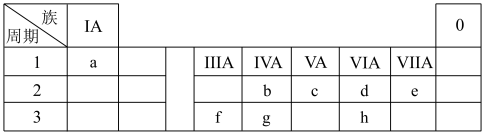
(1)a的单质常用作火箭推进剂,该过程中a单质对应的产物为________ (填化学式)。
(2)g单质在太阳能电池和芯片制造等领域有着重要应用,g最高价氧化物的化学式为________ ;b的氧化物含有的化学键类型为________ 。(填“离子键”“极性键”或“非极性键”)
(3)飞船的制造使用了f的合金,f的简单离子结构示意图为________ ,比较f和g原子半径大小:f________ (填“>”“<”或“=”)g。
(4)元素c与元素e所形成的简单氢化物的稳定性大小:c________ (填“>”“<”或“=”)e。
(5)试比较b、g两种元素最高价氧化物的晶体熔点大小b______ g(用化学式和“>”“<”表示)

(1)a的单质常用作火箭推进剂,该过程中a单质对应的产物为
(2)g单质在太阳能电池和芯片制造等领域有着重要应用,g最高价氧化物的化学式为
(3)飞船的制造使用了f的合金,f的简单离子结构示意图为
(4)元素c与元素e所形成的简单氢化物的稳定性大小:c
(5)试比较b、g两种元素最高价氧化物的晶体熔点大小b
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】下表为元素周期表的一部分,请按要求回答下列问题。
(1)元素①在周期表中的位置___________ ,元素②的双原子分子的电子式___________ 。
(2)画出这8种元素中,金属性最强的元素的原子结构示意图___________ 。
(3)③、⑧两种元素的氢化物稳定性由大到小的顺序___________ (用化学式表示)。
(4)元素⑦、⑧的最高价氧化物对应的水化物中,酸性更强的是___________ (用化学式表示)。
(5)在盛有水的小烧杯中加入元素④的单质,发生反应的离子方程式为___________ 。向上述反应后的溶液中再加入元素⑤的单质,发生反应的化学方程式为___________ 。
| 族 周期 | ⅠA | 0 | ||||||
| 一 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
(2)画出这8种元素中,金属性最强的元素的原子结构示意图
(3)③、⑧两种元素的氢化物稳定性由大到小的顺序
(4)元素⑦、⑧的最高价氧化物对应的水化物中,酸性更强的是
(5)在盛有水的小烧杯中加入元素④的单质,发生反应的离子方程式为
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。M元素与X同主族,与W同周期。
(1)M元素是___________ (填元素符号)。
(2)Z、W形成的气态氢物的稳定性为___________ >___________ 。(填化学式)
(3)写出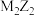 的电子式
的电子式___________ ,写出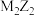 与水反应的离子方程式
与水反应的离子方程式___________ 。
(4)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为___________ 。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知① 能与足量
能与足量 浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是
浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是___________ (填化学式)。写出该气体B与氯水反应的离子方程式___________ 。
(6)由X、Y、Z、W和Fe五种元素组成的相对分子质量为392的化合物C, 中含有6mol结晶水。对化合物C进行下实验:
中含有6mol结晶水。对化合物C进行下实验:
a.取C的溶液加入过量浓 溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b.另取C的溶液,加入过量 溶液产生白色沉淀,加盐酸沉淀不溶解
溶液产生白色沉淀,加盐酸沉淀不溶解
①写出C的化学式为___________ 。
②试写出C与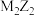 按物质的量比
按物质的量比 在溶液中反应的化学方程式
在溶液中反应的化学方程式___________ 。
(1)M元素是
(2)Z、W形成的气态氢物的稳定性为
(3)写出
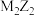 的电子式
的电子式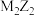 与水反应的离子方程式
与水反应的离子方程式(4)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①
 能与足量
能与足量 浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是
浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是(6)由X、Y、Z、W和Fe五种元素组成的相对分子质量为392的化合物C,
 中含有6mol结晶水。对化合物C进行下实验:
中含有6mol结晶水。对化合物C进行下实验:a.取C的溶液加入过量浓
 溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;b.另取C的溶液,加入过量
 溶液产生白色沉淀,加盐酸沉淀不溶解
溶液产生白色沉淀,加盐酸沉淀不溶解①写出C的化学式为
②试写出C与
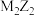 按物质的量比
按物质的量比 在溶液中反应的化学方程式
在溶液中反应的化学方程式
您最近半年使用:0次



