 、
、 、
、 是化工生产中的重要气体原料,它们都有一定的毒性。用氨水可NaOH溶液处理可以有效防止对空气的污染。请回答下列问题:
是化工生产中的重要气体原料,它们都有一定的毒性。用氨水可NaOH溶液处理可以有效防止对空气的污染。请回答下列问题:(1)工业上用电解饱和食盐水生产氯气,用浓氨水检验
 是否泄漏。
是否泄漏。①在电解池阳极上发生的电极反应是
②电解饱和食盐水制氯气的化学反应方程式为
③已知:
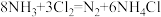 当测试到有少量
当测试到有少量 泄漏时,可以观察到的明显现象
泄漏时,可以观察到的明显现象(2)①若用热烧碱溶液吸收
 ,反应后的混合溶液中含NaCl、NaClO和
,反应后的混合溶液中含NaCl、NaClO和 物质的量比值为n:1:1,则
物质的量比值为n:1:1,则
②
 是形成酸雨的主要因素,工业上常利用过量氨水吸收
是形成酸雨的主要因素,工业上常利用过量氨水吸收 ,其发生反应的离子方程式是
,其发生反应的离子方程式是(3)
 是燃油汽车尾气中的主要污染物之一,实验室可用烧碱溶液吸收
是燃油汽车尾气中的主要污染物之一,实验室可用烧碱溶液吸收 和NO,(已知
和NO,(已知 ,
,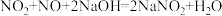 ),当消耗
),当消耗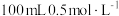 的烧碱溶液时,共吸收混合气体
的烧碱溶液时,共吸收混合气体
更新时间:2023-05-09 10:01:28
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓) CuSO4+A↑+2H2O。试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O。试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于________ (用字母代号填写)
a. 酸 b. 碱 c. 盐 d. 酸性氧化物 e. 碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中________ (填写化学式,下同)失去电子,氧化剂是__________ 。
(2)一定量的铜片与100mL 18 mol/L的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的质量为_____ g,生成的A气体在标准状况下体积为_____ L(假设气体全部逸出),剩余的H2SO4的浓度为____________ mol/L(忽略溶液体积的变化)。
 CuSO4+A↑+2H2O。试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O。试通过计算和推理完成下面的问题:(1)A物质可以导致酸雨的形成。则A应该属于
a. 酸 b. 碱 c. 盐 d. 酸性氧化物 e. 碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中
(2)一定量的铜片与100mL 18 mol/L的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的质量为
您最近一年使用:0次
【推荐2】Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
(1)浓盐酸在反应中显示出来的性质是_____ (填写字母)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)产生0.3 mol Cl2,则转移的电子的物质的量为______ mol。
(3)用双线桥法表示该氧化还原反应中电子转移的方向和数目_________ 。
(1)浓盐酸在反应中显示出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)产生0.3 mol Cl2,则转移的电子的物质的量为
(3)用双线桥法表示该氧化还原反应中电子转移的方向和数目
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
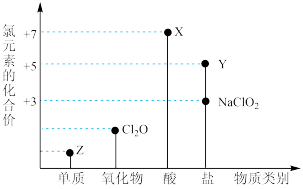
回答下列问题:
(1)X的电离方程式为_________ 。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=_________ 。
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_____________ 。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的___________ 倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为_____________ 。
(6)自来水中的 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平:___ Al+ ____  +
+ _____ =___  +
+ _____ N2↑ + _______ H2O

回答下列问题:
(1)X的电离方程式为
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为
(6)自来水中的
 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平: +
+  +
+
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】氯及其化合物在生活中应用广泛。如图是一些含氯产品
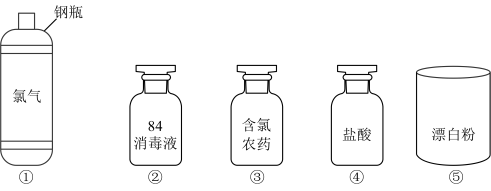
请回答下列问题:
(1)84消毒液的有效成分是次氯酸钠,从物质的分类上看,次氯酸钠属于___________ (填序号)
A.酸 B.碱 C.盐 D.非电解质 E.电解质 F.弱电解质
(2)如果发生了氯气泄漏,以下自救方法得当的是___________(填序号)。
(3)使用84消毒液漂白衣物时,在空气中放置一段时间,漂白效果更好,原因是________ ;
(4)将氯气通入冷的石灰乳中可制备漂白粉,用化学方程式表示制备原理___________ 。

请回答下列问题:
(1)84消毒液的有效成分是次氯酸钠,从物质的分类上看,次氯酸钠属于
A.酸 B.碱 C.盐 D.非电解质 E.电解质 F.弱电解质
(2)如果发生了氯气泄漏,以下自救方法得当的是___________(填序号)。
| A.向地势低的地方撤离 |
| B.观察风向,顺风撤离 |
| C.用蘸有肥皂水的毛巾捂住口鼻撤离 |
| D.用洁净抹布浸透氢氧化钠溶液捂住嘴和鼻 |
(3)使用84消毒液漂白衣物时,在空气中放置一段时间,漂白效果更好,原因是
(4)将氯气通入冷的石灰乳中可制备漂白粉,用化学方程式表示制备原理
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】新型冠状病毒肺炎爆发以来,各类杀菌消毒剂逐渐被人们所认识和使用。下列是常见的几种消毒剂:①“84”消毒液(有效成分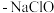 );②
);② (在水中一部分可以电离出正、负离子);③漂白粉;④
(在水中一部分可以电离出正、负离子);③漂白粉;④ ⑤
⑤ ;⑥碘酒;⑦
;⑥碘酒;⑦ 酒精;⑧过氧乙酸
酒精;⑧过氧乙酸 ⑨高铁酸钠
⑨高铁酸钠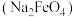 。回答下列问题:
。回答下列问题:
(1)上述杀菌消毒剂___________ (填序号)属于电解质,___________ (填序号)属于非电解质。“84”消毒液中有效成分的电离方程式为___________ 。
(2)巴西奥运会期间,由于工作人员将“84"消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能原因是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO___________ H2O2(填“>”或“<”)。
(3)若混合使用“洁厕灵”(盐酸是成分之一)与84消毒液会产生氯气。原因是___________ (用离子方程式表示)。
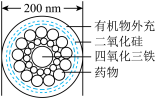
(4)如图是中国科学院上海硅酸盐研究所研发的“纳米药物分子运输车”,可提高肿瘤的治疗效果。以下说法不正确的是___________。
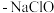 );②
);② (在水中一部分可以电离出正、负离子);③漂白粉;④
(在水中一部分可以电离出正、负离子);③漂白粉;④ ⑤
⑤ ;⑥碘酒;⑦
;⑥碘酒;⑦ 酒精;⑧过氧乙酸
酒精;⑧过氧乙酸 ⑨高铁酸钠
⑨高铁酸钠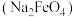 。回答下列问题:
。回答下列问题:(1)上述杀菌消毒剂
(2)巴西奥运会期间,由于工作人员将“84"消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能原因是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO
(3)若混合使用“洁厕灵”(盐酸是成分之一)与84消毒液会产生氯气。原因是
(4)如图是中国科学院上海硅酸盐研究所研发的“纳米药物分子运输车”,可提高肿瘤的治疗效果。以下说法不正确的是___________。

| A.葡萄糖等大多数含碳化合物属于有机物 |
| B.该“纳米药物分子车"属于混合物 |
| C.该“纳米药物分子车”分散于水后能够透过半透膜 |
| D.该“纳米药物分子车”中的二氧化硅和四氧化三铁属于氧化物 |
您最近一年使用:0次
【推荐1】氧、硫、硒、碲都位于元素周期表的VIA族,其化合物在化工生产中有广泛应用。
(1)下列性质的递变顺序不正确的是_____ (填字母)。
A.酸性:H2SeO4>H2SeO3 B.非金属性:O>S>Se>Te
C.还原性:H2Te>H2Se>H2S>H2O D.热稳定性:H2O>H2Te>H2Se>H2S
E.沸点: H2Te>H2Se>H2S>H2O
(2)在常温下进行的置换反应X+W→Y+V中, H2O可以扮演不同的“角色”。已知X、Y是短周期主族元素形成的单质,W、V是化合物。
①若W是水,且作还原剂,反应的化学方程式为_________ 。
②若V是水,为还原产物,反应的化学方程式为_____________ 。
(3) ①一定温度下,向恒容密闭容器中充入一定量的H2S,发生反应H2S(g) S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是
S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是_______ (填字母)。
A.混合气体的密度不再变化 B.混合气体的压强不再变化
C.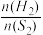 不再变化 D.H2S与H2的消耗速率相等
不再变化 D.H2S与H2的消耗速率相等
②已知:液态CS2完全燃烧生成CO2、SO2气体,每转移3mol电子时放出269.2kJ热量。写出表示CS2(1)的燃烧热的热化学方程式:______________ 。
(4) ①工业上,用S02还原TeC14溶液制备碲(Te),反应中氧化产物与还原产物的物质的量之比为____________ 。
②以石墨为电极,电解强碱性Na2TeO3溶液也可获得碲,电解过程中阴极的电极反应式为_____ ;阳极产生的气体是_____ (填化学式)。
(1)下列性质的递变顺序不正确的是
A.酸性:H2SeO4>H2SeO3 B.非金属性:O>S>Se>Te
C.还原性:H2Te>H2Se>H2S>H2O D.热稳定性:H2O>H2Te>H2Se>H2S
E.沸点: H2Te>H2Se>H2S>H2O
(2)在常温下进行的置换反应X+W→Y+V中, H2O可以扮演不同的“角色”。已知X、Y是短周期主族元素形成的单质,W、V是化合物。
①若W是水,且作还原剂,反应的化学方程式为
②若V是水,为还原产物,反应的化学方程式为
(3) ①一定温度下,向恒容密闭容器中充入一定量的H2S,发生反应H2S(g)
 S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是
S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是A.混合气体的密度不再变化 B.混合气体的压强不再变化
C.
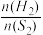 不再变化 D.H2S与H2的消耗速率相等
不再变化 D.H2S与H2的消耗速率相等②已知:液态CS2完全燃烧生成CO2、SO2气体,每转移3mol电子时放出269.2kJ热量。写出表示CS2(1)的燃烧热的热化学方程式:
(4) ①工业上,用S02还原TeC14溶液制备碲(Te),反应中氧化产物与还原产物的物质的量之比为
②以石墨为电极,电解强碱性Na2TeO3溶液也可获得碲,电解过程中阴极的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)以甲烷、空气、氢氧化钾溶液为原料,石墨为电极可以构成燃料电池。该电池的负极反应式为___________________________________________ 。
(2)用如图所示装置进行电解①若A、B均为石墨电极,C为足量CuSO4溶液,则电解的总反应方程式为___________________________________________ 。
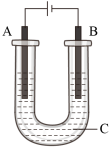
电解一段时间后,取出电极,向电解液中加入适量的___ (填化学式)可使C溶液恢复到电解前的成分和浓度。
②若A、B均为铂电极,C为Na2SO4溶液(含酚酞),电解一段时间后,___ (填“A”或“B”)极附近显红色;将电极取出,搅拌使溶液混合均匀,测得溶液的pH ____ 7(填“<”、“=”或“>”)。
③若A、B为同一材料的电极,C为CuCl2溶液,电解过程中CuCl2溶液的浓度始终 保持不变,则A、B为___ (填化学式)电极;当电路中有0.04 mol电子通过时,阴极增重___ g。
(2)用如图所示装置进行电解①若A、B均为石墨电极,C为足量CuSO4溶液,则电解的总反应方程式为

电解一段时间后,取出电极,向电解液中加入适量的
②若A、B均为铂电极,C为Na2SO4溶液(含酚酞),电解一段时间后,
③若A、B为同一材料的电极,C为CuCl2溶液,电解过程中CuCl2溶液的浓度始终 保持不变,则A、B为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】氯碱工业中电解饱和食盐水的原理示意图如下图所示:

(1)用化学式表示:气体a是___________ 溶液A的溶质是___________ ;
(2)电解饱和食盐水的离子方程式是___________ ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用_____ ;
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
①电池放电时,负极的电极反应式为___________ 。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为___________

(1)用化学式表示:气体a是
(2)电解饱和食盐水的离子方程式是
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:NiO(OH)+MH
 Ni(OH)2+M
Ni(OH)2+M①电池放电时,负极的电极反应式为
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为
您最近一年使用:0次

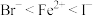 ,有一混合溶液,其中只含有
,有一混合溶液,其中只含有 、
、 、
、 ,其中
,其中 、
、 的物质的量之比为3∶4,向该溶液中通入少量氯气,一定会发生的反应的离子方程式是
的物质的量之比为3∶4,向该溶液中通入少量氯气,一定会发生的反应的离子方程式是

