海水中溴元素主要以Br— 形式存在,工业上从海水中提取溴的流程如下:
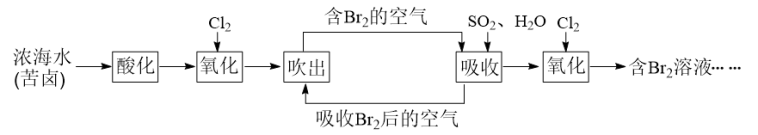
(1)将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,写出吸收反应的化学方程式:___________
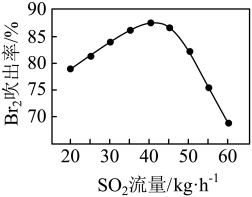
(2)吸收后的空气进行循环利用。吹出时,Br2 吹出率与吸收塔中SO2流量的关系如图所示。SO2 流量过大,Br2 吹出率反而下降的原因是:___________
(3)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,完成下列化学方程式:______________
___________Br2+ ___________Na2CO3 ___________NaBrO3+ ___________CO2+ ___________
___________NaBrO3+ ___________CO2+ ___________
当有3molBr2参加反应,发生转移的电子的物质的量为___________ 。
(4)用于吸收Br2的SO2是工业制硫酸的重要物质,其中主反应是催化氧化SO2.现将SO2与足量O2置于密闭容器中,在催化剂、500℃条件下发生反应。SO2与SO3的物质的量浓度随时间的变化如图所示,请回答下列问题。
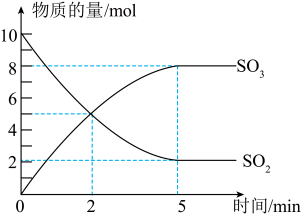
i.反应开始至2min末,以SO2 的浓度变化表示该反应的平均速率是___________ ;2min时,反应是否达到化学平衡状态___________ (填“是”或“否”)。
ii.关于该反应下列说法不正确的是___________ 。
a.催化剂可以增大化学反应速率
b.改变温度或压强,可以实现SO2的完全转化
c.若仅增大容器容积,则该化学反应速率增大

(1)将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,写出吸收反应的化学方程式:
(2)吸收后的空气进行循环利用。吹出时,Br2 吹出率与吸收塔中SO2流量的关系如图所示。SO2 流量过大,Br2 吹出率反而下降的原因是:

(3)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,完成下列化学方程式:
___________Br2+ ___________Na2CO3
 ___________NaBrO3+ ___________CO2+ ___________
___________NaBrO3+ ___________CO2+ ___________当有3molBr2参加反应,发生转移的电子的物质的量为
(4)用于吸收Br2的SO2是工业制硫酸的重要物质,其中主反应是催化氧化SO2.现将SO2与足量O2置于密闭容器中,在催化剂、500℃条件下发生反应。SO2与SO3的物质的量浓度随时间的变化如图所示,请回答下列问题。

i.反应开始至2min末,以SO2 的浓度变化表示该反应的平均速率是
ii.关于该反应下列说法不正确的是
a.催化剂可以增大化学反应速率
b.改变温度或压强,可以实现SO2的完全转化
c.若仅增大容器容积,则该化学反应速率增大
更新时间:2023-04-28 21:55:01
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】 与
与 的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。
的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。
某兴趣小组通过如下装置(夹持装置略)对 制备、吸收、释放和应用进行了研究。
制备、吸收、释放和应用进行了研究。

已知:装置 中的药品可以吸收氯气。回答下列问题:
中的药品可以吸收氯气。回答下列问题:
(1)打开 的活塞,
的活塞, 中发生反应生成
中发生反应生成 ,请将化学方程式配平
,请将化学方程式配平___________
 。
。
(2)吸收 气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放
气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放 的浓度随时间的变化如下图所示。
的浓度随时间的变化如下图所示。
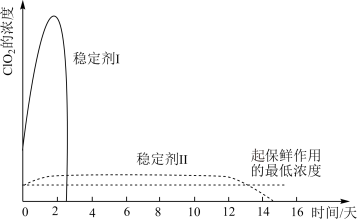
若将其用于水果保鲜,你认为效果较好的稳定剂是___________ ,原因是___________ 。
 与
与 的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。
的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如下装置(夹持装置略)对
 制备、吸收、释放和应用进行了研究。
制备、吸收、释放和应用进行了研究。
已知:装置
 中的药品可以吸收氯气。回答下列问题:
中的药品可以吸收氯气。回答下列问题:(1)打开
 的活塞,
的活塞, 中发生反应生成
中发生反应生成 ,请将化学方程式配平
,请将化学方程式配平 。
。(2)吸收
 气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放
气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放 的浓度随时间的变化如下图所示。
的浓度随时间的变化如下图所示。
若将其用于水果保鲜,你认为效果较好的稳定剂是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】锂电池是目前应用广泛的新型电池,一种回收钴酸锂废旧电池(主要成分为LiCoO2,同时含有少量Fe、Al、C单质)的流程如下图所示。
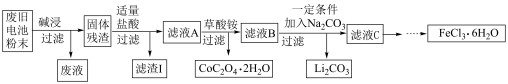
已知:Fe3+能与C2O 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的___________ (填“是”或“不是”)氧化还原反应,CoC2O4·2H2O中C的化合价为___________ ,滤渣I的主要成份为___________ 。
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是___________ 。
写出该过程发生的化学反应方程式___________ 。
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式___________ 。
(4)请设计实验方案检验滤液C中的Cl-。___________
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:_________
___________ClO- +___________Fe3++___________=___________FeO +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。

已知:Fe3+能与C2O
 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是
写出该过程发生的化学反应方程式
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式
(4)请设计实验方案检验滤液C中的Cl-。
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:
___________ClO- +___________Fe3++___________=___________FeO
 +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】黄钠铁矾[NaFe3 (SO4)2(OH)6]是一种高效净水剂,Ni(OH)2可作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备黄钠铁矾和Ni (OH)2,工艺流程如图所示。
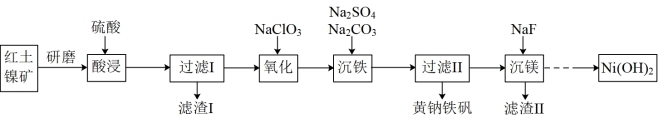
已知:①次亚磷酸钠(NaH2PO2)具有还原性;
②亚磷酸(H3PO3)是二元弱酸。
回答下列问题:
(1)下列说法正确的是_______ (填标号)。
(2)“氧化”过程中发生反应的离子方程式为:_______ ;为 了证明加入的NaClO3已足量,可取“氧化”后的溶液,向其中加入_______ 来检验(填标号)。
a. KSCN 溶液 b. K3[Fe(CN)6]溶液 C.酸性KMnO4溶液
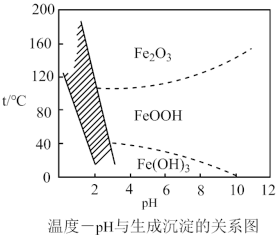
(3)“沉铁” 过程,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域),若控制pH=2.5,沉铁的最佳温度范围为_______ ;若反应在低于40℃时进行,加碳酸钠偏多,则所得黄钠铁矾中混有的杂质是_______ 。
(4)①“沉镁”是生成MgF2沉淀除去Mg2+。若溶液酸度过高,则Mg2+沉淀不完全,原因是_______ 。
②若“沉镁”后溶液的pH=8.0,则此时Ni2+浓度约为_______ mol·L-1 (已知:100.4≈2.5,
Ksp[Ni(OH)2]=10-14.6)。
(5)化学镀镍是金属表面镀镍的常用方法。以NiSO4和NaH2PO2为原料,在90℃的酸性溶液中镀镍,同时生成H3PO3。写出化学镀镍反应的离子方程式_______ 。

已知:①次亚磷酸钠(NaH2PO2)具有还原性;
②亚磷酸(H3PO3)是二元弱酸。
回答下列问题:
(1)下列说法正确的是_______ (填标号)。
| A.研磨粉碎的目的是增大反应速率 |
| B.用浓硫酸可提高“酸浸”时的浸取率 |
| C.过滤时用到的玻璃仪器主要有漏斗、烧杯、玻璃棒 |
| D.“滤渣I”的主要成分为H2SiO3 |
a. KSCN 溶液 b. K3[Fe(CN)6]溶液 C.酸性KMnO4溶液
(3)“沉铁” 过程,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域),若控制pH=2.5,沉铁的最佳温度范围为

(4)①“沉镁”是生成MgF2沉淀除去Mg2+。若溶液酸度过高,则Mg2+沉淀不完全,原因是
②若“沉镁”后溶液的pH=8.0,则此时Ni2+浓度约为
Ksp[Ni(OH)2]=10-14.6)。
(5)化学镀镍是金属表面镀镍的常用方法。以NiSO4和NaH2PO2为原料,在90℃的酸性溶液中镀镍,同时生成H3PO3。写出化学镀镍反应的离子方程式
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】目前工业合成氨的原理是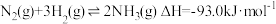 。
。
(1)已知一定条件下: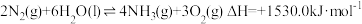 。则表示氢气燃烧热的热化学方程式为
。则表示氢气燃烧热的热化学方程式为_______ 。
(2)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是_______ (填字母代号)。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩容器,生成更多NH3
(3)可用氨水吸收大气污染物NO2生成NH4NO3。25℃时,将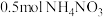 溶于水,溶液显酸性,向该溶液滴加
溶于水,溶液显酸性,向该溶液滴加 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将
氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将_______ (假设温度不变,填“正向”不”或“逆向”)移动
(4)电厂烟气脱氮的主反应:①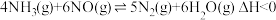 ,副反应:②
,副反应:②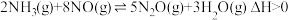 。平衡混合气中N2与N2O含量与温度的关系如图:
。平衡混合气中N2与N2O含量与温度的关系如图:
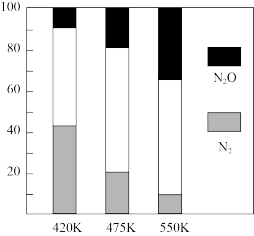
请回答:在 时,平衡混合气中N2含量随温度的变化规律是
时,平衡混合气中N2含量随温度的变化规律是_______ ,导致这种规律的原因是_______ (任答合理的一条原因)。
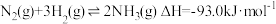 。
。(1)已知一定条件下:
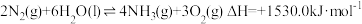 。则表示氢气燃烧热的热化学方程式为
。则表示氢气燃烧热的热化学方程式为(2)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩容器,生成更多NH3
(3)可用氨水吸收大气污染物NO2生成NH4NO3。25℃时,将
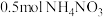 溶于水,溶液显酸性,向该溶液滴加
溶于水,溶液显酸性,向该溶液滴加 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将
氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将(4)电厂烟气脱氮的主反应:①
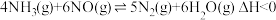 ,副反应:②
,副反应:②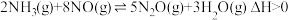 。平衡混合气中N2与N2O含量与温度的关系如图:
。平衡混合气中N2与N2O含量与温度的关系如图:
请回答:在
 时,平衡混合气中N2含量随温度的变化规律是
时,平衡混合气中N2含量随温度的变化规律是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】丁二烯、异丁烯均是重要的有机化工原料,广泛用于有机合成和精细化工。
I.正丁烷催化氧化制1,3-丁二烯的一种反应途径如图所示。
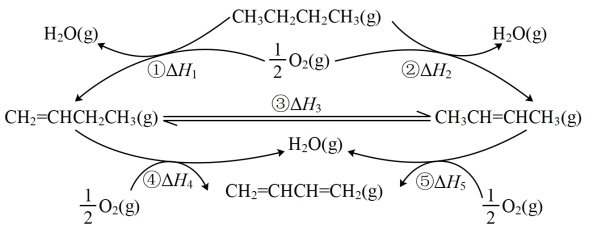
(1)已知:∆H1>∆H2,则CH3CH2CH2CH3(g)+O2(g)==CH2=CHCH=CH2(g)+2H2O(g) ∆H=_______ ,相同条件下,稳定性:1-丁烯_______ (填“>”“<”或“=”)2-丁烯。
(2)在某恒温恒容密闭容器中通入等物质的量的CH2=CHCH2CH3(g)和O2(g),仅发生反应④(该反应为可逆反应),下列描述能说明反应已经达到平衡状态的是_______(填标号)。
II.正丁烷脱氢异构制异丁烯。温度为T℃,向体积不等的恒容密闭容器中均充入1mol正丁烷,发生反应:CH3CH2CH2CH3(g) CH2=C(CH3)2(g)+H2(g) ∆H,反应均进行10min。测得各容器中正丁烷的转化率与容器体积的关系如图所示。
CH2=C(CH3)2(g)+H2(g) ∆H,反应均进行10min。测得各容器中正丁烷的转化率与容器体积的关系如图所示。

(3)A点时v正_______ (填“>”“=”或“<”,下同)v逆;正反应速率:v(B)_______ v(D)。
(4)若C点为平衡点且容器总压强为0.4MPa,则该条件下,反应的平衡常数Kp=_______ MPa(以分压表示的平衡常数为Kp,分压=总压×物质的量分数)。
(5)向A点对应的反应体系中再充入一定量的正丁烷,达到平衡时,正丁烷的转化率_______ (填“增大”、“减小”或“不变”)。
I.正丁烷催化氧化制1,3-丁二烯的一种反应途径如图所示。

(1)已知:∆H1>∆H2,则CH3CH2CH2CH3(g)+O2(g)==CH2=CHCH=CH2(g)+2H2O(g) ∆H=
(2)在某恒温恒容密闭容器中通入等物质的量的CH2=CHCH2CH3(g)和O2(g),仅发生反应④(该反应为可逆反应),下列描述能说明反应已经达到平衡状态的是_______(填标号)。
| A.混合气体的密度不再改变 |
| B.混合气体平均摩尔质量不再改变 |
| C.丁二烯和H2O(g)的物质的量之比不再改变 |
| D.1-丁烯和O2(g)的物质的量之比不再改变 |
II.正丁烷脱氢异构制异丁烯。温度为T℃,向体积不等的恒容密闭容器中均充入1mol正丁烷,发生反应:CH3CH2CH2CH3(g)
 CH2=C(CH3)2(g)+H2(g) ∆H,反应均进行10min。测得各容器中正丁烷的转化率与容器体积的关系如图所示。
CH2=C(CH3)2(g)+H2(g) ∆H,反应均进行10min。测得各容器中正丁烷的转化率与容器体积的关系如图所示。
(3)A点时v正
(4)若C点为平衡点且容器总压强为0.4MPa,则该条件下,反应的平衡常数Kp=
(5)向A点对应的反应体系中再充入一定量的正丁烷,达到平衡时,正丁烷的转化率
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】关于煤的处理是工业重要的生产工艺,从煤的气化到液化是重要环节。
(1)煤的气化是重要的制氢途径,在一定温度下,向体积固定的密闭容器中加入足量的C(s)和 ,起始压强为0.2MPa时,下列反应生成水煤气:
,起始压强为0.2MPa时,下列反应生成水煤气:
Ⅰ.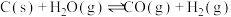

Ⅱ.
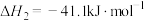
①下列说法正确的是_______ 。
A.平衡时升高温度,反应Ⅰ的平衡逆向移动 B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时 的体积分数可能大于
的体积分数可能大于 D.将炭块粉碎,可加快反应速率
D.将炭块粉碎,可加快反应速率
②反应平衡时, 的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
的转化率为50%,CO的物质的量为0.1mol。此时,整个体系_______ (填“吸收”或“放出”)热量_______ kJ,反应Ⅰ的平衡常数
_______ MPa(以分压表示,分压=总压×物质的量分数)。
(2)掺杂硒的纳米氧化亚铜催化剂可用于工业上水煤气合成甲醇,实现煤的间接液化,其反应为
 。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和
。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和 发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
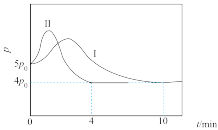
①曲线Ⅱ所对应的改变的条件可能为_______ 。
②体系总压强先增大的原因为_______ ,后减小的原因为_______ 。
③该条件下 的平衡转化率为
的平衡转化率为_______ %(结果保留三位有效数字)。
(1)煤的气化是重要的制氢途径,在一定温度下,向体积固定的密闭容器中加入足量的C(s)和
 ,起始压强为0.2MPa时,下列反应生成水煤气:
,起始压强为0.2MPa时,下列反应生成水煤气:Ⅰ.
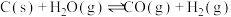

Ⅱ.

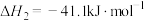
①下列说法正确的是
A.平衡时升高温度,反应Ⅰ的平衡逆向移动 B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时
 的体积分数可能大于
的体积分数可能大于 D.将炭块粉碎,可加快反应速率
D.将炭块粉碎,可加快反应速率②反应平衡时,
 的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
(2)掺杂硒的纳米氧化亚铜催化剂可用于工业上水煤气合成甲醇,实现煤的间接液化,其反应为

 。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和
。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和 发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
①曲线Ⅱ所对应的改变的条件可能为
②体系总压强先增大的原因为
③该条件下
 的平衡转化率为
的平衡转化率为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】稀土有工业“黄金”之称,我国稀土资源丰富。目前从氟碳铈矿(主要化学成分为CeFCO3)提取铈族稀土元素的冶炼处理工艺已经发展到十几种,其中一种提取铈的工艺流程如下:
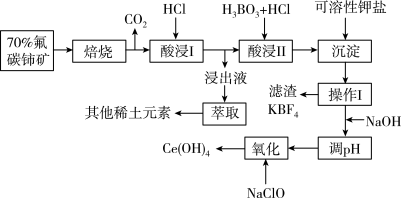
已知:①焙烧后烧渣中含+4 价的铈及+3 价的其他稀土氟氧化物;
②Ce4+能与 S 结合成[CeSO4 ]2+,Ce4+能被萃取剂[(HA)2 ]萃取。
结合成[CeSO4 ]2+,Ce4+能被萃取剂[(HA)2 ]萃取。
请回答下列问题:
(1)CeFCO3中,Ce 元素的化合价为________________________ 。
(2)“酸浸Ⅰ”过程中 CeO2转化为 Ce3+,且产生黄绿色气体,用稀硫酸和 H2O2,替换 HCl 就不会造成环境污染。则稀硫酸、H2O2与 CeO2反应的离子方程式为_____________ 。
(3)“沉淀”步骤中发生的反应为 Ce(BF4)3(s)+3KCl(aq)=3KBF4(s)+CeCl3 (aq)。则该反应的平衡常数表达式为:____________________ (用实际参加反应的离子表示)。
(4)浸出液”中含有少量 Ce4+及其他稀土元素的离子,可以通过“萃取”与“反萃取”作进一步分离、富集各离子。“萃取”时 Ce4+与萃取剂[(HA)2]存在的反应为Ce4++n(HA)2 Ce(H2n-4A2n)+4H + 。 用 D 表示 Ce4 + 分别在有机层中与水层中存在形式的浓度之比: D =
Ce(H2n-4A2n)+4H + 。 用 D 表示 Ce4 + 分别在有机层中与水层中存在形式的浓度之比: D =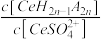 ,其他条件不变,在浸出液中加入不同量的 Na2SO4以改变水层中的 c(S
,其他条件不变,在浸出液中加入不同量的 Na2SO4以改变水层中的 c(S ),D 随浸出液中 c(S
),D 随浸出液中 c(S )增大而减小的原因是:
)增大而减小的原因是:________________________ 。
(5)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧, 在尾气消除过程中发生着 CeO2 CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出 CeO2消除 CO 尾气的化学方程式:
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出 CeO2消除 CO 尾气的化学方程式:________________________________ 。

已知:①焙烧后烧渣中含+4 价的铈及+3 价的其他稀土氟氧化物;
②Ce4+能与 S
 结合成[CeSO4 ]2+,Ce4+能被萃取剂[(HA)2 ]萃取。
结合成[CeSO4 ]2+,Ce4+能被萃取剂[(HA)2 ]萃取。请回答下列问题:
(1)CeFCO3中,Ce 元素的化合价为
(2)“酸浸Ⅰ”过程中 CeO2转化为 Ce3+,且产生黄绿色气体,用稀硫酸和 H2O2,替换 HCl 就不会造成环境污染。则稀硫酸、H2O2与 CeO2反应的离子方程式为
(3)“沉淀”步骤中发生的反应为 Ce(BF4)3(s)+3KCl(aq)=3KBF4(s)+CeCl3 (aq)。则该反应的平衡常数表达式为:
(4)浸出液”中含有少量 Ce4+及其他稀土元素的离子,可以通过“萃取”与“反萃取”作进一步分离、富集各离子。“萃取”时 Ce4+与萃取剂[(HA)2]存在的反应为Ce4++n(HA)2
 Ce(H2n-4A2n)+4H + 。 用 D 表示 Ce4 + 分别在有机层中与水层中存在形式的浓度之比: D =
Ce(H2n-4A2n)+4H + 。 用 D 表示 Ce4 + 分别在有机层中与水层中存在形式的浓度之比: D =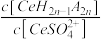 ,其他条件不变,在浸出液中加入不同量的 Na2SO4以改变水层中的 c(S
,其他条件不变,在浸出液中加入不同量的 Na2SO4以改变水层中的 c(S ),D 随浸出液中 c(S
),D 随浸出液中 c(S )增大而减小的原因是:
)增大而减小的原因是:(5)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧, 在尾气消除过程中发生着 CeO2
 CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出 CeO2消除 CO 尾气的化学方程式:
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出 CeO2消除 CO 尾气的化学方程式:
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】推断题。
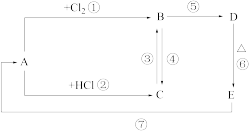
(1)A、B、C、D、E分别是铁或铁的化合物。E常用作制油漆、涂料的颜料。其相互反应关系如图所示:
根据如图所示变化,按要求回答下列问题:
①写出D的化学式___________ ;
②向C的酸性溶液中加入 生成B的离子方程式:
生成B的离子方程式:___________ ;
③E→A的化学方程式:___________ ;
④C中加入 溶液,看到的现象是
溶液,看到的现象是___________ ;该过程中发生的氧化还原反应的化学方程式:___________ ;
(2)利用黄铜矿粉(主要成分为 )制取绿矾
)制取绿矾
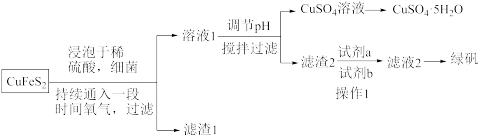
①有一种细菌在有氧气存在的稀硫酸中,可以将 氧化成硫酸盐,写出该反应的化学方程式:
氧化成硫酸盐,写出该反应的化学方程式:___________ 。
②若先加试剂a再加试剂b,则试剂a、b的化学式分别是___________ ;操作I需要用到的玻璃仪器名称是___________ 。
(1)A、B、C、D、E分别是铁或铁的化合物。E常用作制油漆、涂料的颜料。其相互反应关系如图所示:

根据如图所示变化,按要求回答下列问题:
①写出D的化学式
②向C的酸性溶液中加入
 生成B的离子方程式:
生成B的离子方程式:③E→A的化学方程式:
④C中加入
 溶液,看到的现象是
溶液,看到的现象是(2)利用黄铜矿粉(主要成分为
 )制取绿矾
)制取绿矾
①有一种细菌在有氧气存在的稀硫酸中,可以将
 氧化成硫酸盐,写出该反应的化学方程式:
氧化成硫酸盐,写出该反应的化学方程式:②若先加试剂a再加试剂b,则试剂a、b的化学式分别是
您最近半年使用:0次
【推荐3】 是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下
是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下

(1) 中
中 的化合价为
的化合价为____________ 。
(2)写出“反应”步骤中生成 的化学方程式
的化学方程式_________ 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去 和
和 、
、 ,要加入下列试剂,其中的顺序不正确的是
,要加入下列试剂,其中的顺序不正确的是__________ ,最后还需要加入的一种试剂为_________ 。
①加过量 溶液 ②加过量
溶液 ②加过量 溶液 ③加过量
溶液 ③加过量 溶液。
溶液。
A ③②① B ①③② C ③①② D ②①③
(4)“尾气吸收”是吸收“电解”过程排出的少量 。此吸收反应中,氧化剂与还原剂的物质的量之比为
。此吸收反应中,氧化剂与还原剂的物质的量之比为_________ 。
 是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下
是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下
(1)
 中
中 的化合价为
的化合价为(2)写出“反应”步骤中生成
 的化学方程式
的化学方程式(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去
 和
和 、
、 ,要加入下列试剂,其中的顺序不正确的是
,要加入下列试剂,其中的顺序不正确的是①加过量
 溶液 ②加过量
溶液 ②加过量 溶液 ③加过量
溶液 ③加过量 溶液。
溶液。A ③②① B ①③② C ③①② D ②①③
(4)“尾气吸收”是吸收“电解”过程排出的少量
 。此吸收反应中,氧化剂与还原剂的物质的量之比为
。此吸收反应中,氧化剂与还原剂的物质的量之比为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】海水中蕴藏着丰富的资源。除从海水中可制得食盐外,还可以制取镁、钾、溴及其化工产品。从海水中制取金属镁、溴的化工流程图如下:
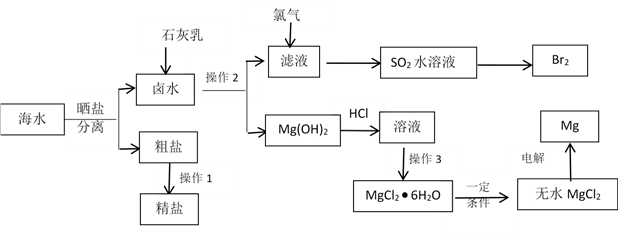
已知:MgO的熔点为2800℃,MgCl2的熔点为712℃。
回答下列问题:
(1)操作2的方法是_____________ ,操作3具体指_____________________ 。
(2)操作1粗盐精制主要是要除掉粗盐中的Ca2+、Mg2+、 离子,以下试剂合理的组合是
离子,以下试剂合理的组合是________
① 稀盐酸 ② NaOH ③ Na2CO3 ④ BaCl2
a.②③④① b.③②④① c.④②③① d.④③①②
(3)SO2水溶液可以起到富集溴的目的,该溶液吸收溴的离子反应方程式是____________ 。
(4)写出电解MgCl2制取Mg的化学方程式______________________ 。
(5)有同学认为:上述流程过于复杂,可直接加热Mg(OH)2得到MgO,再电解熔融的MgO制取金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?_______ (填“同意”或“不同意”),请说出你同意或不同意的理由____________________________ 。

已知:MgO的熔点为2800℃,MgCl2的熔点为712℃。
回答下列问题:
(1)操作2的方法是
(2)操作1粗盐精制主要是要除掉粗盐中的Ca2+、Mg2+、
 离子,以下试剂合理的组合是
离子,以下试剂合理的组合是① 稀盐酸 ② NaOH ③ Na2CO3 ④ BaCl2
a.②③④① b.③②④① c.④②③① d.④③①②
(3)SO2水溶液可以起到富集溴的目的,该溶液吸收溴的离子反应方程式是
(4)写出电解MgCl2制取Mg的化学方程式
(5)有同学认为:上述流程过于复杂,可直接加热Mg(OH)2得到MgO,再电解熔融的MgO制取金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】实验题。查阅资料知:Br2的沸点为58.8℃,密度为3.119g·cm-3微溶于水,有毒。
Ⅰ.(1)常温下,单质溴通常呈________ 态,保存时通常在盛溴的试剂瓶中加入少量__________ 。
Ⅱ.工业生产中,海水提取溴常用空气吹出法。其生产流程可用下图表示:
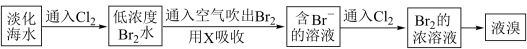
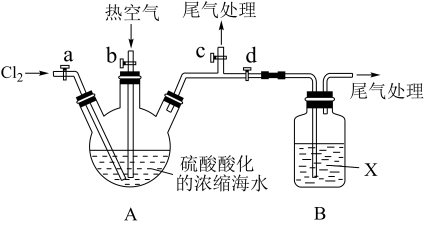
某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴
实验步骤如下:
① 关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
② 关闭a、c,打开b、d,向A中鼓入足量热空气;
③ 关闭b,打开a,再通过A向B中通入足量的Cl2;
④ 将B中所得液体进行蒸馏,收集液溴。
(2)当观察到A中液面上方出现_________ (实验现象)即可判断步骤①中反应已经结束。
(3)X试剂可以是_________ (填序号),尾气处理选用_________ (填序号)。
a.H2O b.饱和食盐水 c.氢氧化钠溶液 D.饱和Na2SO3溶液
B中X试剂发生反应的离子方程式为________________________ 。
(4)蒸馏时应该选择_________ ,操作中应控制的关键实验条件为__________________ 。
Ⅰ.(1)常温下,单质溴通常呈
Ⅱ.工业生产中,海水提取溴常用空气吹出法。其生产流程可用下图表示:
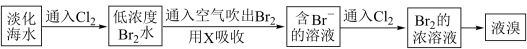
某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴

实验步骤如下:
① 关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
② 关闭a、c,打开b、d,向A中鼓入足量热空气;
③ 关闭b,打开a,再通过A向B中通入足量的Cl2;
④ 将B中所得液体进行蒸馏,收集液溴。
(2)当观察到A中液面上方出现
(3)X试剂可以是
a.H2O b.饱和食盐水 c.氢氧化钠溶液 D.饱和Na2SO3溶液
B中X试剂发生反应的离子方程式为
(4)蒸馏时应该选择

您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】我国海水制盐具有悠久的历史。从海水中制得的氯化钠除了供食用,还作为化工原料用于生产烧碱、纯碱、钠、氯气、盐酸等。从海水中制取镁、钾、溴及其他化工产品,就是在传统海水制盐工业的基础上发展起来的。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。
Ⅰ.与 有关的化工生产
有关的化工生产
(1)写出一种海水淡化的方法__________ ;由海水制粗盐属于__________ 变化;由 制备钠单质的冶炼方法为
制备钠单质的冶炼方法为__________ 。
(2) 可用于工业制备纯碱。我国化学家侯德榜利用物质在水中溶解性的差异,向饱和食盐水中先后通入足量
可用于工业制备纯碱。我国化学家侯德榜利用物质在水中溶解性的差异,向饱和食盐水中先后通入足量 和
和 产生
产生 白色沉淀,将沉淀加热分解即可制得纯碱。请写出侯式制碱法中产生白色沉淀的化学方程式
白色沉淀,将沉淀加热分解即可制得纯碱。请写出侯式制碱法中产生白色沉淀的化学方程式__________ 。
Ⅱ.海水提溴

(3)“吹出法”提溴是利用了溴的__________ 性。工业上进行第③步操作的目的是__________ 。
(4)若步骤③通入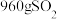 ,则理论上可产出
,则理论上可产出__________ 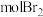 ,实际产出
,实际产出 的质量为
的质量为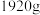 ,则
,则 的产率为
的产率为__________ (产率 )。
)。
Ⅲ.从海洋植物海带中提取碘的实验过程如图所示:
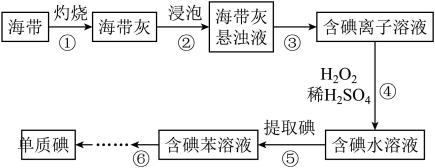
(5)步骤②是加入蒸馏水浸泡,浸泡时应将海带灰放入__________ (填仪器名称)中;步骤⑤提取碘后的水溶液中通常还含有少量碘单质,检验碘单质存在的方法和现象为__________ 。
Ⅰ.与
 有关的化工生产
有关的化工生产(1)写出一种海水淡化的方法
 制备钠单质的冶炼方法为
制备钠单质的冶炼方法为(2)
 可用于工业制备纯碱。我国化学家侯德榜利用物质在水中溶解性的差异,向饱和食盐水中先后通入足量
可用于工业制备纯碱。我国化学家侯德榜利用物质在水中溶解性的差异,向饱和食盐水中先后通入足量 和
和 产生
产生 白色沉淀,将沉淀加热分解即可制得纯碱。请写出侯式制碱法中产生白色沉淀的化学方程式
白色沉淀,将沉淀加热分解即可制得纯碱。请写出侯式制碱法中产生白色沉淀的化学方程式Ⅱ.海水提溴

(3)“吹出法”提溴是利用了溴的
(4)若步骤③通入
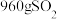 ,则理论上可产出
,则理论上可产出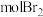 ,实际产出
,实际产出 的质量为
的质量为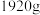 ,则
,则 的产率为
的产率为 )。
)。Ⅲ.从海洋植物海带中提取碘的实验过程如图所示:

(5)步骤②是加入蒸馏水浸泡,浸泡时应将海带灰放入
您最近半年使用:0次



