钾和碘的相关化合物在化工、医药、材料等领域有广泛应用。回答下列问题:
(1)含有K元素的盐的焰色试验呈紫色:
①基态K原子的核外电子排布式为______ 。
②基态K原子中,其核外电子占据最高能层的电子云轮廓图形状为_____ ,成对电子数与未成对电子数之比为______ 。
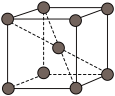
③钾晶体的结构模型如图,该晶体中存在的作用力为______ 。
(2)常温下,在一小试管中放入一小粒碘晶体(紫黑色),加入约5mL蒸馏水,观察到试管底部有少量紫黑色难溶物;将上层液体倾倒于另一试管中,加入约1mL四氯化碳(CCl4),振荡试管,观察到碘被四氯化碳萃取,形成紫红色的碘的四氯化碳溶液。再向试管中加入0.5mL浓碘化钾(KI)水溶液,振荡试管,溶液紫色变浅,发生的反应为I2+I- I
I 。
。
①CCl4属于_____ (填“极性”或“非极性”)分子。
②CCl4分子之间存在的作用力为_____ (填“氢键”或“范德华力”。
③大π键可用符号Π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π 。已知I
。已知I 中存在大π键,其可表示为
中存在大π键,其可表示为_____ 。
④X射线衍射线测定发现,I3AsF6中存在I 。0.5molI
。0.5molI 中的中心原子价(层)电子对数为
中的中心原子价(层)电子对数为_____ NA。(设NA为阿伏加德罗常数的值)
(1)含有K元素的盐的焰色试验呈紫色:
①基态K原子的核外电子排布式为
②基态K原子中,其核外电子占据最高能层的电子云轮廓图形状为

③钾晶体的结构模型如图,该晶体中存在的作用力为
(2)常温下,在一小试管中放入一小粒碘晶体(紫黑色),加入约5mL蒸馏水,观察到试管底部有少量紫黑色难溶物;将上层液体倾倒于另一试管中,加入约1mL四氯化碳(CCl4),振荡试管,观察到碘被四氯化碳萃取,形成紫红色的碘的四氯化碳溶液。再向试管中加入0.5mL浓碘化钾(KI)水溶液,振荡试管,溶液紫色变浅,发生的反应为I2+I-
 I
I 。
。①CCl4属于
②CCl4分子之间存在的作用力为
③大π键可用符号Π
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π 。已知I
。已知I 中存在大π键,其可表示为
中存在大π键,其可表示为④X射线衍射线测定发现,I3AsF6中存在I
 。0.5molI
。0.5molI 中的中心原子价(层)电子对数为
中的中心原子价(层)电子对数为
更新时间:2023-04-24 23:34:23
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】铁和硒(Se)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
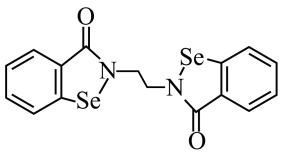
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如图:
①基态 原子的核外电子排布式为[Ar]
原子的核外电子排布式为[Ar]_______ 。
②该新药分子中有_______ 种不同化学环境的C原子。
③比较键角大小:气态SeO3分子_______ SeO 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是_______ 。
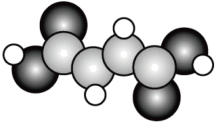
(2)富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中σ键与π键的数目比为_______ 。
②富马酸亚铁中各元素的电负性由大到小的顺序为_______ 。
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如图:

①基态
 原子的核外电子排布式为[Ar]
原子的核外电子排布式为[Ar]②该新药分子中有
③比较键角大小:气态SeO3分子
 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是(2)富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示:

①富马酸分子中σ键与π键的数目比为
②富马酸亚铁中各元素的电负性由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】依据原子结构知识回答下列问题。
(1)下列有关说法错误的是___________ 。
A.元素的电负性:P<O<F
B.在元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有两种
C.离子半径:S2->Ca2+>O2->Na+
D.原子的未成对电子数:Cr>Mn>Si>Cl
E.基态铝原子的核外电子有13种运动状态,占据的最高能级的电子云轮廓图的形状为球形。
(2)违反能量最低原理的是___________ (填序号,下同),违反洪特规则的是___________ ,违反泡利原理的是___________ 。
①Ge:1s22s22p63s23p63d104s24p2 ②F-:1s22s23p6③P: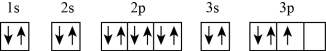
④Fe:1s22s22p63s23p63d64s2 ⑤Mg2+:1s22s22p6⑥C: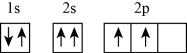
(3)下列硼原子电子排布图表示的状态中,能量最高的为___________(填选项字母)。
(4)①Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。

可知,Li原子的第一电离能为___________ kJ·mol-1,O=O键键能为___________ kJ·mol-1,Li2O晶格能为___________ kJ·mol-1。
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,分解温度较低的是___________ ,原因是___________ 。
(1)下列有关说法错误的是
A.元素的电负性:P<O<F
B.在元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有两种
C.离子半径:S2->Ca2+>O2->Na+
D.原子的未成对电子数:Cr>Mn>Si>Cl
E.基态铝原子的核外电子有13种运动状态,占据的最高能级的电子云轮廓图的形状为球形。
(2)违反能量最低原理的是
①Ge:1s22s22p63s23p63d104s24p2 ②F-:1s22s23p6③P:

④Fe:1s22s22p63s23p63d64s2 ⑤Mg2+:1s22s22p6⑥C:

(3)下列硼原子电子排布图表示的状态中,能量最高的为___________(填选项字母)。
A.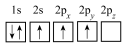 | B.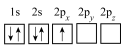 | C.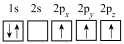 | D.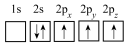 |

可知,Li原子的第一电离能为
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,分解温度较低的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】根据物质结构有关性质和特点,回答下列问题:
(1)Ti基态原子核外电子排布式为_____ 基态铝原子核外电子云形状有_________ (填名称)。
(2)丙烯腈(CH2=CH-CN)分子中α键和 键的个数比为
键的个数比为_____ ,分子中碳原子轨道的杂化类型是___
(3)写出与NH4+互为等电子体的一种分子和一种离子的化学式______ 、_______ 。
(4)钛存在两种同素异构体,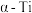 采纳六方最密堆积,
采纳六方最密堆积,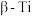 采纳体心立方堆积,鉴别两种钛晶体可以用
采纳体心立方堆积,鉴别两种钛晶体可以用_____ 法,由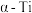 转变为
转变为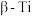 晶体体积
晶体体积_____ (填“膨胀”或“收缩”)。
(5)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________ 形象化描述。
(6)Cu与O元素形成的某种化合物的晶胞结构如图所示,晶胞中氧原子的配位数为____ ,若阿伏伽德罗常数为NA,晶胞的边长为a pm,该晶体的密度为__ g•cm﹣3.
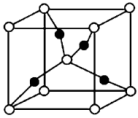
(1)Ti基态原子核外电子排布式为
(2)丙烯腈(CH2=CH-CN)分子中α键和
 键的个数比为
键的个数比为(3)写出与NH4+互为等电子体的一种分子和一种离子的化学式
(4)钛存在两种同素异构体,
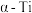 采纳六方最密堆积,
采纳六方最密堆积,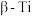 采纳体心立方堆积,鉴别两种钛晶体可以用
采纳体心立方堆积,鉴别两种钛晶体可以用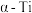 转变为
转变为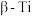 晶体体积
晶体体积(5)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
(6)Cu与O元素形成的某种化合物的晶胞结构如图所示,晶胞中氧原子的配位数为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】X、Y、Z、W、Q为原子序数依次增大的前四周期元素,X核外未成对电子数有2个,与其他元素均能形成二元化合物;Y是地壳中含量最多的金属元素;Z是遗传物质的组成元素之一;W内层电子数是最外层电子数的9倍;Q基态原子价层电子排布中成对电子数和未成对电子数相同,且成对电子数为最外层电子数的2倍。据此回答下列问题:
(1)Q的基态原子的价层电子排布式为___________________________ 。
(2)X、Y、Z、W四种元素中,电负性最大的是_________ (填元素符号,下同);同周期元素中,第一电高能介于Y 和Z之间的有__________________ 。
(3)Y 和W的氯化物熔点高的是______ (填化学式),原因是_____________________ ;与Z的低价氯化物互为等电子体的离子是_______ (填离子符号)。
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图所示。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是___________ ,分子中氮原子的杂化类型有___________________ 。

(5)已知WX的密度为3.25 g/cm3,单元晶胞边长481pm,经计算可确定该单元晶胞中含有____ 个WX,说明在形成晶体时,半径大的粒子先进行了_______ 方式的堆积,晶胞中距离W最近的X有_____ 个。
(1)Q的基态原子的价层电子排布式为
(2)X、Y、Z、W四种元素中,电负性最大的是
(3)Y 和W的氯化物熔点高的是
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图所示。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是

(5)已知WX的密度为3.25 g/cm3,单元晶胞边长481pm,经计算可确定该单元晶胞中含有
您最近一年使用:0次



