高锰酸钾在化工生产和环境保护等领域应用十分广泛。以软锰矿(主要成分是MnO2,含有Fe2O3和SiO2等杂质)为原料制备高锰酸钾的工艺流程如图:
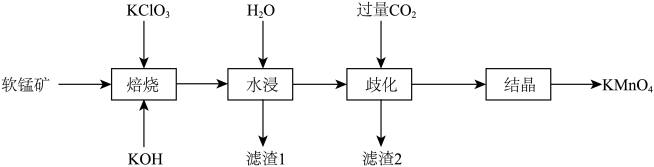
回答下列问题:
(1)基态Mn原子的价电子轨道表示式为______ 。
(2)“焙烧”中有K2MnO4生成,该步骤主要反应的化学方程式为_______ 。
(3)若“焙烧”时未加入KClO3,“水浸”后所得溶液中也含有K2MnO4,原因可能是______ 。
(4)“水浸”时需要加热,其目的是______ 。
(5)“滤渣2”含有MnO2和______ ,“歧化”过程中主要反应的离子方程式为_____ 。
(6)KMnO4可通过电解K2MnO4溶液的方法直接制得,相比“歧化法”,电解法的优点是______ 。

回答下列问题:
(1)基态Mn原子的价电子轨道表示式为
(2)“焙烧”中有K2MnO4生成,该步骤主要反应的化学方程式为
(3)若“焙烧”时未加入KClO3,“水浸”后所得溶液中也含有K2MnO4,原因可能是
(4)“水浸”时需要加热,其目的是
(5)“滤渣2”含有MnO2和
(6)KMnO4可通过电解K2MnO4溶液的方法直接制得,相比“歧化法”,电解法的优点是
更新时间:2023-05-29 11:54:03
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】查阅资料,在酸性溶液中SO2也能发生歧化反应,方程式为3SO2+2H2O=2H2SO4+S↓,已知I-可以作为水溶液中SO2歧化反应的催化剂,催化过程分两个步骤进行。
(1)请写出步骤ⅰ的离子反应方程式:
ⅰ.___________
ⅱ.I2+2H2O+SO2=SO +4H++2I-
+4H++2I-
(2)为探究SO2歧化反应速率的影响因素,在常温下,设计实验如下:
①根据上表分析,V2=___________ mL。
②比较实验Ⅰ、Ⅱ、Ⅲ,可得出H2SO4对该反应速率的影响是:___________ 。
③已知实验Ⅳ是为探究SO2浓度对反应速率的影响,结合浑浊的时间你认为V3、V4分别为___________ 。
A.V3=0、V4=2 B.V3=2、V4=0 C.V3=2、V4=4 D.V3=0、V4=6
④已知刚出现浑浊时硫的质量为0.24g,求实验Ⅰ从开始到刚出现浑浊这段时间,以SO 浓度变化表示的速率v(SO
浓度变化表示的速率v(SO )=
)=___________ 。
⑤实验Ⅱ时,在混合溶液中加入淀粉,发现整个过程没观察到蓝色,请结合步骤i,ii反应速率大小解释其原因___________ 。
(3)将3SO2+2H2O=2H2SO4+S↓,设计成一个电解池用于回收利用废气中的SO2,装置如图所示,电极均为惰性电极。
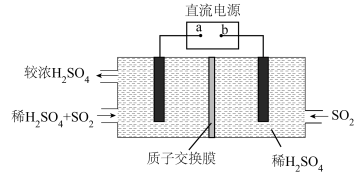
①a为电源的___________ 极;写出阴极的电极反应式___________ ;
②当阴、阳两极共处理0.6molSO2时,通过质子交换膜的离子数目为___________ 。
(1)请写出步骤ⅰ的离子反应方程式:
ⅰ.
ⅱ.I2+2H2O+SO2=SO
 +4H++2I-
+4H++2I-(2)为探究SO2歧化反应速率的影响因素,在常温下,设计实验如下:
| 实验编号 | SO2饱和溶液 | 0.4 mol·L-1 KI | 0.2 mol·L-1 H2SO4 | H2O | 现象 |
| Ⅰ | 10mL | 4mL | 0 | 6mL | 15秒出现浑浊 |
| Ⅱ | 10mL | 4mL | 2ml | V1mL | 10秒出现浑浊 |
| Ⅲ | 10mL | 0 | 2ml | V2mL | 长时间未见浑浊 |
| Ⅳ | 14mL | 4mL | V3ml | V4mL | 12秒出现浑浊 |
②比较实验Ⅰ、Ⅱ、Ⅲ,可得出H2SO4对该反应速率的影响是:
③已知实验Ⅳ是为探究SO2浓度对反应速率的影响,结合浑浊的时间你认为V3、V4分别为
A.V3=0、V4=2 B.V3=2、V4=0 C.V3=2、V4=4 D.V3=0、V4=6
④已知刚出现浑浊时硫的质量为0.24g,求实验Ⅰ从开始到刚出现浑浊这段时间,以SO
 浓度变化表示的速率v(SO
浓度变化表示的速率v(SO )=
)=⑤实验Ⅱ时,在混合溶液中加入淀粉,发现整个过程没观察到蓝色,请结合步骤i,ii反应速率大小解释其原因
(3)将3SO2+2H2O=2H2SO4+S↓,设计成一个电解池用于回收利用废气中的SO2,装置如图所示,电极均为惰性电极。

①a为电源的
②当阴、阳两极共处理0.6molSO2时,通过质子交换膜的离子数目为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】钻钼系催化剂主要用于石油炼制等工艺,从废钴铝催化剂(主要含有 和
和 ,少量
,少量 、
、 的化合物)制备仲钼酸铵的工艺流程图如下:
的化合物)制备仲钼酸铵的工艺流程图如下:
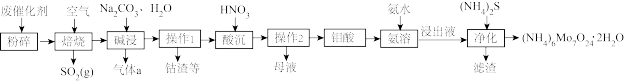
资料:1.氧化钼 :熔点795℃,易升华(即使在低于熔点情况下,也有显著的升华现象)。
:熔点795℃,易升华(即使在低于熔点情况下,也有显著的升华现象)。
2.钼酸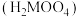 :难溶于水和酸的黄色晶体,可通过酸化铝酸盐溶液而制得。
:难溶于水和酸的黄色晶体,可通过酸化铝酸盐溶液而制得。
(1)仲钼酸铵 中钼元素的化合价是
中钼元素的化合价是_______ 。
(2)废催化剂“焙烧”时 转化为氧化钼,写出反应的化学方程式
转化为氧化钼,写出反应的化学方程式_______ 。
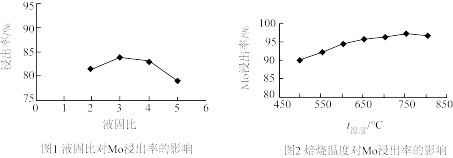
(3)钼浸取率随碱浸液固比、焙烧温度如图1和图2所示
①综合考虑,制备工艺中选择的最佳液固比值和焙烧温度分别是:_______ 。
②铝浸取率随焙烧温度变化的原因是_______ 。
(4)操作1和操作2的名称_______ ,“酸沉”过程中反应的离子方程式为_______ 。
(5)“净化”时,浸出液中残留的 、
、 转化为硫化物沉淀除去。已知
转化为硫化物沉淀除去。已知 ,该溶液中
,该溶液中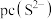 和pH的关系为:
和pH的关系为: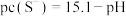 。为了使溶液中的杂质离子浓度小于
。为了使溶液中的杂质离子浓度小于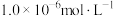 ,应控制溶液的pH不小于
,应控制溶液的pH不小于_______ 已知: ;
; 和
和 的
的 分别为35.2和17.2)。
分别为35.2和17.2)。
 和
和 ,少量
,少量 、
、 的化合物)制备仲钼酸铵的工艺流程图如下:
的化合物)制备仲钼酸铵的工艺流程图如下:
资料:1.氧化钼
 :熔点795℃,易升华(即使在低于熔点情况下,也有显著的升华现象)。
:熔点795℃,易升华(即使在低于熔点情况下,也有显著的升华现象)。2.钼酸
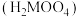 :难溶于水和酸的黄色晶体,可通过酸化铝酸盐溶液而制得。
:难溶于水和酸的黄色晶体,可通过酸化铝酸盐溶液而制得。(1)仲钼酸铵
 中钼元素的化合价是
中钼元素的化合价是(2)废催化剂“焙烧”时
 转化为氧化钼,写出反应的化学方程式
转化为氧化钼,写出反应的化学方程式(3)钼浸取率随碱浸液固比、焙烧温度如图1和图2所示
①综合考虑,制备工艺中选择的最佳液固比值和焙烧温度分别是:
②铝浸取率随焙烧温度变化的原因是

(4)操作1和操作2的名称
(5)“净化”时,浸出液中残留的
 、
、 转化为硫化物沉淀除去。已知
转化为硫化物沉淀除去。已知 ,该溶液中
,该溶液中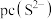 和pH的关系为:
和pH的关系为: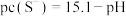 。为了使溶液中的杂质离子浓度小于
。为了使溶液中的杂质离子浓度小于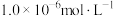 ,应控制溶液的pH不小于
,应控制溶液的pH不小于 ;
; 和
和 的
的 分别为35.2和17.2)。
分别为35.2和17.2)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】重铬酸钾( )是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为
)是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为 ,还含有
,还含有 、
、 等杂质。制备流程如图所示:
等杂质。制备流程如图所示:
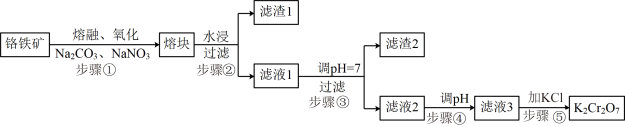
已知:步骤①高温下的主反应为: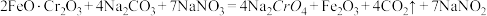
(1)滤渣1的主要成分是___________ 。
(2)步骤④调节pH时发生的离子方程式为___________ 。
(3)下列说法不正确 的是___________。
(4)步骤⑤加入KCl后,还需经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,洗涤 粗产品时可选择___________。
粗产品时可选择___________。
(5)测定产品的纯度
 (摩尔质量:294g/mol)的定量测定:称取0.3750g样品,加水溶解配制250mL溶液,移取25mL溶液于锥形瓶中,加入适量的硫酸和足量的KI溶液,充分反应后加入几滴淀粉溶液,然后用
(摩尔质量:294g/mol)的定量测定:称取0.3750g样品,加水溶解配制250mL溶液,移取25mL溶液于锥形瓶中,加入适量的硫酸和足量的KI溶液,充分反应后加入几滴淀粉溶液,然后用
 标准液进行滴定。上述过程平行测试3次,平均消耗的
标准液进行滴定。上述过程平行测试3次,平均消耗的 溶液的体积为22.50mL。已知:
溶液的体积为22.50mL。已知: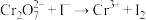 ,
, (未配平)。
(未配平)。
① 的纯度为
的纯度为___________ 。
②上述操作都正确,但实际测得的 纯度偏高,可能的原因是
纯度偏高,可能的原因是___________ 。
 )是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为
)是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为 ,还含有
,还含有 、
、 等杂质。制备流程如图所示:
等杂质。制备流程如图所示:
已知:步骤①高温下的主反应为:
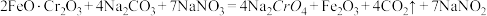
| 常见物质的溶解度 | |||
| 物质 | 0℃(g) | 40℃(g) | 80℃(g) |
| KCl | 28.0 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38.0 |
 | 4.7 | 26.3 | 73 |
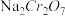 | 163 | 215 | 375 |
(1)滤渣1的主要成分是
(2)步骤④调节pH时发生的离子方程式为
(3)下列说法
| A.步骤①可在陶瓷容器中进行 |
| B.为了加快步骤②中的过滤速度,可用玻璃棒小心翻动沉淀 |
| C.步骤③的目的是使杂质离子转化为沉淀而除去 |
| D.步骤⑤加入KCl后发生的是复分解反应 |
(4)步骤⑤加入KCl后,还需经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,洗涤
 粗产品时可选择___________。
粗产品时可选择___________。| A.冷水 | B.饱和氯化钾溶液 | C.热水 | D.冷的酒精 |
(5)测定产品的纯度
 (摩尔质量:294g/mol)的定量测定:称取0.3750g样品,加水溶解配制250mL溶液,移取25mL溶液于锥形瓶中,加入适量的硫酸和足量的KI溶液,充分反应后加入几滴淀粉溶液,然后用
(摩尔质量:294g/mol)的定量测定:称取0.3750g样品,加水溶解配制250mL溶液,移取25mL溶液于锥形瓶中,加入适量的硫酸和足量的KI溶液,充分反应后加入几滴淀粉溶液,然后用
 标准液进行滴定。上述过程平行测试3次,平均消耗的
标准液进行滴定。上述过程平行测试3次,平均消耗的 溶液的体积为22.50mL。已知:
溶液的体积为22.50mL。已知: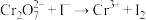 ,
, (未配平)。
(未配平)。①
 的纯度为
的纯度为②上述操作都正确,但实际测得的
 纯度偏高,可能的原因是
纯度偏高,可能的原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】利用钻渣[含Co(OH)2、Fe2O3、Al2O3、MnO等)可以来制取钻的氧化物和CoCl2·6H2O,工艺流程如图所示:
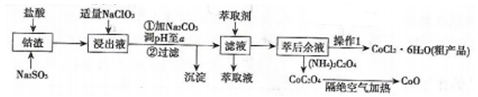
①部分阳离于以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
②CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
回答下列问题:
(1)浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等,浸出过程中Co(OH)3发生反应的离子方程式为________ 。
(2)流程中加入适量的NaClO3的作用是___________ 。若加入NaClO3过量,可能产生有毒气体,写出生成该有毒气体的离子方程式___________________ 。
(3)加入Na2CO3调节溶液的pH=a,a的范围最好是___________ 。沉淀的主要成分是______ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。向“滤液”中加入萃取剂的目的是________ ;其使用的最佳pH范围是________ 。
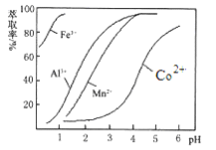
A. 2.0~2.5 B. 3.0~3.5 C. 4.0~4.5 D. 5.0~5.5
(5)“操作1”中包含3个基本实验操作,它们依次是______ 、______ 和过滤。
(6)隔绝空气加热CoC2O4生成CoO和碳的氧化物,对应的化学方程式为_______________ 。

①部分阳离于以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
②CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
回答下列问题:
(1)浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等,浸出过程中Co(OH)3发生反应的离子方程式为
(2)流程中加入适量的NaClO3的作用是
(3)加入Na2CO3调节溶液的pH=a,a的范围最好是
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。向“滤液”中加入萃取剂的目的是

A. 2.0~2.5 B. 3.0~3.5 C. 4.0~4.5 D. 5.0~5.5
(5)“操作1”中包含3个基本实验操作,它们依次是
(6)隔绝空气加热CoC2O4生成CoO和碳的氧化物,对应的化学方程式为
您最近一年使用:0次
【推荐2】CuCl是一种重要的化工原料和广泛应用的催化剂,它难溶于水,不溶于乙醇。现用低品位铜矿石(主要成分CuS、Cu2S、CuO,杂质为Fe2O3、FeO、SiO2等),制备CuCl的工业流程如下:
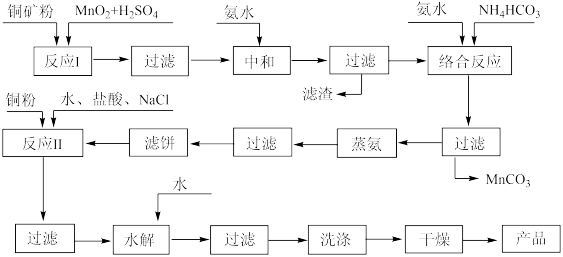
已知:
I.铜盐溶液中加入NH3·H2O和NH4HCO3,可形成配合物Cu(NH3)4CO3
II.在该工艺条件下,生成氢氧化物沉淀的pH范围如下表所示:
回答下列问题
(1)提高矿石浸取率的方法有___________ (任写两种)。
(2)反应I生成的滤渣中有S,写出其中Cu2S参与反应的离子方程式___________ 。
(3)加氨水中和溶液pH应为___________ 。滤饼为黑色固体,其成分含两种元素的质量比为4:1,通过反应II可生成[CuCl2]-,写出此过程的化学方程式___________ 。
(4)根据下图表中数据,加入盐酸与氯化钠适合的条件为___________ 。
NaCl加入量与CuCl产率的关系
HCl加入量与CuCl产率的关系
(5)水解后洗涤沉淀选用的试剂为___________ ,整个流程中能循环使用的物质是___________ 。
(6)100t含铜a%的铜矿石,经流程制备出bt的CuCl,生成CuCl的产率为___________ 。(用含有a、b的代数式表示)

已知:
I.铜盐溶液中加入NH3·H2O和NH4HCO3,可形成配合物Cu(NH3)4CO3
II.在该工艺条件下,生成氢氧化物沉淀的pH范围如下表所示:
| 氢氧化物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀的pH | 7.7 | 6.5 | 1.1 | 4.2 |
| 沉淀完全的pH | 10.4 | 8.96 | 3.3 | 6.7 |
回答下列问题
(1)提高矿石浸取率的方法有
(2)反应I生成的滤渣中有S,写出其中Cu2S参与反应的离子方程式
(3)加氨水中和溶液pH应为
(4)根据下图表中数据,加入盐酸与氯化钠适合的条件为
NaCl加入量与CuCl产率的关系
| NaCl过量(%) | CuCl产率(%) | NaCl过量(%) | CuCl产率(%) |
| 0 | 78 | 10 | 95 |
| 5 | 86 | - | - |
HCl加入量与CuCl产率的关系
| HCl过量(%) | CuCl产率(%) | HCl过量(%) | CuCl产率(%) |
| 0 | 65 | 10 | 88 |
| 5 | 76 | 15 | 95 |
(5)水解后洗涤沉淀选用的试剂为
(6)100t含铜a%的铜矿石,经流程制备出bt的CuCl,生成CuCl的产率为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】高砷烟尘(主要成分有 、PbO、
、PbO、 、ZnO、
、ZnO、 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 和金属铟的工业流程如下:
和金属铟的工业流程如下: 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;
② 在90℃~95℃易分解为
在90℃~95℃易分解为 ,
, 难溶于水;
难溶于水;
③ 。
。
回答下列问题:
(1)“高压酸浸”时,As的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,As的浸出率随硫酸浓度增大而略微减小的原因可能为
时,As的浸出率随硫酸浓度增大而略微减小的原因可能为________ ,滤渣的主要成分为________ (填化学式)。 ,发生反应的离子方程式为
,发生反应的离子方程式为________ 。已知 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为
 ,
, 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
________ 。
(3)“还原”后溶液酸性增强,主要原因是________ (用离子方程式表示)。
(4)“结晶”操作为________ 、过滤、洗涤、干燥。
(5)“萃余液”中含有的金属阳离子为________ (填离子符号),将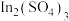 溶液电解得到金属钢,阴极的电极反应式为
溶液电解得到金属钢,阴极的电极反应式为________ 。
 、PbO、
、PbO、 、ZnO、
、ZnO、 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 和金属铟的工业流程如下:
和金属铟的工业流程如下:
 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;②
 在90℃~95℃易分解为
在90℃~95℃易分解为 ,
, 难溶于水;
难溶于水;③
 。
。回答下列问题:
(1)“高压酸浸”时,As的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
 时,As的浸出率随硫酸浓度增大而略微减小的原因可能为
时,As的浸出率随硫酸浓度增大而略微减小的原因可能为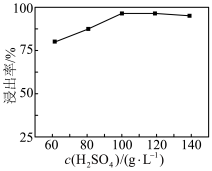
 ,发生反应的离子方程式为
,发生反应的离子方程式为 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为
 ,
, 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
(3)“还原”后溶液酸性增强,主要原因是
(4)“结晶”操作为
(5)“萃余液”中含有的金属阳离子为
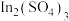 溶液电解得到金属钢,阴极的电极反应式为
溶液电解得到金属钢,阴极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某工厂利用此矿石炼制精铜的工艺流程如图所示(已知:Cu2O+2H+===Cu+Cu2++H2O)。
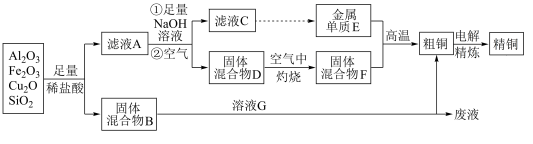
(1)滤液A中铁元素的存在形式为________________ (填离子符号),生成该离子的离子方程式为____________________________ ,检验滤液A中存在该离子的试剂为__________________ 。
(2)溶液G与固体混合物B反应的离子方程式为__________________________________________________ 。
(3)将Na2CO3溶液滴入到一定量的CuCl2溶液中,得到氯化钠、二氧化碳和一种绿色的不溶于水的盐(不含结晶水),该盐受热分解产生三种氧化物,则该盐的化学式是____________ 。

(1)滤液A中铁元素的存在形式为
(2)溶液G与固体混合物B反应的离子方程式为
(3)将Na2CO3溶液滴入到一定量的CuCl2溶液中,得到氯化钠、二氧化碳和一种绿色的不溶于水的盐(不含结晶水),该盐受热分解产生三种氧化物,则该盐的化学式是
您最近一年使用:0次
【推荐2】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)已知:2C(s)+O2(g)=2CO(g) ΔH1=-221 kJ·molˉ1
4Al(g)+3O2(g) =2Al2O3(s) ΔH2=-3351 kJ·molˉ1
2Al(g)+N2(g)=2AlN(s) ΔH3=-318 kJ·molˉ1
碳热还原Al2O3合成 AlN 的总热化学方程式是___________________ ;
(2) “亚硫酸盐法”吸收烟气中的SO2,室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。
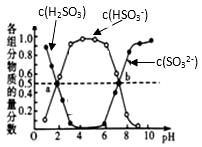
请写出a点时n(HSO3-)∶n(H2SO3)=______ ,b点时溶液pH=7,则n(NH4+)∶n(HSO3-)=______ ;
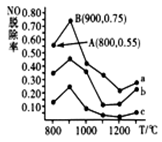
(3)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为:4NH3+6NO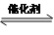 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4∶l、3∶l、1∶3时,得到NO脱除率曲线如图所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4∶l、3∶l、1∶3时,得到NO脱除率曲线如图所示:
①请写出N2的电子式________ ;
② 曲线c对应NH3与NO的物质的量之比是______ ;
③曲线a中NO的起始浓度为6×10-4mg·m-3,从A点到B点经过0.8s,该时间段内NO的脱除速率为___________ mg·m-3·s-1;
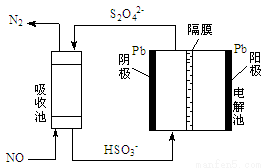
(4)间接电化学法可除NO。其原理如上右图所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性)__________________ 。
(1)已知:2C(s)+O2(g)=2CO(g) ΔH1=-221 kJ·molˉ1
4Al(g)+3O2(g) =2Al2O3(s) ΔH2=-3351 kJ·molˉ1
2Al(g)+N2(g)=2AlN(s) ΔH3=-318 kJ·molˉ1
碳热还原Al2O3合成 AlN 的总热化学方程式是
(2) “亚硫酸盐法”吸收烟气中的SO2,室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。

请写出a点时n(HSO3-)∶n(H2SO3)=
(3)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为:4NH3+6NO
 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4∶l、3∶l、1∶3时,得到NO脱除率曲线如图所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4∶l、3∶l、1∶3时,得到NO脱除率曲线如图所示:
①请写出N2的电子式
② 曲线c对应NH3与NO的物质的量之比是
③曲线a中NO的起始浓度为6×10-4mg·m-3,从A点到B点经过0.8s,该时间段内NO的脱除速率为
(4)间接电化学法可除NO。其原理如上右图所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性)

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】工业上利用氧化铝基废催化剂(主要成分为Al2O3,还含有少量Pd)回收Al2(SO4)3及Pd的流程如下:
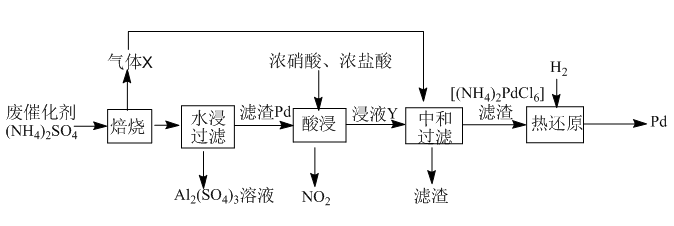
(1)Al2(SO4)3溶液蒸干灼烧后所得物质的化学名称是___________ 。
(2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为___________ 。
水浸与中和步骤得到溶液的操作方法是___________ 。
(3)浸液Y中含Pd元素的溶质是___________ (填化学式)。
(4)“热还原”中每生成1molPd生成的气体的物质的量为___________ (已知热还原得到的固体只有Pd)。
(5)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)==2PdHx(s),其中x的最大值为0.8。已知: Pd的密度为12g·cm-3, 则10.6cm3Pd能储存标准状况下H2的最大体积为___________ L。
(6)铝的阳极氧化法是将铝作为阳极,置于硫酸等电解液中,加入α-羟基丙酸、丙三醇后进行电解,可观察到铝的表面会形成一层致密的氧化膜。
①写出电解时阳极的电极反应式:______________________ 。
②电解过程中α-羟基丙酸、丙三醇的作用可能是______________________ 。

(1)Al2(SO4)3溶液蒸干灼烧后所得物质的化学名称是
(2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为
水浸与中和步骤得到溶液的操作方法是
(3)浸液Y中含Pd元素的溶质是
(4)“热还原”中每生成1molPd生成的气体的物质的量为
(5)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)==2PdHx(s),其中x的最大值为0.8。已知: Pd的密度为12g·cm-3, 则10.6cm3Pd能储存标准状况下H2的最大体积为
(6)铝的阳极氧化法是将铝作为阳极,置于硫酸等电解液中,加入α-羟基丙酸、丙三醇后进行电解,可观察到铝的表面会形成一层致密的氧化膜。
①写出电解时阳极的电极反应式:
②电解过程中α-羟基丙酸、丙三醇的作用可能是
您最近一年使用:0次
【推荐1】2022年4月16日,中国空间站的3名航天员乘神舟十三号载人飞船平安返回地球。空间站处理CO2的一种重要方法是对CO2进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
I.固态胺吸收与浓缩CO2
在水蒸气存在下固态胺吸收CO2反应生成酸式碳酸盐(该反应是放热反应),再解吸出CO2的简单方法是加热。
II.CO2的加氢甲烷化
H2还原CO2制CH4的部分反应如下:
i.CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41kJ•mol-1
CO(g)+H2O(g) △H1=+41kJ•mol-1
ii.CO(g)+3H2(g) CH4(g)+H2O(g) △H2=-246kJ•mol-1
CH4(g)+H2O(g) △H2=-246kJ•mol-1
(1)反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的△H=
CH4(g)+2H2O(g)的△H=________ kJ•mol-1。
(2)有利于提高甲烷平衡产率的反应条件是________ (写一种)。
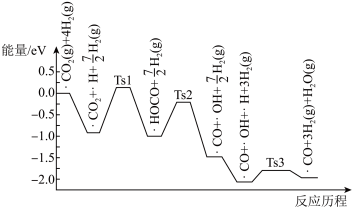
(3)科学家研究在催化剂表面上CO2与H2的反应,前三步历程如图所示,吸附在催化剂表面上的物种用“•”标注,Ts表示过渡态。下列说法中一定正确的是________ (填字母)。
(4)控制起始时 =4,p=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
=4,p=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
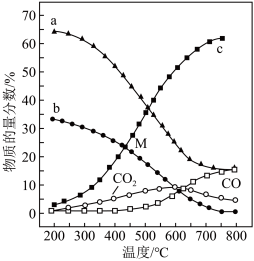
①图中代表CH4的曲线是_______ (填“a”、“b”或“c”);温度低于500℃时,CO的物质的量分数约为0,说明此条件下,反应_______ (填“i”或“ii”)化学平衡常数大,反应完全。
②M点(T<500℃)时,平衡分压p(CO2)=_______ atm,反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的平衡常数Kp=
CH4(g)+2H2O(g)的平衡常数Kp=_______ atm-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
III.CO2甲烷化生成的H2O电解再生氧气。
(5)电解时阳极产生O2的电极反应式为_______ 。
I.固态胺吸收与浓缩CO2
在水蒸气存在下固态胺吸收CO2反应生成酸式碳酸盐(该反应是放热反应),再解吸出CO2的简单方法是加热。
II.CO2的加氢甲烷化
H2还原CO2制CH4的部分反应如下:
i.CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+41kJ•mol-1
CO(g)+H2O(g) △H1=+41kJ•mol-1ii.CO(g)+3H2(g)
 CH4(g)+H2O(g) △H2=-246kJ•mol-1
CH4(g)+H2O(g) △H2=-246kJ•mol-1(1)反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的△H=
CH4(g)+2H2O(g)的△H=(2)有利于提高甲烷平衡产率的反应条件是
(3)科学家研究在催化剂表面上CO2与H2的反应,前三步历程如图所示,吸附在催化剂表面上的物种用“•”标注,Ts表示过渡态。下列说法中一定正确的是

| A.第一步历程中只发生了非极性共价键的断裂 |
| B.该转化反应的速率取决于Ts1的能垒 |
| C.•HOCO转化为•CO和•OH的反应△H<0 |
| D.催化剂参与化学反应,能降低反应的活化能,提高反应物的平衡转化率 |
(4)控制起始时
 =4,p=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
=4,p=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
①图中代表CH4的曲线是
②M点(T<500℃)时,平衡分压p(CO2)=
 CH4(g)+2H2O(g)的平衡常数Kp=
CH4(g)+2H2O(g)的平衡常数Kp=III.CO2甲烷化生成的H2O电解再生氧气。
(5)电解时阳极产生O2的电极反应式为
您最近一年使用:0次
【推荐2】有效去除大气中的 是环境保护的重要课题。
是环境保护的重要课题。
(1)用水吸收 的相关热化学方程式如下:
的相关热化学方程式如下:
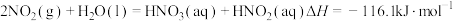
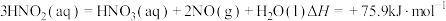
反应 的
的
___________  。
。
(2)用稀硝酸吸收 ,得到
,得到 和
和 的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式:
的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式:___________ 。( 是弱酸)
是弱酸)
(3)用酸性 水溶液吸收
水溶液吸收 ,吸收过程中存在
,吸收过程中存在 与
与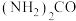 生成
生成 和
和 的反应,写出该反应的化学方程式:
的反应,写出该反应的化学方程式:___________ 。
(4)在有氧条件下,新型催化剂 能催化
能催化 与
与 反应生成
反应生成 。
。
① 与
与 生成
生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为___________  。
。
②将一定比例的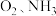 和
和 的混合气体,匀速通入装有催化剂
的混合气体,匀速通入装有催化剂 的反应器中反应(装置见图):
的反应器中反应(装置见图): 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在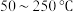 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后缓慢上升的主要原因是
的去除率先迅速上升后缓慢上升的主要原因是___________ 。 (氯的化合价为
(氯的化合价为 价),其原理是
价),其原理是
 接电源的
接电源的___________ (填“正”或“负”)极。
②阳极反应式是___________ 。
 是环境保护的重要课题。
是环境保护的重要课题。(1)用水吸收
 的相关热化学方程式如下:
的相关热化学方程式如下: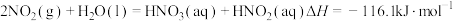
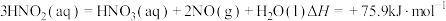
反应
 的
的
 。
。(2)用稀硝酸吸收
 ,得到
,得到 和
和 的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式:
的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式: 是弱酸)
是弱酸)(3)用酸性
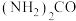 水溶液吸收
水溶液吸收 ,吸收过程中存在
,吸收过程中存在 与
与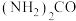 生成
生成 和
和 的反应,写出该反应的化学方程式:
的反应,写出该反应的化学方程式:(4)在有氧条件下,新型催化剂
 能催化
能催化 与
与 反应生成
反应生成 。
。①
 与
与 生成
生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为 。
。②将一定比例的
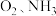 和
和 的混合气体,匀速通入装有催化剂
的混合气体,匀速通入装有催化剂 的反应器中反应(装置见图):
的反应器中反应(装置见图):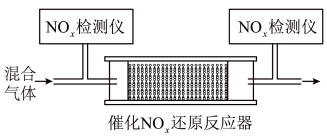
 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在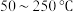 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后缓慢上升的主要原因是
的去除率先迅速上升后缓慢上升的主要原因是
 (氯的化合价为
(氯的化合价为 价),其原理是
价),其原理是
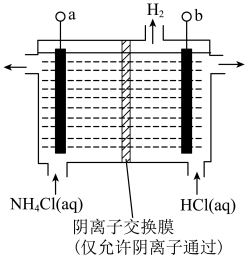
 接电源的
接电源的②阳极反应式是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I. 高炉炼铁是冶炼铁的主要方法,发生的主要反应为: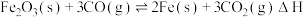
已知:① 石墨
石墨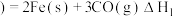
②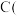 石墨
石墨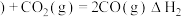 ,
,
(1)则
________ (用含 、
、 代数式表示)
代数式表示)
Ⅱ.已知 在不同温度下的平衡常数如表:
在不同温度下的平衡常数如表:
请回答下列问题:
(2)该反应的平衡常数表达式
_______ ,
______ 0(填“ ”、“
”、“ ”或“
”或“ ”)
”)
(3)在一个容积为 的密闭容器中,
的密闭容器中,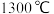 时加入
时加入  、
、 各
各 ,反应经过
,反应经过 后达到平衡,则
后达到平衡,则 的平衡转化率为
的平衡转化率为 _______ 。若维持条件不变向该容器中投入1molFe2O3、1molCO、1molFe、5molCO2,判断平衡移动的方向_______ (填“正向移动”“逆向移动”或“不移动”)
(4)欲提高 的平衡转化率促进
的平衡转化率促进 的转化可采取的措施是
的转化可采取的措施是 _______ 。
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂
d.及时吸收或移出部分 e.粉碎矿石使其与平衡混合气体充分接触
e.粉碎矿石使其与平衡混合气体充分接触
Ⅲ. 如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡。试回答:
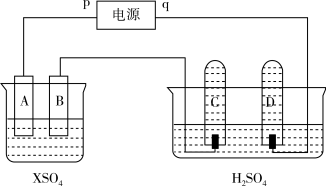
(5)C为_______ 极
(6)当电路中通过0.004mol电子时,B电极上沉积金属X为0.128g,则此金属的摩尔质量为_______ 。
I. 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
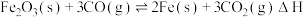
已知:①
 石墨
石墨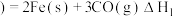
②
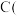 石墨
石墨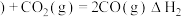 ,
,(1)则

 、
、 代数式表示)
代数式表示) Ⅱ.已知
 在不同温度下的平衡常数如表:
在不同温度下的平衡常数如表:温度 |  | 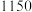 | 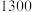 |
| 平衡常数 | 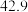 |  | 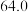 |
(2)该反应的平衡常数表达式


 ”、“
”、“ ”或“
”或“ ”)
”)(3)在一个容积为
 的密闭容器中,
的密闭容器中,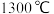 时加入
时加入  、
、 各
各 ,反应经过
,反应经过 后达到平衡,则
后达到平衡,则 的平衡转化率为
的平衡转化率为 (4)欲提高
 的平衡转化率促进
的平衡转化率促进 的转化可采取的措施是
的转化可采取的措施是 a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂
d.及时吸收或移出部分
 e.粉碎矿石使其与平衡混合气体充分接触
e.粉碎矿石使其与平衡混合气体充分接触Ⅲ. 如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡。试回答:

(5)C为
(6)当电路中通过0.004mol电子时,B电极上沉积金属X为0.128g,则此金属的摩尔质量为
您最近一年使用:0次



