钻钼系催化剂主要用于石油炼制等工艺,从废钴铝催化剂(主要含有 和
和 ,少量
,少量 、
、 的化合物)制备仲钼酸铵的工艺流程图如下:
的化合物)制备仲钼酸铵的工艺流程图如下:
资料:1.氧化钼 :熔点795℃,易升华(即使在低于熔点情况下,也有显著的升华现象)。
:熔点795℃,易升华(即使在低于熔点情况下,也有显著的升华现象)。
2.钼酸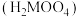 :难溶于水和酸的黄色晶体,可通过酸化铝酸盐溶液而制得。
:难溶于水和酸的黄色晶体,可通过酸化铝酸盐溶液而制得。
(1)仲钼酸铵 中钼元素的化合价是
中钼元素的化合价是_______ 。
(2)废催化剂“焙烧”时 转化为氧化钼,写出反应的化学方程式
转化为氧化钼,写出反应的化学方程式_______ 。
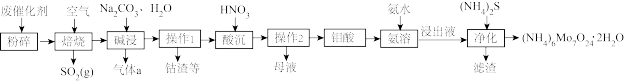
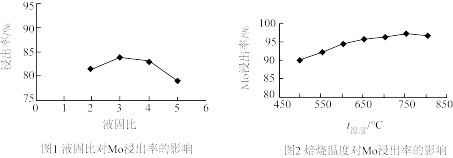
(3)钼浸取率随碱浸液固比、焙烧温度如图1和图2所示
①综合考虑,制备工艺中选择的最佳液固比值和焙烧温度分别是:_______ 。
②铝浸取率随焙烧温度变化的原因是_______ 。
(4)操作1和操作2的名称_______ ,“酸沉”过程中反应的离子方程式为_______ 。
(5)“净化”时,浸出液中残留的 、
、 转化为硫化物沉淀除去。已知
转化为硫化物沉淀除去。已知 ,该溶液中
,该溶液中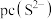 和pH的关系为:
和pH的关系为: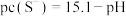 。为了使溶液中的杂质离子浓度小于
。为了使溶液中的杂质离子浓度小于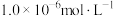 ,应控制溶液的pH不小于
,应控制溶液的pH不小于_______ 已知: ;
; 和
和 的
的 分别为35.2和17.2)。
分别为35.2和17.2)。
 和
和 ,少量
,少量 、
、 的化合物)制备仲钼酸铵的工艺流程图如下:
的化合物)制备仲钼酸铵的工艺流程图如下:
资料:1.氧化钼
 :熔点795℃,易升华(即使在低于熔点情况下,也有显著的升华现象)。
:熔点795℃,易升华(即使在低于熔点情况下,也有显著的升华现象)。2.钼酸
 :难溶于水和酸的黄色晶体,可通过酸化铝酸盐溶液而制得。
:难溶于水和酸的黄色晶体,可通过酸化铝酸盐溶液而制得。(1)仲钼酸铵
 中钼元素的化合价是
中钼元素的化合价是(2)废催化剂“焙烧”时
 转化为氧化钼,写出反应的化学方程式
转化为氧化钼,写出反应的化学方程式(3)钼浸取率随碱浸液固比、焙烧温度如图1和图2所示
①综合考虑,制备工艺中选择的最佳液固比值和焙烧温度分别是:
②铝浸取率随焙烧温度变化的原因是

(4)操作1和操作2的名称
(5)“净化”时,浸出液中残留的
 、
、 转化为硫化物沉淀除去。已知
转化为硫化物沉淀除去。已知 ,该溶液中
,该溶液中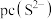 和pH的关系为:
和pH的关系为: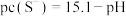 。为了使溶液中的杂质离子浓度小于
。为了使溶液中的杂质离子浓度小于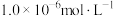 ,应控制溶液的pH不小于
,应控制溶液的pH不小于 ;
; 和
和 的
的 分别为35.2和17.2)。
分别为35.2和17.2)。
更新时间:2022-04-23 12:29:24
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】过氧化氢水溶液是医药、卫生行业上广泛使用的消毒剂。某兴趣小组对过氧化氢(H2O2)氧化性和还原性开展如下探究。
【查阅资料】
①BaO2与稀硫酸反应可制得H2O2,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2。
②H2O2在常温下会缓慢分解成水和氧气,在加热或MnO2等催化剂作用下会迅速分解。
③H2O2在碱性条件下能与Mn2+反应生成棕褐色固体,产生大量气泡。
【实验探究】
(1)制备H2O2:将BaO2溶于足量的冷稀硫酸中充分反应,经_____ (填操作名称)得到含H2O2的溶液A。
(2)检验H2O2:取一定量的溶液A于试管中,加入少量MnO2,迅速产生大量气泡,检验该气体的方法是_____ 。
(3)探究H2O2的氧化性和还原性:
I.向一定量的KMnO4溶液中滴加溶液A,产生气泡,溶液紫色褪去。反应的化学方程式为2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O,其中H2O2作_____ 剂。
Ⅱ.向一定量的FeSO4溶液中滴加溶液A,溶液变为棕黄色,此反应的离子方程式为_____ ,其中H2O2作_____ 剂。
Ⅲ.该小组设计如表实验探究H2O2与Mn2+的反应。
①设计实验i的目的是_____ 。
②试剂a应选_____ 。
A.NaCl B.HCl C.NaOH D.KNO3
③取ii中生成的棕褐色固体,滴加浓盐酸,加热,产生黄绿色气体,应选用的气体发生装置是_____ (填序号)。
A. B.
B.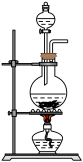 C.
C.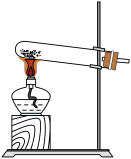 D.
D.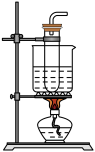
(4)综上所述,H2O2在反应中表现氧化性或还原性,与其它反应物的氧化性或还原性强弱以及溶液的_____ 性等因素有关。
【查阅资料】
①BaO2与稀硫酸反应可制得H2O2,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2。
②H2O2在常温下会缓慢分解成水和氧气,在加热或MnO2等催化剂作用下会迅速分解。
③H2O2在碱性条件下能与Mn2+反应生成棕褐色固体,产生大量气泡。
【实验探究】
(1)制备H2O2:将BaO2溶于足量的冷稀硫酸中充分反应,经
(2)检验H2O2:取一定量的溶液A于试管中,加入少量MnO2,迅速产生大量气泡,检验该气体的方法是
(3)探究H2O2的氧化性和还原性:
I.向一定量的KMnO4溶液中滴加溶液A,产生气泡,溶液紫色褪去。反应的化学方程式为2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O,其中H2O2作
Ⅱ.向一定量的FeSO4溶液中滴加溶液A,溶液变为棕黄色,此反应的离子方程式为
Ⅲ.该小组设计如表实验探究H2O2与Mn2+的反应。
| 序号 | 实验 | 溶液 | 现象 |
| i | 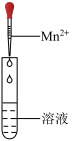 | H2O2 | 有少量气泡 |
| ii | H2O2+H2SO4 | 有少量气泡 | |
| iii | H2O2+a | 生成棕褐色固体,产生大量气泡 |
②试剂a应选
A.NaCl B.HCl C.NaOH D.KNO3
③取ii中生成的棕褐色固体,滴加浓盐酸,加热,产生黄绿色气体,应选用的气体发生装置是
A.
 B.
B. C.
C. D.
D.
(4)综上所述,H2O2在反应中表现氧化性或还原性,与其它反应物的氧化性或还原性强弱以及溶液的
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】已知:A为酸式盐,B为某二价主族金属元素的化合物,其中B的化学式中共有32个电子,常温常压下C、D、F、G、I均呈气态,除G呈红棕色外其他气体均为无色。等物质的量A、B与少量的水充分混合能恰好完全反应。图中反应条件(除高温外)均已略去。
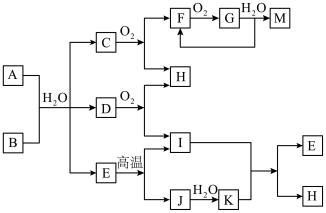
(1)写出B的电子式_____________
(2)写出下列反应的离子方程式:
①在A溶液中加入M__________________________________________
②向A溶液中加入过量NaOH溶液,并加热_______________________
(3)C还可在纯氧中安静燃烧,产物为H和一种单质,写出该反应的化学方程式:_________
(4)写出A与B反应的化学方程式_________________________________ 。

(1)写出B的电子式
(2)写出下列反应的离子方程式:
①在A溶液中加入M
②向A溶液中加入过量NaOH溶液,并加热
(3)C还可在纯氧中安静燃烧,产物为H和一种单质,写出该反应的化学方程式:
(4)写出A与B反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】化学与生产、生活密切相关。回答下列问题:
I.家庭厨卫中有许多中学化学常见的物质,括号内为厨卫用品的主要成分。
①食盐(NaCl);②料酒(乙醇);③食醋(乙酸);④碱面( );⑤发酵粉(
);⑤发酵粉( 和明矾);⑥“84”消毒液(NaClO);⑦洁厕灵(HCl)。
和明矾);⑥“84”消毒液(NaClO);⑦洁厕灵(HCl)。
(1)当食盐不慎洒落在天然气的火焰上,观察到的现象是___________ 。
(2)②③的主要成分可以归为一类物质,其分类的依据是___________(填字母)。
(3)写出过量⑦和④反应的离子方程式:___________ 。
(4)“84”消毒液和洁厕灵不能混合使用,用离子方程式解释其原因:___________ 。
(5)某同学用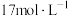 的浓硫酸配制480mL
的浓硫酸配制480mL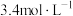 的稀硫酸用于增强“84”消毒液的消毒能力,需取用浓硫酸的体积为
的稀硫酸用于增强“84”消毒液的消毒能力,需取用浓硫酸的体积为___________ mL。
Ⅱ.汽车安全气囊内装有 等物质。
等物质。
(6)当汽车发生严重碰撞时,引发 分解:
分解: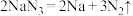 ,
, 的电子式为
的电子式为___________ ,若安全气囊内有65g ,其完全分解所释放的
,其完全分解所释放的 在标准状况下的体积为
在标准状况下的体积为___________ L,产生的Na立即与 发生置换反应生成
发生置换反应生成 ,其中氧化剂和还原剂的物质的量之比是
,其中氧化剂和还原剂的物质的量之比是___________ 。
I.家庭厨卫中有许多中学化学常见的物质,括号内为厨卫用品的主要成分。
①食盐(NaCl);②料酒(乙醇);③食醋(乙酸);④碱面(
 );⑤发酵粉(
);⑤发酵粉( 和明矾);⑥“84”消毒液(NaClO);⑦洁厕灵(HCl)。
和明矾);⑥“84”消毒液(NaClO);⑦洁厕灵(HCl)。(1)当食盐不慎洒落在天然气的火焰上,观察到的现象是
(2)②③的主要成分可以归为一类物质,其分类的依据是___________(填字母)。
| A.两种物质都是非电解质 | B.两种物质都是电解质 |
| C.两种物质都是氧化物 | D.两种物质都是含碳化合物 |
(3)写出过量⑦和④反应的离子方程式:
(4)“84”消毒液和洁厕灵不能混合使用,用离子方程式解释其原因:
(5)某同学用
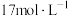 的浓硫酸配制480mL
的浓硫酸配制480mL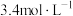 的稀硫酸用于增强“84”消毒液的消毒能力,需取用浓硫酸的体积为
的稀硫酸用于增强“84”消毒液的消毒能力,需取用浓硫酸的体积为Ⅱ.汽车安全气囊内装有
 等物质。
等物质。(6)当汽车发生严重碰撞时,引发
 分解:
分解: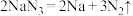 ,
, 的电子式为
的电子式为 ,其完全分解所释放的
,其完全分解所释放的 在标准状况下的体积为
在标准状况下的体积为 发生置换反应生成
发生置换反应生成 ,其中氧化剂和还原剂的物质的量之比是
,其中氧化剂和还原剂的物质的量之比是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】 和
和 是重要的工业原料。
是重要的工业原料。
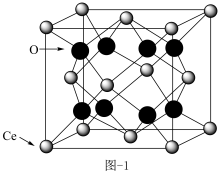
(1) 晶胞见图-1,其中O原子位于Ce构成的
晶胞见图-1,其中O原子位于Ce构成的________ 空隙。(填“正四面体”或“正八面体”)
(2)铜-氧化物(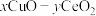 ,其中O均为-2价)可催化氧化除去氢气中少量CO,其反应机理见图-2所示。
,其中O均为-2价)可催化氧化除去氢气中少量CO,其反应机理见图-2所示。
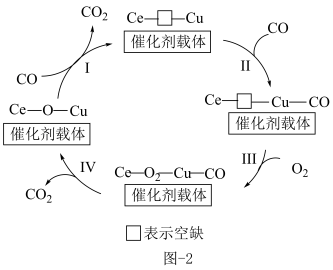
①反应Ⅰ中Ce的化合价变化为:________ 。(已知反应Ⅰ中Cu、Ce的化合价均发生变化)
②若反应Ⅱ中通入 ,检测反应Ⅳ的产物,其中含有
,检测反应Ⅳ的产物,其中含有 有
有________ 种。
(3)用pH约为7的 溶液与
溶液与 溶液反应制备
溶液反应制备 沉淀。若制备
沉淀。若制备 含量少的
含量少的 ,采用的加料方式为:将
,采用的加料方式为:将________ 溶液缓慢滴加到________ 溶液中。(填化学式)
(4)准确称取1.00g 样品置于锥形瓶中,加入适量过二硫酸铵[
样品置于锥形瓶中,加入适量过二硫酸铵[ ]溶液恰好将
]溶液恰好将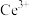 氧化为
氧化为 ,然后加入40.00mL
,然后加入40.00mL 与之恰好反应完全。已知:
与之恰好反应完全。已知: 。求该样品中
。求该样品中 的质量分数
的质量分数_____ (写出计算过程)。
 和
和 是重要的工业原料。
是重要的工业原料。(1)
 晶胞见图-1,其中O原子位于Ce构成的
晶胞见图-1,其中O原子位于Ce构成的
(2)铜-氧化物(
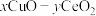 ,其中O均为-2价)可催化氧化除去氢气中少量CO,其反应机理见图-2所示。
,其中O均为-2价)可催化氧化除去氢气中少量CO,其反应机理见图-2所示。
①反应Ⅰ中Ce的化合价变化为:
②若反应Ⅱ中通入
 ,检测反应Ⅳ的产物,其中含有
,检测反应Ⅳ的产物,其中含有 有
有(3)用pH约为7的
 溶液与
溶液与 溶液反应制备
溶液反应制备 沉淀。若制备
沉淀。若制备 含量少的
含量少的 ,采用的加料方式为:将
,采用的加料方式为:将(4)准确称取1.00g
 样品置于锥形瓶中,加入适量过二硫酸铵[
样品置于锥形瓶中,加入适量过二硫酸铵[ ]溶液恰好将
]溶液恰好将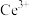 氧化为
氧化为 ,然后加入40.00mL
,然后加入40.00mL 与之恰好反应完全。已知:
与之恰好反应完全。已知: 。求该样品中
。求该样品中 的质量分数
的质量分数
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】有机酸种类繁多,广泛分布于中草药的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:
(1)乙酸是合成乙酸乙酯的重要原料,制备原理如下:
CH3COOH(l)+ C2H5OH(l) CH3COOHC2H5(l)+H2O(l) △H=-8.62kJ/mol
CH3COOHC2H5(l)+H2O(l) △H=-8.62kJ/mol
已知:CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78 ℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示:
①该研究小组的实验目的是________________ 。60℃下反应40min与70℃下反应20min相比,前者的平均反应速率___________ 后者(填“小于”、“等于”或“大于”)。
②如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是___________ ;
③利用此原理制得的乙酸乙酯粗品中常含有一定量的乙酸、乙醇以及微量的硫酸,提纯时可向粗品中加入__________ 溶液进行充分洗涤,分离出有机层,并加入无水硫酸钠干燥,最后经过__________ 、_______ 两步操作即可得到纯品。
(2)乙二酸俗名草酸(二元弱酸,结构简式:HOOC—COOH),被广泛的应用于抗生素类药物的合成。
①实验室中经常利用酸性KMnO4溶液滴定法测其纯度。已知草酸与酸性KMnO4溶液反应过程有无色无味气体产生,且KMnO4溶液紫色褪去,写出草酸与酸性KMnO4溶液反应的离子方程式_____________________ ;
②资料表明:25℃时草酸的电离平衡常数Ka1=6.0×10-2;Ka2=6.4×10-5;据此分析,室温时草酸氢钾(KHC2O4)的水解反应平衡常数Kh=________ (单位省略,计算结果保留两位有效数字),其溶液中c(H2C2O4)________ c(C2O42-)(填“小于”、“等于”或“大于”)。
(1)乙酸是合成乙酸乙酯的重要原料,制备原理如下:
CH3COOH(l)+ C2H5OH(l)
 CH3COOHC2H5(l)+H2O(l) △H=-8.62kJ/mol
CH3COOHC2H5(l)+H2O(l) △H=-8.62kJ/mol已知:CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78 ℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示:
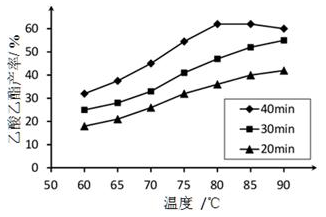
①该研究小组的实验目的是
②如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是
③利用此原理制得的乙酸乙酯粗品中常含有一定量的乙酸、乙醇以及微量的硫酸,提纯时可向粗品中加入
(2)乙二酸俗名草酸(二元弱酸,结构简式:HOOC—COOH),被广泛的应用于抗生素类药物的合成。
①实验室中经常利用酸性KMnO4溶液滴定法测其纯度。已知草酸与酸性KMnO4溶液反应过程有无色无味气体产生,且KMnO4溶液紫色褪去,写出草酸与酸性KMnO4溶液反应的离子方程式
②资料表明:25℃时草酸的电离平衡常数Ka1=6.0×10-2;Ka2=6.4×10-5;据此分析,室温时草酸氢钾(KHC2O4)的水解反应平衡常数Kh=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】合成氨在国民经济中占有十分重要的地位。
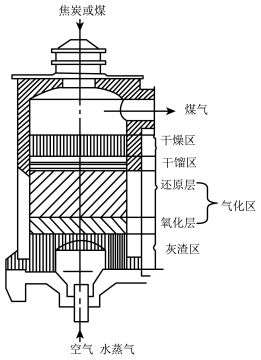
(1)制备原料气阶段:以煤、焦炭、水蒸气、空气为原料在如图反应器中合成氢气。
氧化层中进行的反应:
Ⅰ、 ,
,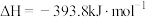
Ⅱ、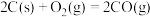 ,
,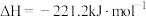
还原层中进行的反应:
Ⅲ、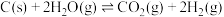 ,
,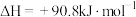
Ⅳ、 ,
,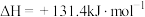
①在还原层中 在产物中的体积分数为
在产物中的体积分数为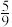 ,写出反应的热化学方程式:
,写出反应的热化学方程式:___________ 。
②下列说法正确的是___________
A.氧化层能维持炉中的反应温度
B.升温可提高还原区 的平衡选择性,减少CO的排放
的平衡选择性,减少CO的排放
C.氧化区中的反应 、
、 。
。
D.若通入的 ,后续必须要补充
,后续必须要补充 才可作为制氨的原料气
才可作为制氨的原料气
(2)氨的合成阶段:气固相合成催化
①氨合成阶段 在低温时主要由速率控制
在低温时主要由速率控制 的产率,已知在接近平衡时:
的产率,已知在接近平衡时: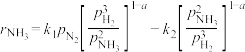 (
(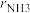 —氨合成反应的净速率;
—氨合成反应的净速率; ,
, —正、逆反应速率常数;
—正、逆反应速率常数;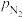 ,
,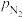 ,
, —
— ,
, ,
, 的分压;
的分压; 为常数,与催化剂有关,经实验测定以铁为主的氨合成催化剂
为常数,与催化剂有关,经实验测定以铁为主的氨合成催化剂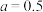 ,试用
,试用 ,
, 表示氨合成反应的平衡常数
表示氨合成反应的平衡常数
___________ )。
②已知,320℃恒温1L的容器中通入一定量的 和
和 ,
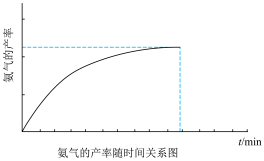
, 的产率随时间变化关系如图所示。起始温度为320℃绝热1L的容器中通入与恒温时相同量的
的产率随时间变化关系如图所示。起始温度为320℃绝热1L的容器中通入与恒温时相同量的 和
和 在
在 时刻达到平衡后,调整装置保持320℃,在
时刻达到平衡后,调整装置保持320℃,在 时刻重新达到平衡。画出投料后到
时刻重新达到平衡。画出投料后到 时刻容器内的
时刻容器内的 的产率随时间变化关系曲线
的产率随时间变化关系曲线___________ 。
(3)氨水催化吸收 是小型合成氨厂广泛采用的脱硫方法。原料气中
是小型合成氨厂广泛采用的脱硫方法。原料气中 在脱硫塔中被氨吸收得到
在脱硫塔中被氨吸收得到 。补充完成在吸收液中添加对苯二酚(作为载氧体和催化剂),回收单质硫的化学方程式。
。补充完成在吸收液中添加对苯二酚(作为载氧体和催化剂),回收单质硫的化学方程式。
Ⅰ: Ⅱ:
Ⅱ:___________
(1)制备原料气阶段:以煤、焦炭、水蒸气、空气为原料在如图反应器中合成氢气。
氧化层中进行的反应:

Ⅰ、
 ,
,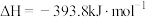
Ⅱ、
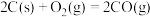 ,
,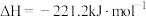
还原层中进行的反应:
Ⅲ、
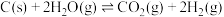 ,
,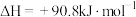
Ⅳ、
 ,
,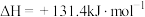
①在还原层中
 在产物中的体积分数为
在产物中的体积分数为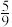 ,写出反应的热化学方程式:
,写出反应的热化学方程式:②下列说法正确的是
A.氧化层能维持炉中的反应温度
B.升温可提高还原区
 的平衡选择性,减少CO的排放
的平衡选择性,减少CO的排放C.氧化区中的反应
 、
、 。
。D.若通入的
 ,后续必须要补充
,后续必须要补充 才可作为制氨的原料气
才可作为制氨的原料气(2)氨的合成阶段:气固相合成催化
①氨合成阶段
 在低温时主要由速率控制
在低温时主要由速率控制 的产率,已知在接近平衡时:
的产率,已知在接近平衡时: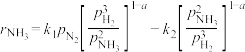 (
(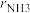 —氨合成反应的净速率;
—氨合成反应的净速率; ,
, —正、逆反应速率常数;
—正、逆反应速率常数;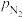 ,
,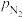 ,
, —
— ,
, ,
, 的分压;
的分压; 为常数,与催化剂有关,经实验测定以铁为主的氨合成催化剂
为常数,与催化剂有关,经实验测定以铁为主的氨合成催化剂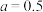 ,试用
,试用 ,
, 表示氨合成反应的平衡常数
表示氨合成反应的平衡常数
②已知,320℃恒温1L的容器中通入一定量的
 和
和 ,
, 的产率随时间变化关系如图所示。起始温度为320℃绝热1L的容器中通入与恒温时相同量的
的产率随时间变化关系如图所示。起始温度为320℃绝热1L的容器中通入与恒温时相同量的 和
和 在
在 时刻达到平衡后,调整装置保持320℃,在
时刻达到平衡后,调整装置保持320℃,在 时刻重新达到平衡。画出投料后到
时刻重新达到平衡。画出投料后到 时刻容器内的
时刻容器内的 的产率随时间变化关系曲线
的产率随时间变化关系曲线
(3)氨水催化吸收
 是小型合成氨厂广泛采用的脱硫方法。原料气中
是小型合成氨厂广泛采用的脱硫方法。原料气中 在脱硫塔中被氨吸收得到
在脱硫塔中被氨吸收得到 。补充完成在吸收液中添加对苯二酚(作为载氧体和催化剂),回收单质硫的化学方程式。
。补充完成在吸收液中添加对苯二酚(作为载氧体和催化剂),回收单质硫的化学方程式。Ⅰ:
 Ⅱ:
Ⅱ:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】铍可应用于飞机、火箭制造业和原子能工业。素有“中国铍业一枝花”之称的湖南水口山六厂改进国外生产工艺,以硅铍石(主要成分为 、
、 、
、 、
、 、
、 )为原料提取铍,具体流程如下:
)为原料提取铍,具体流程如下:
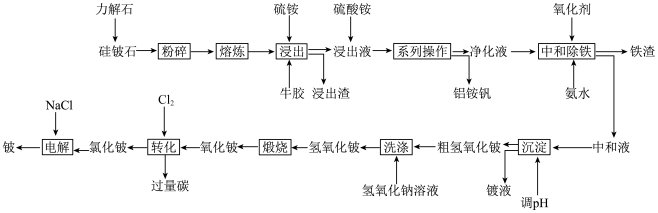
已知:①铍和铝在元素周期表中处于对角线位置,电负性相近,其单质及化合物在结构与性质等方面具有相似性。
②铝铵钒在不同温度下的溶解度:
回答下列问题:
(1)流程中“系列操作”为___________ 。
(2)将“中和液”沉淀时,调节溶液的 不能过大或过小。
不能过大或过小。 过大时发生反应的离子方程式为
过大时发生反应的离子方程式为___________ 。
(3)已知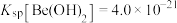 ,
,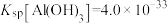 。若
。若 浓度为0.40
浓度为0.40 的中和液开始沉淀时,溶液中
的中和液开始沉淀时,溶液中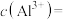
___________  。
。
(4)若在实验室洗涤粗 ,操作为
,操作为___________ ;洗涤时加入 溶液除去表面吸附的少量氢氧化铝,反应的离子方程式为
溶液除去表面吸附的少量氢氧化铝,反应的离子方程式为___________ 。
(5)氧化铍转化为氯化铍的化学方程式为___________ 。
(6) 的电子式为
的电子式为___________ ;电解时须加入氯化钠的作用是___________ 。
 、
、 、
、 、
、 、
、 )为原料提取铍,具体流程如下:
)为原料提取铍,具体流程如下:
已知:①铍和铝在元素周期表中处于对角线位置,电负性相近,其单质及化合物在结构与性质等方面具有相似性。
②铝铵钒在不同温度下的溶解度:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 |
| 溶解度/g | 2.10 | 5.00 | 7.74 | 10.9 | 14.9 | 26.7 |
(1)流程中“系列操作”为
(2)将“中和液”沉淀时,调节溶液的
 不能过大或过小。
不能过大或过小。 过大时发生反应的离子方程式为
过大时发生反应的离子方程式为(3)已知
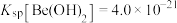 ,
,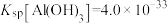 。若
。若 浓度为0.40
浓度为0.40 的中和液开始沉淀时,溶液中
的中和液开始沉淀时,溶液中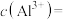
 。
。(4)若在实验室洗涤粗
 ,操作为
,操作为 溶液除去表面吸附的少量氢氧化铝,反应的离子方程式为
溶液除去表面吸附的少量氢氧化铝,反应的离子方程式为(5)氧化铍转化为氯化铍的化学方程式为
(6)
 的电子式为
的电子式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】我国锰矿资源主要为贫碳酸锰矿(主要成分为 ,还含有少量
,还含有少量 、
、 、
、 、
、 、
、 、
、 ),利用贫碳酸锰矿制取
),利用贫碳酸锰矿制取 的流程如图所示,回答下列问题。
的流程如图所示,回答下列问题。 ,
, 。
。
(1) 中锰元素的价态有+2价和+3价,则下列表示
中锰元素的价态有+2价和+3价,则下列表示 组成的式子正确的是___________(填标号)。
组成的式子正确的是___________(填标号)。
(2)“滤渣1”的主要成分是___________ (填化学式)。
(3)“氧化”的目的是将 转化为
转化为 ,写出发生反应的离子方程式
,写出发生反应的离子方程式___________ ,检测 是否完全氧化的试剂是
是否完全氧化的试剂是___________ (写试剂名称)。
(4)“除钙镁”后的滤液中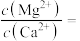
___________ 。
(5)“碳化”过程需要加热,但温度不能太高,试分析温度不能太高的原因___________ 。
(6)“焙烧”过程中随温度不同生成的锰的氧化物也不同。图中A点对应的氧化物是___________ ,为了获得 ,需要加热到
,需要加热到___________  (已知:A、B、C三点对应的物质均为纯净氧化物)。
(已知:A、B、C三点对应的物质均为纯净氧化物)。
 ,还含有少量
,还含有少量 、
、 、
、 、
、 、
、 、
、 ),利用贫碳酸锰矿制取
),利用贫碳酸锰矿制取 的流程如图所示,回答下列问题。
的流程如图所示,回答下列问题。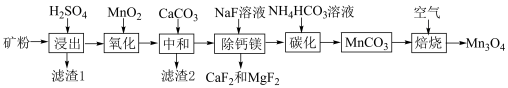
 ,
, 。
。(1)
 中锰元素的价态有+2价和+3价,则下列表示
中锰元素的价态有+2价和+3价,则下列表示 组成的式子正确的是___________(填标号)。
组成的式子正确的是___________(填标号)。A.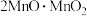 | B.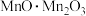 | C.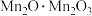 | D. |
(2)“滤渣1”的主要成分是
(3)“氧化”的目的是将
 转化为
转化为 ,写出发生反应的离子方程式
,写出发生反应的离子方程式 是否完全氧化的试剂是
是否完全氧化的试剂是(4)“除钙镁”后的滤液中
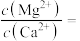
(5)“碳化”过程需要加热,但温度不能太高,试分析温度不能太高的原因
(6)“焙烧”过程中随温度不同生成的锰的氧化物也不同。图中A点对应的氧化物是
 ,需要加热到
,需要加热到 (已知:A、B、C三点对应的物质均为纯净氧化物)。
(已知:A、B、C三点对应的物质均为纯净氧化物)。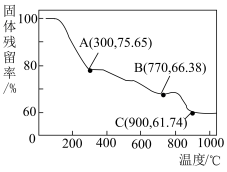
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】中和渣是有色金属冶炼过程中产生的危险废渣。从中和渣(主要含有 和少量
和少量 、
、 、
、 、
、 的氢氧化物)中回收铜、锌等金属的工艺流程如下图:
的氢氧化物)中回收铜、锌等金属的工艺流程如下图: ,几种物质的
,几种物质的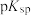 如下表
如下表
②当金属离子浓度小于 时,视为沉淀完全
时,视为沉淀完全
回答下列问题:
(1)“中性浸出”时,采用“中性”的目的是________ 。
(2)“高温高酸浸出”时,“浸渣2”的主要成分为________ 。
(3)“萃铜”时发生反应 ,
,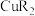 的结构简式如图所示:
的结构简式如图所示: 的价层电子排布图
的价层电子排布图________ 。
②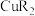 水溶性差的原因是
水溶性差的原因是________ (选填序号)。
a.形成分子内氢键 b.分子结构较稳定 c.亲油基团起主导作用
③萃取剂HR的结构简式为________ 。
(4)“氧化沉淀”时,试剂X用以调节溶液的pH。
①加入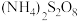 溶液时生成
溶液时生成 沉淀,反应的离子方程式为
沉淀,反应的离子方程式为________ 。
②沉淀后溶液的pH需不低于________ 。
(5)该流程中,可以循环使用的物质有________ 。
(6)某黄铜合金晶胞结构如图,其中A、B的原子坐标均可为 。与Zn原子距离最近且相等的Cu原子有
。与Zn原子距离最近且相等的Cu原子有________ 个,C的原子坐标为________ 。
 和少量
和少量 、
、 、
、 、
、 的氢氧化物)中回收铜、锌等金属的工艺流程如下图:
的氢氧化物)中回收铜、锌等金属的工艺流程如下图: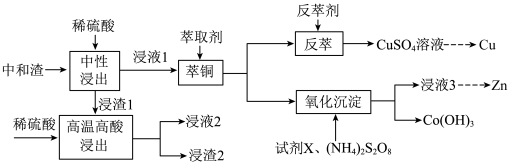
 ,几种物质的
,几种物质的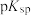 如下表
如下表物质 |
|
|
|
|
|
| 37.4 | 14.6 | 43.7 | 16.9 | 19.6 |
 时,视为沉淀完全
时,视为沉淀完全回答下列问题:
(1)“中性浸出”时,采用“中性”的目的是
(2)“高温高酸浸出”时,“浸渣2”的主要成分为
(3)“萃铜”时发生反应
 ,
,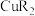 的结构简式如图所示:
的结构简式如图所示: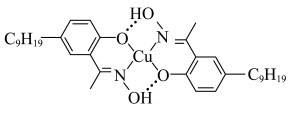
 的价层电子排布图
的价层电子排布图②
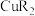 水溶性差的原因是
水溶性差的原因是a.形成分子内氢键 b.分子结构较稳定 c.亲油基团起主导作用
③萃取剂HR的结构简式为
(4)“氧化沉淀”时,试剂X用以调节溶液的pH。
①加入
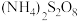 溶液时生成
溶液时生成 沉淀,反应的离子方程式为
沉淀,反应的离子方程式为②沉淀后溶液的pH需不低于
(5)该流程中,可以循环使用的物质有
(6)某黄铜合金晶胞结构如图,其中A、B的原子坐标均可为
 。与Zn原子距离最近且相等的Cu原子有
。与Zn原子距离最近且相等的Cu原子有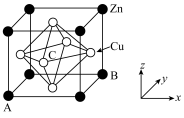
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】下图为对预处理后的可充电电池粉末(主要为NiO、CdO、CoO和Fe2O3等)回收重金属的工艺流程。
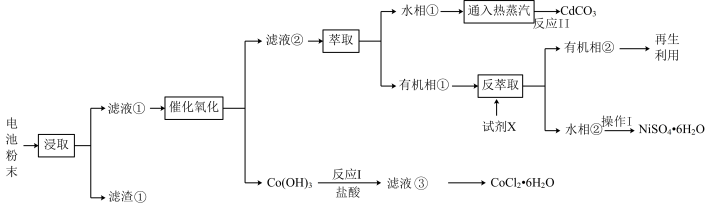
已知:浸取液为NH3和NH4HCO3的混合液;滤液①主要含:[Cd(NH3)4]2+、[Ni(NH3)6]2+、[Co(NH3)6]2+和CO32-
(1)滤液③中,钴元素的化合价为:_______________
(2)“催化氧化”步骤中,向[Co(NH3)6]2+含量为0.38g·L1的溶液中通入空气,待反应完全后,记录数据如下表:
由表中数据可得,[Co(NH3)6]2+氧化的最佳条件为_________________________ ;
(3)反应I的化学方程式:_____________________________________ ;操作I中用乙醇代替蒸馏水洗涤NiSO4·6H2O 的优点是:_____________________ ;
(4)萃取原理为:Ni2+ (水层)+2HR(有机层)⇌NiR(有机层)+2H+(水层),反萃取中,加入试剂X为:__________________________ ,该工艺可循环利用的物质为有机萃取剂和____________________ ;(以上均填化学式)
(5)生成CdCO3沉淀是利用反应[Cd(NH3)4]2++CO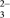 ⇌CdCO3↓+4NH3。已知:常温下,该反应平衡常数K=2.75×105mol2•L2,[Cd(NH3)4]2+⇌Cd2++4NH3的平衡常数K不稳=2.75×107, Ksp(CdCO3)=
⇌CdCO3↓+4NH3。已知:常温下,该反应平衡常数K=2.75×105mol2•L2,[Cd(NH3)4]2+⇌Cd2++4NH3的平衡常数K不稳=2.75×107, Ksp(CdCO3)= ________ 。
(6)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2;该电池充电时,阳极的电极反应方程式为:_________ ;

已知:浸取液为NH3和NH4HCO3的混合液;滤液①主要含:[Cd(NH3)4]2+、[Ni(NH3)6]2+、[Co(NH3)6]2+和CO32-
(1)滤液③中,钴元素的化合价为:
(2)“催化氧化”步骤中,向[Co(NH3)6]2+含量为0.38g·L1的溶液中通入空气,待反应完全后,记录数据如下表:
反应时间 | [Co(NH3)6]3+(g·L1)(25ºC) | [Co(NH3)6]3+(g·L1)(90ºC,石墨催化) |
1.5h | 0.090 | 0.35 |
2.5h | 0.14 | 0.38 |
5h | 0.35 | 0.38 |
由表中数据可得,[Co(NH3)6]2+氧化的最佳条件为
(3)反应I的化学方程式:
(4)萃取原理为:Ni2+ (水层)+2HR(有机层)⇌NiR(有机层)+2H+(水层),反萃取中,加入试剂X为:
(5)生成CdCO3沉淀是利用反应[Cd(NH3)4]2++CO
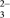 ⇌CdCO3↓+4NH3。已知:常温下,该反应平衡常数K=2.75×105mol2•L2,[Cd(NH3)4]2+⇌Cd2++4NH3的平衡常数K不稳=2.75×107, Ksp(CdCO3)=
⇌CdCO3↓+4NH3。已知:常温下,该反应平衡常数K=2.75×105mol2•L2,[Cd(NH3)4]2+⇌Cd2++4NH3的平衡常数K不稳=2.75×107, Ksp(CdCO3)= (6)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2;该电池充电时,阳极的电极反应方程式为:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将_____________ 还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________ 。
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。
滤液Ⅱ中加入萃取剂的作用是_________ ;使用萃取剂适宜的pH是______ 。
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=____ 。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。

滤液Ⅱ中加入萃取剂的作用是
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】氮化硼(BN)是一种新型无机非金属材料,不溶于冷水。常用硼砂-氯化铵法制备氮化硼,实验步骤如下:
步骤1:原料预处理。硼砂(Na2B4O7·10H2O)在真空中200~400°C脱水;提纯氯化铵。
步骤2:将粉碎和干燥的硼砂与氯化铵以7:3的质量比混合,压成坯块。
步骤3:在900~1000°C下通入氨气充分反应。
步骤4:分离、提纯产品。
回答下列问题:
(1)步骤1中硼砂脱水的目的是_______ 。
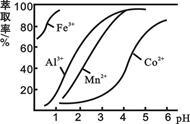
(2)某小组设计图1装置完成步骤3。
①固体R是_______ (填化学式)。
②有人认为应选择图2仪器替代酒精灯,他的理由是_______ 。改进后完成实验。
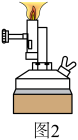
③实验时,先启动装置A中反应,当_______ (填实验现象)时点燃装置C中加热仪器。
④写出装置C中发生反应的化学方程式:_______ 。
(3)步骤4中分离、提纯产品的方法是_______ 。
(4)测定产品纯度(只含NaCl杂质)。称取wg产品溶于水,过滤。将滤液配制成250mL溶液,准确量取25.00mL配制的溶液于锥形瓶,加入V1mLc1mol·L-1AgNO3溶液,充分反应后,加入适量硝基苯(包裹AgC1),再滴加几滴指示剂X,用c2mol·L-1NH4SCN溶液滴定至终点,消耗滴定液V2mL。已知:室温下,Ksp(AgC1)=1.8×10-10,Ksp(AgSCN)=1.2×10-12。
①指示剂X是_______ (填化学式)。
②该产品纯度为_______ (用代数式表示)。
③若不加硝基苯,测得产品纯度_______ (填“偏高”“偏低”或“无影响”)。
步骤1:原料预处理。硼砂(Na2B4O7·10H2O)在真空中200~400°C脱水;提纯氯化铵。
步骤2:将粉碎和干燥的硼砂与氯化铵以7:3的质量比混合,压成坯块。
步骤3:在900~1000°C下通入氨气充分反应。
步骤4:分离、提纯产品。
回答下列问题:
(1)步骤1中硼砂脱水的目的是
(2)某小组设计图1装置完成步骤3。

①固体R是
②有人认为应选择图2仪器替代酒精灯,他的理由是

③实验时,先启动装置A中反应,当
④写出装置C中发生反应的化学方程式:
(3)步骤4中分离、提纯产品的方法是
(4)测定产品纯度(只含NaCl杂质)。称取wg产品溶于水,过滤。将滤液配制成250mL溶液,准确量取25.00mL配制的溶液于锥形瓶,加入V1mLc1mol·L-1AgNO3溶液,充分反应后,加入适量硝基苯(包裹AgC1),再滴加几滴指示剂X,用c2mol·L-1NH4SCN溶液滴定至终点,消耗滴定液V2mL。已知:室温下,Ksp(AgC1)=1.8×10-10,Ksp(AgSCN)=1.2×10-12。
①指示剂X是
②该产品纯度为
③若不加硝基苯,测得产品纯度
您最近一年使用:0次







