已知:①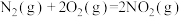
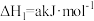
②
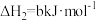
③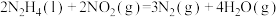

下列叙述错误的是
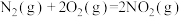
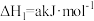
②

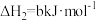
③
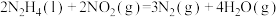

下列叙述错误的是
A. |
B.1mol 和 和 的总能量等于 的总能量等于 的总能量 的总能量 |
C.反应②中若生成 , , 将变小 将变小 |
| D.在常温下,反应③能自发进行 |
更新时间:2023-05-07 15:40:00
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】接触法制备硫酸中的关键步骤是: 在
在 催化作用下与空气中
催化作用下与空气中 在接触室发生可逆反应,其热化学方程式为:
在接触室发生可逆反应,其热化学方程式为: 。题图表示在有、无催化剂条件下
。题图表示在有、无催化剂条件下 氧化成
氧化成 过程中的能量变化。
过程中的能量变化。 催化时,该反应机理为:
催化时,该反应机理为:
反应①:
反应②:
下列说法正确的是

 在
在 催化作用下与空气中
催化作用下与空气中 在接触室发生可逆反应,其热化学方程式为:
在接触室发生可逆反应,其热化学方程式为: 。题图表示在有、无催化剂条件下
。题图表示在有、无催化剂条件下 氧化成
氧化成 过程中的能量变化。
过程中的能量变化。 催化时,该反应机理为:
催化时,该反应机理为:反应①:

反应②:

下列说法正确的是

A. 催化时,反应②的速率大于反应① 催化时,反应②的速率大于反应① |
B. |
| C.升高温度,正反应速率增大,逆反应速率减小 |
D.增大压强,反应 平衡常数增大 平衡常数增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,有关该反应的下列说法正确的是
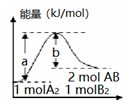

| A.每生成2 mol AB分子,需要吸收b kJ热量 |
| B.加入催化剂,(a-b)的差值减小 |
| C.该反应的反应物断键吸收的能量大于生成物成键放出的能量 |
| D.若反应生成AB为液态,每生成2 mol AB分子,需要吸收的热量大于(a-b) kJ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】下列说法正确的是
| A.已知:①C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5kJ/mol,②C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.0kJ/mol,则C(s,石墨)=C(s,金刚石) ΔH=+1.5kJ/mol |
B.由C(s)+ O2(g)=CO(g) ΔH=-110.5kJ/mol,可知碳的燃烧热为110.5kJ/mol O2(g)=CO(g) ΔH=-110.5kJ/mol,可知碳的燃烧热为110.5kJ/mol |
| C.常温常压下,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,则HF(aq) +NaOH(aq)=NaF(aq)+H2O(1) ΔH=-57.3kJ/mol |
| D.ΔH>0和ΔS>0的反应,在任何温度下都不能自发进行 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列说法正确的是
| A.吸热反应一定需要加热才能发生 |
| B.高温煅烧石灰石既属于氧化还原反应,又属于吸热反应 |
C.由 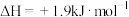 可知:金刚石比石墨更稳定 可知:金刚石比石墨更稳定 |
D.已知  , ,  ,则 ,则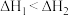 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】工业合成三氧化硫的反应为2SO2(g)+O2(g) 2SO3(g) △H=-198kJ/mol,反应过程可用如图模拟(
2SO3(g) △H=-198kJ/mol,反应过程可用如图模拟( 表示O2,
表示O2, 表示SO2,
表示SO2, 表示催化剂)。下列说法不正确的是
表示催化剂)。下列说法不正确的是

 2SO3(g) △H=-198kJ/mol,反应过程可用如图模拟(
2SO3(g) △H=-198kJ/mol,反应过程可用如图模拟( 表示O2,
表示O2, 表示SO2,
表示SO2, 表示催化剂)。下列说法不正确的是
表示催化剂)。下列说法不正确的是
| A.过程Ⅱ和过程Ⅲ决定了全部反应进行的程度 |
| B.催化剂可降低反应的活化能,从而使单位体积中活化分子百分数增大,化学反应速率加快 |
| C.过程Ⅱ为吸热过程,过程Ⅲ为放热过程;所以升高温度,过程Ⅱ速率加快,过程Ⅲ速率减慢 |
| D.1molSO2和0.5molO2反应,放出的热量小于99kJ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列有关电解质溶液的说法正确的是
| A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小 |
| B.利用焓判据可判断N2(g)+3H2(g)=2NH3(g) ∆H=-92.4 kJ·mol-1不能自发进行 |
| C.纯物质完全燃烧生成1 mol稳定氧化物时所放出的热量叫做该物质的燃烧热 |
| D.常温下,pH=2的醋酸与pH=12的NaOH溶液等体积混合后,溶液pH<7 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】在恒温、恒压下,下列有关某反应的判断中,正确的是
| A.若其ΔH>0,ΔS>0,则其一定是自发反应 |
| B.若其ΔH<0,ΔS<0,则其一定是自发反应 |
| C.若其ΔH<0,ΔS>0,则其一定是自发反应 |
| D.若其ΔH>0,ΔS<0,则其一定是自发反应 |
您最近一年使用:0次

 ,发生反应:
,发生反应: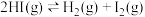
 ,达到平衡状态。该反应经过以下两步基元反应完成:
,达到平衡状态。该反应经过以下两步基元反应完成:


 、
、
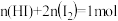
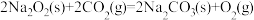 在常温下能自发进行,则该反应的△H>0
在常温下能自发进行,则该反应的△H>0 。欲使溶液中
。欲使溶液中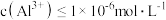 ,需调节溶液的
,需调节溶液的


