一种由铜镉渣生产金属镉的流程如下:(铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。)
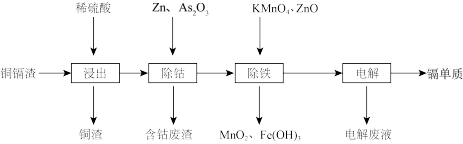
下表列出了相关金属离子生成氢氧化物沉淀的pH
(1)浸出过程中,不采用通入空气的方法进行搅拌,原因是防止将Cu氧化浸出。写出通空气将Cu氧化浸出的离子方程式___________ 。
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3,该微电池的正极反应式为_______ 。
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH。
①除铁过程中,理论上参加反应的物质n(KMnO4):n(Fe2+)=___________ 。
②除铁时加入ZnO控制反应液pH的范围为___________ 。
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证:___________ 。
(5)净化后的溶液可电解获得镉单质。镉的金属性___________ 金属铜(填“强于”或“弱于”)。

下表列出了相关金属离子生成氢氧化物沉淀的pH
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3,该微电池的正极反应式为
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH。
①除铁过程中,理论上参加反应的物质n(KMnO4):n(Fe2+)=
②除铁时加入ZnO控制反应液pH的范围为
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证:
(5)净化后的溶液可电解获得镉单质。镉的金属性
更新时间:2023-06-02 07:33:44
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】五氧化二氮(N2O5)是有机合成中常用的绿色硝化剂。N2O5常温下为白色固体,可溶于CH2Cl2等氯代烃溶剂,微溶于水且与水反应生成强酸,高于室温时对热不稳定。
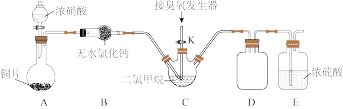
(1)1840年,Devill首次将干燥的氯气通入硝酸银,在试管壁上得到了N2O5.已知反应的氧化产物为空气中的成分之一,写出反应的化学方程式:___________ 。
(2)某化学兴趣小组设计臭氧(O3)氧化法制备N2O5,反应原理为N2O4+O3=N2O5+O2.实验装置如图,回答下列问题:
①写出装置A中发生反应的离子方程式:___________ 。
②装置B的名称为___________ ;装置E的作用是___________ 。
③实验时,将三口烧瓶C浸入冰水中,打开装置A中分液漏斗的活塞,一段时间后C中液体变为红棕色。然后打开活塞K,通过臭氧发生器向三口烧瓶中通入含有臭氧的氧气。C中二氯甲烷(CH2Cl2)的作用是___________ 。
(3)判断C中反应已结束的简单方法是___________ 。
(4)原装置存在一处明显的错误为___________ 。
(5)该兴趣小组用滴定法测定N2O5粗产品中N2O4的含量。
取2.0 g粗产品,加入25.00 mL 0.1000 mol/L酸性高锰酸钾溶液。充分反应后,用0.1000 mol/L H2O2溶液滴定剩余的高锰酸钾,达到滴定终点时,消耗H2O2溶液20.00 mL。(已知:H2O2与HNO3不反应且不考虑其分解),i、则产品中N2O4的含量为___________ (质量分数,结果保留三位有效数字)。

(1)1840年,Devill首次将干燥的氯气通入硝酸银,在试管壁上得到了N2O5.已知反应的氧化产物为空气中的成分之一,写出反应的化学方程式:
(2)某化学兴趣小组设计臭氧(O3)氧化法制备N2O5,反应原理为N2O4+O3=N2O5+O2.实验装置如图,回答下列问题:
①写出装置A中发生反应的离子方程式:
②装置B的名称为
③实验时,将三口烧瓶C浸入冰水中,打开装置A中分液漏斗的活塞,一段时间后C中液体变为红棕色。然后打开活塞K,通过臭氧发生器向三口烧瓶中通入含有臭氧的氧气。C中二氯甲烷(CH2Cl2)的作用是
(3)判断C中反应已结束的简单方法是
(4)原装置存在一处明显的错误为
(5)该兴趣小组用滴定法测定N2O5粗产品中N2O4的含量。
取2.0 g粗产品,加入25.00 mL 0.1000 mol/L酸性高锰酸钾溶液。充分反应后,用0.1000 mol/L H2O2溶液滴定剩余的高锰酸钾,达到滴定终点时,消耗H2O2溶液20.00 mL。(已知:H2O2与HNO3不反应且不考虑其分解),i、则产品中N2O4的含量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】高锰酸钾是一种应用领域非常广泛的强氧化剂。实验室中可用K2MnO4歧化法或电解K2MnO4的方法制备高锰酸钾。
(1)K2MnO4歧化法制备高锰酸钾的流程如下图(部分不含锰元素的产物已略去)。

①操作1是____________ 。
②“熔融”过程中反应的化学方程式是____________ 。
③酸化时,理论上最高只有66.7%的锰元素转化为KMnO4,解释其原因:____________ 。
④已知:相关物质不同温度下的溶解度(单位:g)数据如表:
结晶法得到的粗KMnO4中一般含有少量KCl杂质。“酸化”时所用的酸也会影响其他杂质含量。为减少杂质含量,下列酸化时最适宜的物质是____________ 。
A.醋酸 B.CO2 C.硫酸
(2)电解K2MnO4溶液的方法制备高锰酸钾。
①KMnO4在____________ .(填“阴”或“阳”)极生成。
②研究表明:在恒定电流的条件下进行电解时,K2MnO4的转化率和电流效率(通过单位电量时KMnO4实际产量与理论产量之比)随时间的变化如图所示。

解释图中电流效率变化的原因____________ 。
(1)K2MnO4歧化法制备高锰酸钾的流程如下图(部分不含锰元素的产物已略去)。

①操作1是
②“熔融”过程中反应的化学方程式是
③酸化时,理论上最高只有66.7%的锰元素转化为KMnO4,解释其原因:
④已知:相关物质不同温度下的溶解度(单位:g)数据如表:
| KMnO4 | CH3COOK | K2SO4 | KCl | K2CO3 | KHCO3 | |
| 20℃ | 6.34. | 217 | 11.1 | 34.2 | 111 | 33.7 |
| 90℃ | 45.2 | 398 | 22.9 | 53.9 |
结晶法得到的粗KMnO4中一般含有少量KCl杂质。“酸化”时所用的酸也会影响其他杂质含量。为减少杂质含量,下列酸化时最适宜的物质是
A.醋酸 B.CO2 C.硫酸
(2)电解K2MnO4溶液的方法制备高锰酸钾。
①KMnO4在
②研究表明:在恒定电流的条件下进行电解时,K2MnO4的转化率和电流效率(通过单位电量时KMnO4实际产量与理论产量之比)随时间的变化如图所示。

解释图中电流效率变化的原因
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】铁有两种氯化物,它们的一些性质及制备方法如下:Ⅰ氯化铁:熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。工业上采用向500-600℃的铁粉中通入氯气来生产无水氯化铁。Ⅱ氯化亚铁:熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
实验室可用如图所示的装置模拟工业生产无水氯化铁,试回答下列问题:

(1)装置A用于 固体与浓盐酸反应制氯气,将下列离子方程补充完整并配平
固体与浓盐酸反应制氯气,将下列离子方程补充完整并配平___________ 。
___________ ___________
___________ ___________=___________
___________=___________ ___________
___________ ___________
___________
(2)弯曲的a管所起的作用是___________ ;装置采用较粗的导管来连接装有铁粉的硬质玻璃管和广口瓶C,其目的是___________ 。
(3)导管b口应与___________ (从虚线框内装置中选择装置,用字母代号填空)连接,这样可避免反应系统与环境间的相互影响,相互影响包括___________ 。
(4)实验完成后,取广口瓶C中收集到的产物(已去除铁粉)进行如下测定分析:
①称取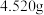 样品溶于过量的稀盐酸中;②加入足量
样品溶于过量的稀盐酸中;②加入足量 ;③再加入足量
;③再加入足量 溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为
溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为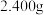 。
。
①写出第②步加入 发生的离子反应方程式
发生的离子反应方程式___________ 。
②经计算,得该样品中铁元素的质量分数为___________ %(结果精确到小数点后两位)。
(5)由以上数据分析和计算得出结论:
①用此装置制得的无水氯化铁含铁量___________ (填“偏高”或“偏低”),显然其中含有较多的___________ (填化学式)杂质。
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是___________ 。
实验室可用如图所示的装置模拟工业生产无水氯化铁,试回答下列问题:

(1)装置A用于
 固体与浓盐酸反应制氯气,将下列离子方程补充完整并配平
固体与浓盐酸反应制氯气,将下列离子方程补充完整并配平___________
 ___________
___________ ___________=___________
___________=___________ ___________
___________ ___________
___________(2)弯曲的a管所起的作用是
(3)导管b口应与
(4)实验完成后,取广口瓶C中收集到的产物(已去除铁粉)进行如下测定分析:
①称取
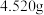 样品溶于过量的稀盐酸中;②加入足量
样品溶于过量的稀盐酸中;②加入足量 ;③再加入足量
;③再加入足量 溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为
溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为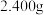 。
。①写出第②步加入
 发生的离子反应方程式
发生的离子反应方程式②经计算,得该样品中铁元素的质量分数为
(5)由以上数据分析和计算得出结论:
①用此装置制得的无水氯化铁含铁量
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是
您最近一年使用:0次
【推荐1】综合利用CO2对环境保护及能开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是______________ 。
a. 可在碱性氧化物中寻找
b. 可在ⅠA、ⅡA族元素形成的氧化物中寻找
c. 可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是__________________________ 。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O CO+H2+O2,已知:
CO+H2+O2,已知:
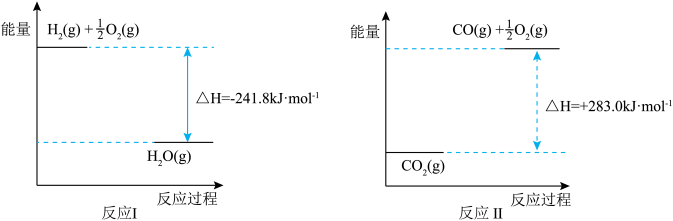
反应A的热化学方程式是___________________________ 。用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s) 2NH3(g)+CO2(g).实验测得的有关数据见上表.( t1<t2<t3)氨基甲酸铵分解反应是
2NH3(g)+CO2(g).实验测得的有关数据见上表.( t1<t2<t3)氨基甲酸铵分解反应是________ 反应(“放热”、“吸热”).在15℃,此反应的化学平衡常数为:__________ .

(4)高温电解技术能高效实现(3)中反应A,工作原理示意图如下:
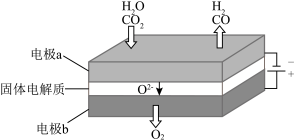
① 电极b发生______________ (填“氧化”或“还原”)反应。
② CO2在电极a放电的反应式是___________________________ 。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是
a. 可在碱性氧化物中寻找
b. 可在ⅠA、ⅡA族元素形成的氧化物中寻找
c. 可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O
 CO+H2+O2,已知:
CO+H2+O2,已知:
反应A的热化学方程式是
 2NH3(g)+CO2(g).实验测得的有关数据见上表.( t1<t2<t3)氨基甲酸铵分解反应是
2NH3(g)+CO2(g).实验测得的有关数据见上表.( t1<t2<t3)氨基甲酸铵分解反应是
(4)高温电解技术能高效实现(3)中反应A,工作原理示意图如下:

① 电极b发生
② CO2在电极a放电的反应式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】CO2加氢可转化为高附加值的CO、CH4、CH3OH等C1产物。该过程可缓解CO2带来的环境压力,同时可变废为宝,带来巨大的经济效益。CO2加氢过程,主要发生如下三个竞争反应:
反应ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.0 kJ/mol
CH3OH(g)+H2O(g) ΔH1=-49.0 kJ/mol
反应ⅱ:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH2=-165.0 kJ/mol
CH4(g)+2H2O(g) ΔH2=-165.0 kJ/mol
反应ⅲ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH3=+41.17 kJ/mol
CO(g)+H2O(g) ΔH3=+41.17 kJ/mol
回答下列问题:
(1)由CO、H2合成甲醇的热化学方程式为_______ 。
(2)反应ⅲ为逆水煤气变换反应,简称RWGS。以金属催化剂为例,该反应历程的微观示意和相对能量(eV)变化图如图所示( 为催化剂,
为催化剂, 为O原子,
为O原子, 为C原子,
为C原子, 为H原子):
为H原子):
历程I:
历程II:
历程III:
①历程Ⅰ方框内反应的方程式为CO2*+*=CO*+O*(*为催化剂活性位点)。根据图示,其反应热ΔH_______ 0(填“>”或“<”)。
②反应历程Ⅱ方框内的方程式是_______ 。
③反应历程中_______ (填“历程I”“历程II”或“历程III”)是RWGS的控速步骤。
(3)电解法转化CO2可实现CO2资源化利用,电解CO2制HCOOH的原理示意图如图。

①a、b表示CO2进气管,其中_______ (填“a”或“b”)管是不需要的。
②写出阴极的电极反应式:_______ 。
③电解一段时间后,若两侧电解液中K+物质的量相差为0.04 mol,则阳极池产生的气体在标准状况下的总体积为_______ L(假设产生的气体全部逸出)。
反应ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-49.0 kJ/mol
CH3OH(g)+H2O(g) ΔH1=-49.0 kJ/mol反应ⅱ:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH2=-165.0 kJ/mol
CH4(g)+2H2O(g) ΔH2=-165.0 kJ/mol反应ⅲ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3=+41.17 kJ/mol
CO(g)+H2O(g) ΔH3=+41.17 kJ/mol回答下列问题:
(1)由CO、H2合成甲醇的热化学方程式为
(2)反应ⅲ为逆水煤气变换反应,简称RWGS。以金属催化剂为例,该反应历程的微观示意和相对能量(eV)变化图如图所示(
 为催化剂,
为催化剂, 为O原子,
为O原子, 为C原子,
为C原子, 为H原子):
为H原子):历程I:

历程II:

历程III:

①历程Ⅰ方框内反应的方程式为CO2*+*=CO*+O*(*为催化剂活性位点)。根据图示,其反应热ΔH
②反应历程Ⅱ方框内的方程式是
③反应历程中
(3)电解法转化CO2可实现CO2资源化利用,电解CO2制HCOOH的原理示意图如图。

①a、b表示CO2进气管,其中
②写出阴极的电极反应式:
③电解一段时间后,若两侧电解液中K+物质的量相差为0.04 mol,则阳极池产生的气体在标准状况下的总体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】
(1)氨的合成是最重要的化工生产之一,工业上合成氨用的H2有多种制取的方法。用天然气跟水蒸气反应:CH4(g)+H2O(g) CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________ 。

(2)已知通常状况下,每充分燃烧1gCO并恢复到原状态,会释放10KJ的热量。请写出表示CO燃烧热的热化学反应方程式:________________________________ 。
(3)一种甲烷燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接通入甲烷,同时向一个电极通入空气。此电池的负极电极反应式是_______________ 。
(4)利用右图装置可以模拟铁的电化学防护。

① 若X为碳棒,为减缓铁的腐蚀,开关K应置于______ 处。假设海水中只有NaCl溶质,写出此时总离子反应方程式:__________________________________________ 。
② 若X为锌,开关K置于M处,该电化学防护法称为_________ 。写出铁电极处的电极反应式:_____________________________ 。
(1)氨的合成是最重要的化工生产之一,工业上合成氨用的H2有多种制取的方法。用天然气跟水蒸气反应:CH4(g)+H2O(g)
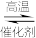 CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=
(2)已知通常状况下,每充分燃烧1gCO并恢复到原状态,会释放10KJ的热量。请写出表示CO燃烧热的热化学反应方程式:
(3)一种甲烷燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接通入甲烷,同时向一个电极通入空气。此电池的负极电极反应式是
(4)利用右图装置可以模拟铁的电化学防护。

① 若X为碳棒,为减缓铁的腐蚀,开关K应置于
② 若X为锌,开关K置于M处,该电化学防护法称为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】某强酸性溶液X,可能含有Al3+、Ba2+、 、Fe2+、Fe3+、
、Fe2+、Fe3+、 、
、 、
、 、
、 中的一种或几种离子,取该溶液进行实验,其现象及转化如图。反应过程中有一种气体是红棕色。请回答下列问题:
中的一种或几种离子,取该溶液进行实验,其现象及转化如图。反应过程中有一种气体是红棕色。请回答下列问题:
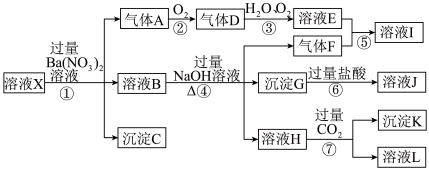
(1)由强酸性条件即可判断溶液X中一定不存在的离子有__________ 。
(2)溶液X中,关于 的判断一定正确的是
的判断一定正确的是__________ 。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为________ 。
(4)转化④中产生H的离子方程式为__________ 。
(5)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为________ 。
(6)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是_______ 。
①NaOH溶液 ②KSCN溶液 ③石蕊试剂 ④pH试纸 ⑤KMnO4溶液 ⑥氯水和KSCN的混合溶液
 、Fe2+、Fe3+、
、Fe2+、Fe3+、 、
、 、
、 、
、 中的一种或几种离子,取该溶液进行实验,其现象及转化如图。反应过程中有一种气体是红棕色。请回答下列问题:
中的一种或几种离子,取该溶液进行实验,其现象及转化如图。反应过程中有一种气体是红棕色。请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有
(2)溶液X中,关于
 的判断一定正确的是
的判断一定正确的是a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为
(4)转化④中产生H的离子方程式为
(5)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为
(6)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是
①NaOH溶液 ②KSCN溶液 ③石蕊试剂 ④pH试纸 ⑤KMnO4溶液 ⑥氯水和KSCN的混合溶液
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】某无色透明溶液中可能大量存在 、
、 、
、 、
、 、
、 中的几种离子。
中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是___________ 。
(2)取少量原溶液,向其中加入过量氯化钡,有白色沉淀生成,说明原溶液中肯定存在的离子是___________ ,有关反应的离子方程式为___________ 。
(3)向(2)的滤液中加入过量NaOH溶液,也有白色沉淀生成,说明原溶液中肯定存在的离子是___________ ,有关反应的离子方程式为___________ 。
(4)检验原溶液中存在 的实验方法是
的实验方法是___________ 。
 、
、 、
、 、
、 、
、 中的几种离子。
中的几种离子。(1)不做任何实验就可以肯定原溶液中不存在的离子是
(2)取少量原溶液,向其中加入过量氯化钡,有白色沉淀生成,说明原溶液中肯定存在的离子是
(3)向(2)的滤液中加入过量NaOH溶液,也有白色沉淀生成,说明原溶液中肯定存在的离子是
(4)检验原溶液中存在
 的实验方法是
的实验方法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某溶液由Ba2+、Fe3+、Na+、Cu2+、SO42-、Cl-、AlO2-、CO32-中的若干种离子组成。取适量该溶液进行如下实验:①向其中加入过量盐酸,有气体生成,并得到无色透明溶液;②向①所得的溶液中加入过量氨水,产生白色沉淀,过滤;③向②所得的滤液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;④向③所得的滤液中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀。根据上述实验回答下列问题:
(1)原溶液中一定不存在的离子是__________________________ ;
(2)原溶液中可能存在的离子是________ 。为检验该离子是否存在,应补充的实验为(写出实验过程):____ 。
(1)原溶液中一定不存在的离子是
(2)原溶液中可能存在的离子是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
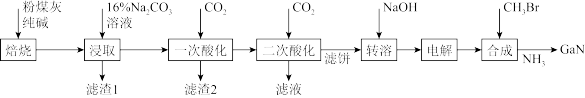
【推荐1】金属镓被称为“电子工业脊梁”,性质与铝相似,金属活动性介于锌和铁之间。氮化镓是5G技术中广泛应用的新型半导体材料,利用粉煤灰(主要成分为 、
、 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
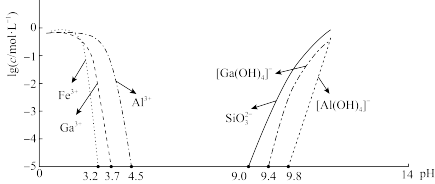
已知:常温下,相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度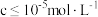 时,可认为已除尽。
时,可认为已除尽。
回答下列问题:
(1)“焙烧”的目的是将 转化为
转化为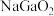 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(2)“滤渣1”主要成分为_______ 。
(3)“二次酸化”的pH≈_______ ,其中 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(4)“电解”可得金属Ga,写出阴极电极反应式_______ 。
(5)“合成”得到的三甲基镓与NH3反应时,两者物质的量之比为_______ 。
(6)常温下,反应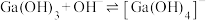 的平衡常数K=
的平衡常数K=_______ 。
 、
、 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
已知:常温下,相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度
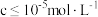 时,可认为已除尽。
时,可认为已除尽。
回答下列问题:
(1)“焙烧”的目的是将
 转化为
转化为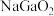 ,该反应的化学方程式为
,该反应的化学方程式为(2)“滤渣1”主要成分为
(3)“二次酸化”的pH≈
 发生反应的离子方程式为
发生反应的离子方程式为(4)“电解”可得金属Ga,写出阴极电极反应式
(5)“合成”得到的三甲基镓与NH3反应时,两者物质的量之比为
(6)常温下,反应
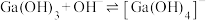 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】废旧磷酸铁锂( )电池的正极材料中主要含有
)电池的正极材料中主要含有 、Al、石墨以及少量难溶性的杂质,为了减少环境污染、缓解资源短缺,通过下图流程制备碳酸锂(
、Al、石墨以及少量难溶性的杂质,为了减少环境污染、缓解资源短缺,通过下图流程制备碳酸锂( ),以实现资源的回收利用。
),以实现资源的回收利用。

已知:25℃时,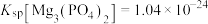 ,
,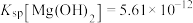 。
。
回答下列问题:
(1)为了提高废料的浸出效果,可采取的措施是_______ (回答一项即可)。
(2)已知滤渣①中含 ,“浸出”过程中有
,“浸出”过程中有 生成,则“浸出”时发生的主要反应的离子方程式为
生成,则“浸出”时发生的主要反应的离子方程式为_______ 。工业生产中选择 而不用双氧水的优点是
而不用双氧水的优点是_______ 。
(3)滤液①中仍有少量的 ,则“除磷”时发生反应的化学方程式为
,则“除磷”时发生反应的化学方程式为_______ 。
(4)“除铁铝”中须控制溶液的pH<8.8,滤渣③的主要成分是_______ (填化学式)。若省略该过程会导致_______ 。
(5)“沉锂”后可水洗除去 表面的杂质,得到纯度较高的
表面的杂质,得到纯度较高的 ,判断
,判断 洗净的方法是
洗净的方法是_______ 。
 )电池的正极材料中主要含有
)电池的正极材料中主要含有 、Al、石墨以及少量难溶性的杂质,为了减少环境污染、缓解资源短缺,通过下图流程制备碳酸锂(
、Al、石墨以及少量难溶性的杂质,为了减少环境污染、缓解资源短缺,通过下图流程制备碳酸锂( ),以实现资源的回收利用。
),以实现资源的回收利用。
已知:25℃时,
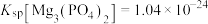 ,
,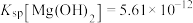 。
。回答下列问题:
(1)为了提高废料的浸出效果,可采取的措施是
(2)已知滤渣①中含
 ,“浸出”过程中有
,“浸出”过程中有 生成,则“浸出”时发生的主要反应的离子方程式为
生成,则“浸出”时发生的主要反应的离子方程式为 而不用双氧水的优点是
而不用双氧水的优点是(3)滤液①中仍有少量的
 ,则“除磷”时发生反应的化学方程式为
,则“除磷”时发生反应的化学方程式为(4)“除铁铝”中须控制溶液的pH<8.8,滤渣③的主要成分是
(5)“沉锂”后可水洗除去
 表面的杂质,得到纯度较高的
表面的杂质,得到纯度较高的 ,判断
,判断 洗净的方法是
洗净的方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】利用含锶(Sr)废渣制备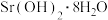 晶体的流程如下。
晶体的流程如下。

已知:i.含锶废渣中 主要以
主要以 和
和 的形式存在
的形式存在
ii.25℃,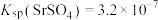 ,
,
(1)转化
①转化前,含锶废渣需要粉碎研磨的目的是___________ 。
②已知 溶液显弱碱性,结合化学用语解释其原因:
溶液显弱碱性,结合化学用语解释其原因:___________ 。
③转化过程中,向 中加入氨水,提高溶液
中加入氨水,提高溶液 ,目的是提高
,目的是提高___________ (填粒子符号)的浓度,将 转化为
转化为 。
。
(2)溶出
溶出过程发生反应的离子方程式是___________ 。
(3)纯化
溶出液中除了含有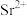 外,还含有
外,还含有 和少量
和少量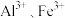 等杂质,其中
等杂质,其中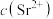 与
与 近似相等。纯化过程涉及操作如下。
近似相等。纯化过程涉及操作如下。

已知:iii.25℃,Fe3+和 沉淀时的
沉淀时的 (金属离子浓度均为
(金属离子浓度均为 ):
):
iv.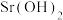 和
和 在不同温度下的溶解度:
在不同温度下的溶解度:
①为了除去溶出液中的 和
和 ,应调节
,应调节 范围为
范围为___________ 。
②滤液1中加入适量 调节
调节 至14和升温至90℃有利于
至14和升温至90℃有利于 析出的原因是
析出的原因是___________ 。
③90℃,时,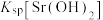
___________ (填“>”或“<”)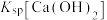 。
。
④操作X是加热浓缩、___________ 、___________ 、洗涤。
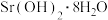 晶体的流程如下。
晶体的流程如下。
已知:i.含锶废渣中
 主要以
主要以 和
和 的形式存在
的形式存在ii.25℃,
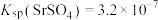 ,
,
(1)转化
①转化前,含锶废渣需要粉碎研磨的目的是
②已知
 溶液显弱碱性,结合化学用语解释其原因:
溶液显弱碱性,结合化学用语解释其原因:③转化过程中,向
 中加入氨水,提高溶液
中加入氨水,提高溶液 ,目的是提高
,目的是提高 转化为
转化为 。
。(2)溶出
溶出过程发生反应的离子方程式是
(3)纯化
溶出液中除了含有
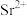 外,还含有
外,还含有 和少量
和少量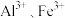 等杂质,其中
等杂质,其中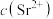 与
与 近似相等。纯化过程涉及操作如下。
近似相等。纯化过程涉及操作如下。
已知:iii.25℃,Fe3+和
 沉淀时的
沉淀时的 (金属离子浓度均为
(金属离子浓度均为 ):
):| 氢氧化物 | 开始沉降 | 沉淀完全 | 沉淀开始溶解 |
 | 2.3 | 4.1 | - |
 | 4.0 | 5.2 | 7.8 |
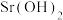 和
和 在不同温度下的溶解度:
在不同温度下的溶解度:| 温度/℃ 溶解度/g 氢氧化物 | 20 | 40 | 60 | 80 | 90 |
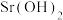 | 1.77 | 3.95 | 8.42 | 20.2 | 44.5 |
 | 0.173 | 0.141 | 0.121 | 0.094 | 0.086 |
 和
和 ,应调节
,应调节 范围为
范围为②滤液1中加入适量
 调节
调节 至14和升温至90℃有利于
至14和升温至90℃有利于 析出的原因是
析出的原因是③90℃,时,
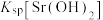
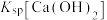 。
。④操作X是加热浓缩、
您最近一年使用:0次



