下表是元素周期表的一部分,回答相关问题。
(1)元素①和⑦形成的化合物的化学式为___________ 。
(2)元素⑥的过氧化物的电子式___________ ,其最高价氧化物对应的水化物中含有的化学键类型为___________ 。
(3)元素⑥、⑦、⑧、⑨的简单离子半径由大到小的顺序为___________ (用离子符号表示);元素④、⑤、⑧、⑨的最简单氢化物中稳定性最强的是___________ (填化学式)。
(4)最近,德国科学家实现了铷原子气体超流体态与绝缘体态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。关于铷的下列说法不正确的是___________ (填序号)。
a.与水反应比钠反应更剧烈
b.单质具有很强的氧化性
c.Rb2O在空气中不会吸收水和二氧化碳
d.Rb2O2能与水剧烈反应并释放氧气
e.RbOH的碱性比同浓度的NaOH溶液弱
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(2)元素⑥的过氧化物的电子式
(3)元素⑥、⑦、⑧、⑨的简单离子半径由大到小的顺序为
(4)最近,德国科学家实现了铷原子气体超流体态与绝缘体态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。关于铷的下列说法不正确的是
a.与水反应比钠反应更剧烈
b.单质具有很强的氧化性
c.Rb2O在空气中不会吸收水和二氧化碳
d.Rb2O2能与水剧烈反应并释放氧气
e.RbOH的碱性比同浓度的NaOH溶液弱
更新时间:2023-06-15 16:23:34
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】A、B、C、D、E、F是原子序数依次递增的前四周期元素。A是宇宙中含量最丰富的元素;D与E同主族,且E的原子序数是D的两倍;B与D组成的化合物是一种温室气体;C元素原子最外层P能级比S能级多1个电子;F原子的最外层电子数与A相同,其余各层均充满。据此回答下列问题。
(1)F元素形成的高价基态离子的核外电子排布式为__________ 。
(2)E的一种具有强还原性的氧化物分子的VSEPR模型为__________ 。
(3)C、D、E元素的第一电离能由大到小的顺序是__________ 。(用元素符号表示)
(4)A和D形成的18电子化合物难溶于BE2,其理由是__________ ,此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为__________
(5)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是__________ 。
(6)F与C形成化合物的晶胞如图所示,该化合物的化学式为_____________ ,C离子的配位数是_____________ 。

(1)F元素形成的高价基态离子的核外电子排布式为
(2)E的一种具有强还原性的氧化物分子的VSEPR模型为
(3)C、D、E元素的第一电离能由大到小的顺序是
(4)A和D形成的18电子化合物难溶于BE2,其理由是
(5)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是
(6)F与C形成化合物的晶胞如图所示,该化合物的化学式为

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】下表为元素周期表的短周期部分。请填空。
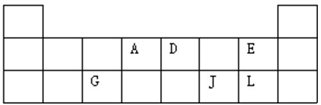
(1)写出 A 原子的最外层电子的轨道表示式___________ ,G、J、L 三种元素形成的简单离子中, 离子半径最小的是___________ ,D 元素的气态氢化物的电子式为___________ ;
(2)A 元素可形成化合物 Fe(AO)5,该物质常温下呈液态,熔点为-20.5℃,沸点为 103℃,易溶于 非极性溶液,据此可判断 Fe(AO)5 晶体属于______________ (填晶体类型);
(3)将 G 元素的最高价氧化物对应的水化物溶解在稀硫酸中,写出反应的离子方程式___________ ;当足量的铁和 2mol 单质 L 发生反应时,电子转移了___________ mol;
(4)J 与 L 分别与氢元素形成的气态氢化物的稳定性关系为:___________ >___________ (填化学式)。

(1)写出 A 原子的最外层电子的轨道表示式
(2)A 元素可形成化合物 Fe(AO)5,该物质常温下呈液态,熔点为-20.5℃,沸点为 103℃,易溶于 非极性溶液,据此可判断 Fe(AO)5 晶体属于
(3)将 G 元素的最高价氧化物对应的水化物溶解在稀硫酸中,写出反应的离子方程式
(4)J 与 L 分别与氢元素形成的气态氢化物的稳定性关系为:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】几种主族元素在周期表中的位置如下:
(1)①⑨形成的化合物属于___________ (填“离子化合物”或“共价化合物”),用电子式表示其形成过程___________ 。
(2)以上元素的最高价氧化物对应的水化物的酸性最强的分子式为___________ 。
(3)比较⑦、⑧简单氢化物的还原性:___________ (填化学式);比较①、⑥、⑦三种简单离子的半径大小,其由大到小的顺序___________ (填离子符号)。
(4)下列可以判断①和③金属性强弱的是___________(填字母)。
(5)金属镓 常用作光学玻璃、真空管、半导体的原料。
常用作光学玻璃、真空管、半导体的原料。
预测 的化学性质并填写表格:
的化学性质并填写表格:
以上预测都是依据___________ 。
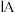 | 0 | |||||||
| 1 | ④ | 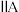 | 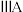 | 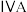 | 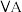 | 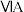 | 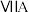 | |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ⑨ | ⑦ | ||||
| 4 | ② |  | ⑧ | |||||
(2)以上元素的最高价氧化物对应的水化物的酸性最强的分子式为
(3)比较⑦、⑧简单氢化物的还原性:
(4)下列可以判断①和③金属性强弱的是___________(填字母)。
A.单质的熔点: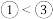 | B.化合价: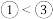 |
| C.单质与水反应的剧烈程度:①>③ | D.最高价氧化物对应水化物的碱性:①>③ |
 常用作光学玻璃、真空管、半导体的原料。
常用作光学玻璃、真空管、半导体的原料。预测
 的化学性质并填写表格:
的化学性质并填写表格:| 预测性质(所填物质类别不同) | 反应后可能的生成物(填化学式) |
 能与 能与 | 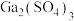 、 、 |
 能与 能与 | 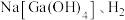 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】下表列出了①~⑩十种元素在周期表中的位置:
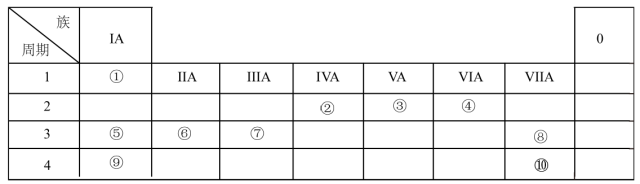
请按要求回答下列问题:
(1)元素⑤的原子结构示意图为___ ;元素②的最高价氧化物的电子式是___ 。
(2)⑤、⑥、⑨三种元素原子半径由大到小的顺序是___ (填元素符号);这三种元素最高价氧化物对应水化物中碱性最强的是___ (填化学式)。
(3)③、④元素的简单氢化物的稳定性较弱的是___ (填化学式)。
(4)①、②、④三种元素形成的有机物的分子结构模型如图所示,写出该有机物的结构简式:___ ;①与②所形成的最简单的烯烃与溴的四氯化碳溶液反应的化学方程式:___ 。

(5)元素⑦的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式:___ 。
(6)写出元素⑨的单质与水反应的化学方程式:___ 。
(7)请从原子结构的角度解释,元素⑧非金属性比元素⑩强的原因:___ 。

请按要求回答下列问题:
(1)元素⑤的原子结构示意图为
(2)⑤、⑥、⑨三种元素原子半径由大到小的顺序是
(3)③、④元素的简单氢化物的稳定性较弱的是
(4)①、②、④三种元素形成的有机物的分子结构模型如图所示,写出该有机物的结构简式:

(5)元素⑦的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式:
(6)写出元素⑨的单质与水反应的化学方程式:
(7)请从原子结构的角度解释,元素⑧非金属性比元素⑩强的原因:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】六种短周期元素在周期表中的相对位置如下所示,其中E元素原子核外电子总数是其最外层电子数的3倍。关于元素周期表及这六种元素性质,请回答:

(1)这六种元素的氢化物中,最稳定的是___________ .(写化学式);
(2)AF2的结构式为_____________ .
(3)在一定条件下,由B单质与H2反应生成1 molG气体时,放出的热量为46.2 kJ,写出该反应的热化学方程式:_____________________ .
(4)工业上用G检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质B生成,写出化学方程式__________________________ .该反应中被氧化的G与参与反应的G的质量之比__________ .
(5)F的单质可由其氧化物与氢化物反应生成,写出该反应的化学方程式:__________ .

(1)这六种元素的氢化物中,最稳定的是
(2)AF2的结构式为
(3)在一定条件下,由B单质与H2反应生成1 molG气体时,放出的热量为46.2 kJ,写出该反应的热化学方程式:
(4)工业上用G检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质B生成,写出化学方程式
(5)F的单质可由其氧化物与氢化物反应生成,写出该反应的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】2021年5月15日,“天问一号”探测器成功实现环绕器和着陆巡视器的“两器分离”并成功着陆。“天问一号”采用了我国自主研制的高性能碳化硅增强铝基复合材料。工业上制取碳化硅的化学反应方程式为: ,回答下列问题。
,回答下列问题。
(1)请写出X的化学式___________ 。决定元素种类的微粒是___________ 。
(2)若生成4g碳化硅,生成X气体的体积在标准状况下为___________ L。
(3)从结构层面解释碳化硅材料硬度高的原因___________ 。以下不含共价键的离子晶体是___________ 。
A. 氯化钠 B. 硝酸钾 C. 碳化硅 D. 晶体硅
(4)写出 的电子式
的电子式___________ 。写出 的结构式
的结构式___________ 。
(5)上述材料所涉及元素中,某元素原子核外的M层上有3个电子数,则其离子结构示意图为___________ ;某元素的最外层电子数是其核外电子层数3倍,则其简单离子的电子式为___________ ,请写出与它具有相同电子数的四核微粒的化学式___________
(6)硅元素存在多种同位素。已知三种天然稳定同位素的数据如下:
请列出硅元素的相对原子质量为的计算式___________ 。放射性同位素在实际生活中有许多方面的用途,请列举一条___________ 。
 ,回答下列问题。
,回答下列问题。(1)请写出X的化学式
(2)若生成4g碳化硅,生成X气体的体积在标准状况下为
(3)从结构层面解释碳化硅材料硬度高的原因
A. 氯化钠 B. 硝酸钾 C. 碳化硅 D. 晶体硅
(4)写出
 的电子式
的电子式 的结构式
的结构式(5)上述材料所涉及元素中,某元素原子核外的M层上有3个电子数,则其离子结构示意图为
(6)硅元素存在多种同位素。已知三种天然稳定同位素的数据如下:
| 硅的同位素 | 同位素的相对原子质量 | 自然界中各同位素原子的丰度 |
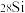 | 27.977 | 92.23% |
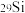 | 28.976 | 4.67% |
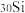 | 29.974 | 3.10% |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:
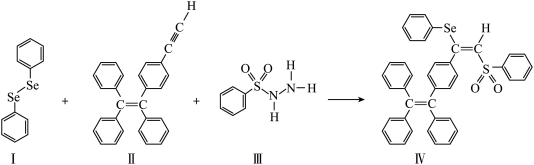
(1)Se与S同主族,Se在元素周期表中的位置为___________ ,用电子式写出 的形成过程
的形成过程___________ 。
(2) 是一种有恶臭的气体,常作半导体用料。与
是一种有恶臭的气体,常作半导体用料。与 相比,沸点
相比,沸点
___________  (填“>”或“<”,下同),原因是
(填“>”或“<”,下同),原因是___________ ;热稳定性:
___________  。
。
(3)研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属㸰引起的中毒。Na、Se、O形成的简单离子的半径由大到小的顺序为
)可减轻重金属㸰引起的中毒。Na、Se、O形成的简单离子的半径由大到小的顺序为___________ 。
(4)反应物Ⅲ的局部结构与肼( )十分相似,
)十分相似, 与
与 性质十分相似,肼可与过量的硫酸反应生成酸式盐,该酸式盐化学式为
性质十分相似,肼可与过量的硫酸反应生成酸式盐,该酸式盐化学式为___________ ,以为原料合成的液体火箭燃料偏二甲肼( ),偏二甲肼与液态氧化剂
),偏二甲肼与液态氧化剂 接触立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,该反应的化学方程式为
接触立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,该反应的化学方程式为___________ ,已知1g偏二甲肼发生此反应发出42.5KJ热量,则该反应的反应热为___________ 。

(1)Se与S同主族,Se在元素周期表中的位置为
 的形成过程
的形成过程(2)
 是一种有恶臭的气体,常作半导体用料。与
是一种有恶臭的气体,常作半导体用料。与 相比,沸点
相比,沸点
 (填“>”或“<”,下同),原因是
(填“>”或“<”,下同),原因是
 。
。(3)研究发现,给小鼠喂食适量硒酸钠(
 )可减轻重金属㸰引起的中毒。Na、Se、O形成的简单离子的半径由大到小的顺序为
)可减轻重金属㸰引起的中毒。Na、Se、O形成的简单离子的半径由大到小的顺序为(4)反应物Ⅲ的局部结构与肼(
 )十分相似,
)十分相似, 与
与 性质十分相似,肼可与过量的硫酸反应生成酸式盐,该酸式盐化学式为
性质十分相似,肼可与过量的硫酸反应生成酸式盐,该酸式盐化学式为 ),偏二甲肼与液态氧化剂
),偏二甲肼与液态氧化剂 接触立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,该反应的化学方程式为
接触立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,该反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】为纪念元素周期表诞生150周年,IUPAC等从世界范围征集优秀青年化学家提名,形成一张“青年化学家元素周期表”,向世界介绍118位优秀青年化学家,有8位中国青年化学家成为“N、S、Hg、U”等元素的代言人。
(1)汞的原子结构示意图 ,汞在元素周期表中位于第
,汞在元素周期表中位于第_______ 周期。
(2)氮在周期表第_______ 列,周期表中位置是_______ 。
(3)下列有关性质的比较,不能用元素周期律解释的是_______。
(4)非金属性:N>C,用一个化学方程式证明_______ 。
(1)汞的原子结构示意图
 ,汞在元素周期表中位于第
,汞在元素周期表中位于第(2)氮在周期表第
(3)下列有关性质的比较,不能用元素周期律解释的是_______。
| A.酸性:HCl>H2S | B.非金属性:O>S |
| C.碱性:NaOH>Mg(OH)2 | D.热稳定性:HCl>H2S |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】判断对错
1.具有相同核电荷数的微粒是同一种元素________
2.不同元素组成的多原子分子里的化学键一定是极性键________
3.最外层电子数为2的元素不一定属于主族元素________
4.可由 2CH3OH+3O2=2CO2+4H2O 反应 ,设计成原电池________
5.氢氧燃料电池,如图所示,a、b均为惰性电极。其中,b极为正极,电极反应是O2+4OH-+4e-=2H2O________

1.具有相同核电荷数的微粒是同一种元素
2.不同元素组成的多原子分子里的化学键一定是极性键
3.最外层电子数为2的元素不一定属于主族元素
4.可由 2CH3OH+3O2=2CO2+4H2O 反应 ,设计成原电池
5.氢氧燃料电池,如图所示,a、b均为惰性电极。其中,b极为正极,电极反应是O2+4OH-+4e-=2H2O

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】根据要求回答下列问题:
I. 写出下列物质或微粒的电子式:
(1)CO2_________________
(2)N2__________________
(3) Na2O_____________
(4)NaOH________________
II. 下列物质:①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧ I2 ⑨He
(1)含有共价键的离子化合物是(用序号回答)_____________
含有共价键的共价化合物是(用序号回答)_______________
(2)当其熔化时,不破坏化学键的是(用序号回答)______________ .
I. 写出下列物质或微粒的电子式:
(1)CO2
(2)N2
(3) Na2O
(4)NaOH
II. 下列物质:①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧ I2 ⑨He
(1)含有共价键的离子化合物是(用序号回答)
含有共价键的共价化合物是(用序号回答)
(2)当其熔化时,不破坏化学键的是(用序号回答)
您最近一年使用:0次

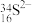 微粒中的质子数是
微粒中的质子数是

