钛及其化合物在生产、生活中有着广泛的用途。回答下列问题:
(1)Ti(BH4)3是一种储氢材料。BH 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为___ ;Ti、B、H元素的电负性由大到小排列顺序为_____ 。
(2)已知Ti3+易形成多种配合物,[TiCl(H2O)5]Cl2·H2O是其中的一种。
①1mol该配合物中含有_______ molσ键。
②Ti3+具有较强还原性的原因是___________ 。
(3)研究表明,TiO2通过氮掺杂反应可生成TiO2-xNy,能使TiO2对可见光具有活性,反应如图所示。
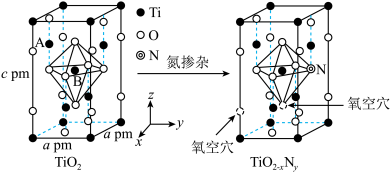
①上图TiO2晶胞中钛原子占据___________ 个氧原子围成的八面体空隙。
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为( ,
, ,
, ),则A点原子的分数坐标为(
),则A点原子的分数坐标为( ,0,
,0,___________ )。
③TiO2-xNy晶体中x=___________ 。
(1)Ti(BH4)3是一种储氢材料。BH
 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为(2)已知Ti3+易形成多种配合物,[TiCl(H2O)5]Cl2·H2O是其中的一种。
①1mol该配合物中含有
②Ti3+具有较强还原性的原因是
(3)研究表明,TiO2通过氮掺杂反应可生成TiO2-xNy,能使TiO2对可见光具有活性,反应如图所示。

①上图TiO2晶胞中钛原子占据
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为(
 ,
, ,
, ),则A点原子的分数坐标为(
),则A点原子的分数坐标为( ,0,
,0,③TiO2-xNy晶体中x=
更新时间:2023-07-28 15:45:21
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】下表列出了10种元素在周期表中的位置。用化学符号回答下列问题:
(1)10种元素中,第一电离能最大的是_______ ,电负性最小的金属元素是_______ 。
(2)①③⑥三种元素最高价氧化物对应的水化物中,碱性最强的是_______ 。
(3)②③④三种元素形成的简单离子,离子半径由大到小的顺序是_______ 。
(4)①和⑨的最高价氧化物对应的水化物的化学式分别为_______ 、_______ 。
(5)①和⑥的最高价氧化物对应的水化物相互反应的离子方程式为_______ 。
(6)用电子式表示第三周期主族元素中电负性最小的元素和电负性最大的元素形成化合物的过程:_______ 。
(7)⑨元素原子的价电子的轨道表示式为_______ 。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑤ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑥ | ⑧ | ⑩ | |||
| 第4周期 | ② | ④ | ⑨ |
(2)①③⑥三种元素最高价氧化物对应的水化物中,碱性最强的是
(3)②③④三种元素形成的简单离子,离子半径由大到小的顺序是
(4)①和⑨的最高价氧化物对应的水化物的化学式分别为
(5)①和⑥的最高价氧化物对应的水化物相互反应的离子方程式为
(6)用电子式表示第三周期主族元素中电负性最小的元素和电负性最大的元素形成化合物的过程:
(7)⑨元素原子的价电子的轨道表示式为
您最近一年使用:0次
【推荐2】下图是元素周期表中的前四周期,回答下列问题。

(1)a元素的基态原子的电子排布图是图①、②中的一个。
① ②
②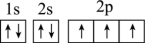
另一个电子排布图错误的原因是它不符合_______ (填字母)。
A.构造原理 B.泡利原理 C.洪特规则
b元素的正二价离子的价层电子排布图是_______ 。
(2)b、e两种元素的第四电离能大小关系为I4(Fe)_______ I4(Co) (填“>”“<”或“=”),原因是_______ 。
(3)已知元素c、f的最简单的化合物中共用电子对偏向f,元素c、g的最简单的化合物中共用电子对偏向c,则元素c、f、g的电负性由大到小的顺序为_______ (填元素符号)。
(4)某元素的原子价层电子排布式为nsn-1npn+1,该基态原子核外电子空间运动状态有_______ 种。
(5)d元素的下列粒子中,电离最外层一个电子所需能量最大的是_______(填字母)。
(6)下列现象与原子核外电子跃迁有关的是_______(填字母)

(1)a元素的基态原子的电子排布图是图①、②中的一个。
①
 ②
②
另一个电子排布图错误的原因是它不符合
A.构造原理 B.泡利原理 C.洪特规则
b元素的正二价离子的价层电子排布图是
(2)b、e两种元素的第四电离能大小关系为I4(Fe)
(3)已知元素c、f的最简单的化合物中共用电子对偏向f,元素c、g的最简单的化合物中共用电子对偏向c,则元素c、f、g的电负性由大到小的顺序为
(4)某元素的原子价层电子排布式为nsn-1npn+1,该基态原子核外电子空间运动状态有
(5)d元素的下列粒子中,电离最外层一个电子所需能量最大的是_______(填字母)。
A. | B. | C.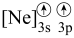 | D.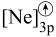 |
| A.激光 | B.LED灯光 | C.金属导电 | D.核辐射 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】卟啉化合物在生命科学、太阳能储存等众多领域具有广阔的应用前景。回答下列问题:
Ⅰ.四苯基金属锌卟啉配合物合成过程如下(ph-为苯基):
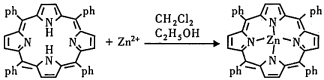
(1)配合物中基态 2+的核外电子排布式为
2+的核外电子排布式为___________ ,C原子的杂化类型为___________ 。
(2)合成过程所用的试剂乙醇中所含元素的电负性由大到小的顺序为___________ 。
(3)乙醇的沸点高于二氯甲烷的沸点,主要原因是___________ 。
Ⅱ. 研究表明利用卟啉配合物可大幅度提高钙钛矿太阳能电池器件的性能和稳定性。
(4)钙钛矿晶胞如图所示, 处于6个
处于6个 组成的
组成的___________ 空隙(填“四面体空隙”或“八面体空隙”)中。若 与
与 的最短距离为
的最短距离为 ,设
,设 为阿伏加德罗常数的值,则晶体的密度为
为阿伏加德罗常数的值,则晶体的密度为___________  (列出计算表达式)。
(列出计算表达式)。
(5)在钙钛矿晶胞结构的另一种表示中, 处于各顶点位置,则
处于各顶点位置,则 处于
处于___________ 位置。
Ⅰ.四苯基金属锌卟啉配合物合成过程如下(ph-为苯基):

(1)配合物中基态
 2+的核外电子排布式为
2+的核外电子排布式为(2)合成过程所用的试剂乙醇中所含元素的电负性由大到小的顺序为
(3)乙醇的沸点高于二氯甲烷的沸点,主要原因是
Ⅱ. 研究表明利用卟啉配合物可大幅度提高钙钛矿太阳能电池器件的性能和稳定性。
(4)钙钛矿晶胞如图所示,
 处于6个
处于6个 组成的
组成的 与
与 的最短距离为
的最短距离为 ,设
,设 为阿伏加德罗常数的值,则晶体的密度为
为阿伏加德罗常数的值,则晶体的密度为 (列出计算表达式)。
(列出计算表达式)。
(5)在钙钛矿晶胞结构的另一种表示中,
 处于各顶点位置,则
处于各顶点位置,则 处于
处于
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】锌及锌的化合物应用广泛。测定铜合金中的锌时要利用下列反应:[Zn(CN)4]2-+4HCHO+4H2O = Zn2++4HOCH2CN+4OH- 。回答下列问题:
(1)基态 Zn2+的电子排布式为___________ ,[Zn(CN)4]2-中 Zn2+与 CN-之间的化学键称为___________ ,CN-的电子式为___________ 。
(2)基态 C 原子核外电子占据___________ 个不同原子轨道,C、N、O 三种元素的电负性由大到小的 顺序为___________ 。
(3)HCHO 分子中碳原子轨道的杂化类型是___________ ,HOCH2CN 分子中含有的σ键与π键数目之 比为___________ 。
(4)S 与 Zn 所形成化合物晶体的晶胞如图所示。
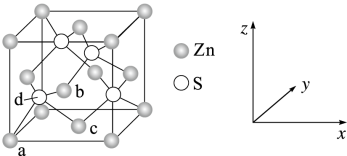
①在该晶胞中,Zn 的配位数为___________ 。
②原子坐标参数可表示晶胞内部各原子的相对位置。上图晶胞中,原子坐标参数 a 为(0,0,0);b为( ,0,
,0, );c为(
);c为( ,
, ,0),则 d 的原子坐标参数为
,0),则 d 的原子坐标参数为___________ 。
③已知该晶胞的密度为ρ g·cm-3,设 NA为阿伏加德罗常数的值,则其中两个 S 之间的最短距离 为___________ pm。(列出计算式即可)
(1)基态 Zn2+的电子排布式为
(2)基态 C 原子核外电子占据
(3)HCHO 分子中碳原子轨道的杂化类型是
(4)S 与 Zn 所形成化合物晶体的晶胞如图所示。

①在该晶胞中,Zn 的配位数为
②原子坐标参数可表示晶胞内部各原子的相对位置。上图晶胞中,原子坐标参数 a 为(0,0,0);b为(
 ,0,
,0, );c为(
);c为( ,
, ,0),则 d 的原子坐标参数为
,0),则 d 的原子坐标参数为③已知该晶胞的密度为ρ g·cm-3,设 NA为阿伏加德罗常数的值,则其中两个 S 之间的最短距离 为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】前四周期元素 的原子序数依次增大。
的原子序数依次增大。 位于同一周期且均为主族元素,基态
位于同一周期且均为主族元素,基态 原子
原子 能级的电子总数比
能级的电子总数比 能级的多1;基态
能级的多1;基态 原子的核外电子空间运动状态有7种;基态
原子的核外电子空间运动状态有7种;基态 原子中含6个未成对电子。回答下列问题:
原子中含6个未成对电子。回答下列问题:
(1) 的元素名称为
的元素名称为_______ ,位于周期表的_______ 区。
(2)元素S、T、V第一电离能由大到小的顺序为_______ (填元素符号)。
(3)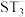 中
中 原子轨道的杂化类型为
原子轨道的杂化类型为_______ ,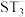 的空间结构为
的空间结构为_______ 。
(4)与同族其他元素 形成的
形成的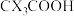 相比,
相比,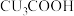 酸性更强,原因是
酸性更强,原因是_______ 。
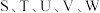 的原子序数依次增大。
的原子序数依次增大。 位于同一周期且均为主族元素,基态
位于同一周期且均为主族元素,基态 原子
原子 能级的电子总数比
能级的电子总数比 能级的多1;基态
能级的多1;基态 原子的核外电子空间运动状态有7种;基态
原子的核外电子空间运动状态有7种;基态 原子中含6个未成对电子。回答下列问题:
原子中含6个未成对电子。回答下列问题:(1)
 的元素名称为
的元素名称为(2)元素S、T、V第一电离能由大到小的顺序为
(3)
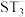 中
中 原子轨道的杂化类型为
原子轨道的杂化类型为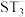 的空间结构为
的空间结构为(4)与同族其他元素
 形成的
形成的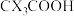 相比,
相比,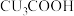 酸性更强,原因是
酸性更强,原因是
您最近一年使用:0次
【推荐3】我国的超级钢研究已居于世界领先地位,这种超级钢由不同比例的铁、锰、铬、钴、铝、钒等金属元素合成,其强度很大,在应用时能够实现钢板的轻薄化。回答问题:
(1)基态Fe原子中,电子占据的最高能层符号为_______ 。
(2)Mn在元素周期表中的位置为_______ ; 可与
可与 反应生成配合物,其组成为
反应生成配合物,其组成为 ,向1 mol该配合物中加入足量
,向1 mol该配合物中加入足量 溶液,能产生2 mol AgCl沉淀,若加入足量NaOH溶液、加热、无刺激性气味的气体产生,则1 mol该配合物中含有σ键的数目是
溶液,能产生2 mol AgCl沉淀,若加入足量NaOH溶液、加热、无刺激性气味的气体产生,则1 mol该配合物中含有σ键的数目是_______ ;其中 的VSEPR模型的名称是
的VSEPR模型的名称是_______ 。
(3)研究表明,当化合物的阳离子有未成对电子时,该化合物具有磁性。下列物质可用作录音带磁粉的是_______。
(4)氮化铬(CrN)在超级电容器领域有良好应用前景,其晶体结构类型与氯化钠相同。
①氮化铬的熔点比氯化钠高的主要原因是_______ 。
②晶胞中 的配位数为
的配位数为_______ 。
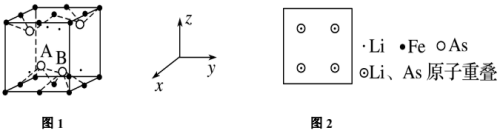
(5)LiFeAs可组成一种新型材料,其立方晶胞结构如图1所示。若晶胞参数为a nm, A、B处的两个As原子之间距离为_______ nm,请在下方图2上沿z轴方向投影图中画出铁原子的位置,用“·”表示_______ 。
(1)基态Fe原子中,电子占据的最高能层符号为
(2)Mn在元素周期表中的位置为
 可与
可与 反应生成配合物,其组成为
反应生成配合物,其组成为 ,向1 mol该配合物中加入足量
,向1 mol该配合物中加入足量 溶液,能产生2 mol AgCl沉淀,若加入足量NaOH溶液、加热、无刺激性气味的气体产生,则1 mol该配合物中含有σ键的数目是
溶液,能产生2 mol AgCl沉淀,若加入足量NaOH溶液、加热、无刺激性气味的气体产生,则1 mol该配合物中含有σ键的数目是 的VSEPR模型的名称是
的VSEPR模型的名称是(3)研究表明,当化合物的阳离子有未成对电子时,该化合物具有磁性。下列物质可用作录音带磁粉的是_______。
A. | B. | C. | D.ZnO |
①氮化铬的熔点比氯化钠高的主要原因是
②晶胞中
 的配位数为
的配位数为(5)LiFeAs可组成一种新型材料,其立方晶胞结构如图1所示。若晶胞参数为a nm, A、B处的两个As原子之间距离为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大,A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,C与B同主族,D元素的价电子数是其余电子数的一半,E与D同族,F与A同主族,回答下列问题:
(1)D、E所在周期原子最外层电子数为1的元素有____________ 种。
(2)A、B、C第一电离能由大到小的顺序为______________ (用元素符号表示);
(3)B与C形成的二元化合物中,属于非极性分子的是________ (填化学式);该分子中心原子的杂化类型为____________ ;
(4)E和F形成的一种化合物的晶体结构如图所示,则该化合物的化学式为______________ ;F的配位数为____________ ;

(5)D的离子可以形成多种配合物,由Dn+、Br-、C的最高价含氧酸根和A的简单氢化物形成的1:1:1:5的某配合物,向该配合物的溶液中滴加AgNO3溶液产生淡黄色沉淀,滴加BaCl2溶液无现象,则该配合物的化学式为________ ;n值为________ ;Dn+的基态电子排布式为________ ;
(1)D、E所在周期原子最外层电子数为1的元素有
(2)A、B、C第一电离能由大到小的顺序为
(3)B与C形成的二元化合物中,属于非极性分子的是
(4)E和F形成的一种化合物的晶体结构如图所示,则该化合物的化学式为

(5)D的离子可以形成多种配合物,由Dn+、Br-、C的最高价含氧酸根和A的简单氢化物形成的1:1:1:5的某配合物,向该配合物的溶液中滴加AgNO3溶液产生淡黄色沉淀,滴加BaCl2溶液无现象,则该配合物的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】前四周期五种元素A、B、C、D、E的原子序数依次增大。基态B原子s能级上的电子总数为其p能级电子总数的2倍,基态C原子的价层电子排布式为 ,基态D原子中s、p能级上电子总数相等。
,基态D原子中s、p能级上电子总数相等。 的d能级达到全充满结构且4s轨道上没有电子。A和C能组成两种液态化合物(常温常压)。回答下列问题:
的d能级达到全充满结构且4s轨道上没有电子。A和C能组成两种液态化合物(常温常压)。回答下列问题:
(1)D的名称是___________ ,基态E原子最外层的能层符号为___________ 。
(2)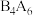 分子中4个B原子共直线,则B的杂化类型是
分子中4个B原子共直线,则B的杂化类型是___________ 。
(3)BC分子能与Fe、Ni等金属形成配合物,其中B提供孤电子对,而不是C提供孤电子对,可能的原因是___________ 。
(4)DC的熔点___________ (填“高于”或“低于”)
 ,其原因是
,其原因是___________ 。
(5)上述五种元素中,电负性最大的是___________ (填元素符号)。
(6)B的一种单质的晶胞如图所示。已知:晶体密度为
 ,设
,设
 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。

①1个晶胞含___________ 个B原子。
②晶胞中a与b原子之间的距离为___________ nm。
 ,基态D原子中s、p能级上电子总数相等。
,基态D原子中s、p能级上电子总数相等。 的d能级达到全充满结构且4s轨道上没有电子。A和C能组成两种液态化合物(常温常压)。回答下列问题:
的d能级达到全充满结构且4s轨道上没有电子。A和C能组成两种液态化合物(常温常压)。回答下列问题:(1)D的名称是
(2)
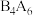 分子中4个B原子共直线,则B的杂化类型是
分子中4个B原子共直线,则B的杂化类型是(3)BC分子能与Fe、Ni等金属形成配合物,其中B提供孤电子对,而不是C提供孤电子对,可能的原因是
(4)DC的熔点
 ,其原因是
,其原因是(5)上述五种元素中,电负性最大的是
(6)B的一种单质的晶胞如图所示。已知:晶体密度为
 ,设
,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
①1个晶胞含
②晶胞中a与b原子之间的距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
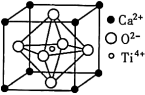
【推荐3】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态Ti原子的价电子排布式为__ ,能量最高的能级有__ 个空轨道;Si、P、S第一电离能由小到大顺序是__ 。
(2)碳和硅的有关化学键键能如表所示:
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___ 。
(3)一种新型熔融盐燃料电池以Li2CO3和Na2CO3的熔融盐混合物作电解质,则CO32-的空间构型为___ 。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:
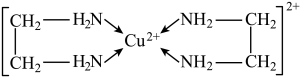
该配离子中含有的化学键类型有__ (填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
一个乙二胺分子中共有__ 个σ键,C原子的杂化方式为__ 。
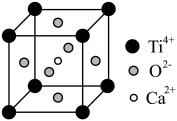
(5)CaTiO3的晶胞为立方晶胞,结构如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角)Ca2+的配位数为__ ,与Ti4+距离最近且相等的O2-有__ 个;晶体的密度为ρg/cm3,最近的Ti4+和O2-之间的距离为__ nm(填计算式)。(CaTiO3的摩尔质量为136g/mol,NA为阿伏加 德罗常数)。
(1)基态Ti原子的价电子排布式为
(2)碳和硅的有关化学键键能如表所示:
| 化学键 | C−C | C−H | C−O | Si−Si | Si−H | Si−O |
| 键能/kJ▪mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是
(3)一种新型熔融盐燃料电池以Li2CO3和Na2CO3的熔融盐混合物作电解质,则CO32-的空间构型为
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:

该配离子中含有的化学键类型有
a.配位键 b.极性键 c.离子键 d.非极性键
一个乙二胺分子中共有
(5)CaTiO3的晶胞为立方晶胞,结构如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角)Ca2+的配位数为

您最近一年使用:0次



