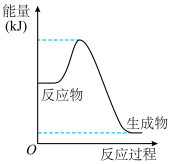
某科研团队在体积固定的密闭容器中将 和
和 催化重整制备合成气,其反应历程示意图如下:
催化重整制备合成气,其反应历程示意图如下:
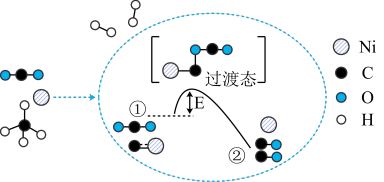
回答下列问题:
(1)制备合成气的化学方程式为___________ , 中含有
中含有___________ 键(填“极性”或“非极性”)。
(2)历程①→②是___________ (填“释放”或“吸收”)能量的过程,Ni起___________ 作用。
(3)按 充入
充入 和
和 ,并维持温度和容积不变,下列不能说明制备合成气的反应达到化学平衡状态的是___________。
,并维持温度和容积不变,下列不能说明制备合成气的反应达到化学平衡状态的是___________。
(4)在体积为 的密闭容器中加入
的密闭容器中加入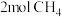 、
、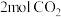 以及催化剂进行重整反应,
以及催化剂进行重整反应, 的平衡转化率
的平衡转化率 与温度(T)、压强(P)的关系如图所示。
与温度(T)、压强(P)的关系如图所示。

①为了加快反应速率,可采取的措施为___________ 。
②当温度为 、压强为
、压强为 时,a点的
时,a点的
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③在温度为 、压强为
、压强为 时,
时, 时达到平衡,用
时达到平衡,用 表示该反应的反应速率为
表示该反应的反应速率为___________  。保持温度和体积不变,若起始时提高投料比
。保持温度和体积不变,若起始时提高投料比 ,则起始速率
,则起始速率___________ (填“加快”“减慢”或“无法判断”)。
 和
和 催化重整制备合成气,其反应历程示意图如下:
催化重整制备合成气,其反应历程示意图如下:
回答下列问题:
(1)制备合成气的化学方程式为
 中含有
中含有(2)历程①→②是
(3)按
 充入
充入 和
和 ,并维持温度和容积不变,下列不能说明制备合成气的反应达到化学平衡状态的是___________。
,并维持温度和容积不变,下列不能说明制备合成气的反应达到化学平衡状态的是___________。| A.混合气体的总压强不再变化 | B. |
C. 与 与 浓度比值不再变化 浓度比值不再变化 | D. 的体积分数不再变化 的体积分数不再变化 |
 的密闭容器中加入
的密闭容器中加入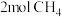 、
、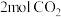 以及催化剂进行重整反应,
以及催化剂进行重整反应, 的平衡转化率
的平衡转化率 与温度(T)、压强(P)的关系如图所示。
与温度(T)、压强(P)的关系如图所示。
①为了加快反应速率,可采取的措施为
②当温度为
 、压强为
、压强为 时,a点的
时,a点的
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③在温度为
 、压强为
、压强为 时,
时, 时达到平衡,用
时达到平衡,用 表示该反应的反应速率为
表示该反应的反应速率为 。保持温度和体积不变,若起始时提高投料比
。保持温度和体积不变,若起始时提高投料比 ,则起始速率
,则起始速率
更新时间:2023-08-02 07:43:21
|
相似题推荐
【推荐1】I.回答下列问题
(1)下列变化中满足图示的是___________(填字母)。
(2)下图是在 101kPa、298K条件下,1mol NO₂气体和1mol CO反应生成 和 1mol NO 气体的能量变化的示意图。该反应的热化学方程式为
和 1mol NO 气体的能量变化的示意图。该反应的热化学方程式为___________ 。
(3)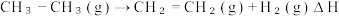 有关化学键的键能如上表所示。则该反应的反应热为ΔH=
有关化学键的键能如上表所示。则该反应的反应热为ΔH=___________ 。
Ⅱ. 近年来,我国化工技术获得重大突破,利用合成气(主要成分为 CO、CO₂和)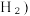 在催化剂的作用下合成甲醇(CH₃OH)是其中的一个研究项目。该研究发生的主要反应如下:
在催化剂的作用下合成甲醇(CH₃OH)是其中的一个研究项目。该研究发生的主要反应如下:
i. CO与H₂反应合成甲醇: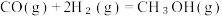
i i.CO₂与H₂反应合成甲醇:
(4)上述反应符合原子经济性的是反应___________ (i或ii)。
(5)在某一时刻采取下列措施,能使反应 i 的反应速率减小的措施是___________。
(6)一定温度下,在容积固定的密闭容器中发生反应ii,下列说法可以表明反应达到化学平衡状态的是___________。
(7)H₂还原 CO电化学法制备甲醇( 的工作原理如图所示:
的工作原理如图所示:___________ 极(填“正”或“负”),电池工作过程中  通过质子膜向
通过质子膜向___________ (填“左”或者“右”)移动,通入CO的一端发生的电极反应式为___________ 。
(1)下列变化中满足图示的是___________(填字母)。
| A.镁和稀盐酸的反应 |
B.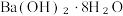 与NH₄Cl的反应 与NH₄Cl的反应 |
| C.NaOH 固体加入水中 |
| D.乙醇燃烧 |
(2)下图是在 101kPa、298K条件下,1mol NO₂气体和1mol CO反应生成
 和 1mol NO 气体的能量变化的示意图。该反应的热化学方程式为
和 1mol NO 气体的能量变化的示意图。该反应的热化学方程式为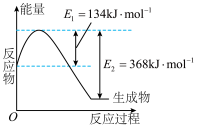
| 化学键 | C——H | C=C | C—C | H—H |
| 键能/(kJ·mol⁻¹) | 414 | 615 | 347.7 | 436.4 |
(3)
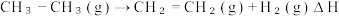 有关化学键的键能如上表所示。则该反应的反应热为ΔH=
有关化学键的键能如上表所示。则该反应的反应热为ΔH=Ⅱ. 近年来,我国化工技术获得重大突破,利用合成气(主要成分为 CO、CO₂和)
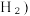 在催化剂的作用下合成甲醇(CH₃OH)是其中的一个研究项目。该研究发生的主要反应如下:
在催化剂的作用下合成甲醇(CH₃OH)是其中的一个研究项目。该研究发生的主要反应如下:i. CO与H₂反应合成甲醇:
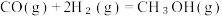
i i.CO₂与H₂反应合成甲醇:

(4)上述反应符合原子经济性的是反应
(5)在某一时刻采取下列措施,能使反应 i 的反应速率减小的措施是___________。
| A.恒温恒容下,再充入CO | B.升高温度 |
| C.恒温恒容下,向其中充入Ar | D.恒温恒压下,向其中充入 Ar |
(6)一定温度下,在容积固定的密闭容器中发生反应ii,下列说法可以表明反应达到化学平衡状态的是___________。
| A.单位时间内消耗 3molH₂, 同时生成1mol的 CH₃OH |
| B.CH₃OH 的体积分数不再发生变化 |
C.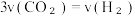 |
| D.容器内气体密度不再改变 |
(7)H₂还原 CO电化学法制备甲醇(
 的工作原理如图所示:
的工作原理如图所示: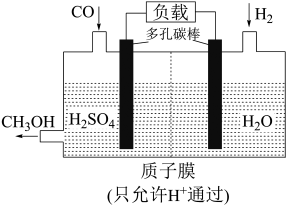
 通过质子膜向
通过质子膜向
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】I.在2L密闭容器内,800℃时反应2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)下图中表示NO2的变化的曲线是_______ (填字母)。

(2)800℃,反应达到平衡时,NO的转化率是_______ 。
(3)用O2表示从0~2s内该反应的平均速率v=_______ 。
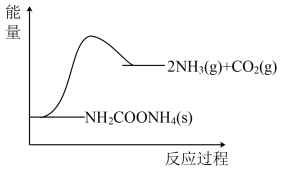
Ⅱ.将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g)
(1)下图所示,反应中断开反应物化学键吸收的能量_______ (填写“大于”“等于”“小于”)形成生成物中化学键放出的能量。
(2)能使该反应的速率增大的是_______ 。
A.及时分离出CO2气体 B.适当升高温度
C.加入少量NH2COONH4(s) D.选择高效催化剂
(3)下列不能判断该分解反应已经达到化学平衡状态的是_______ (填序号)。
①v正(NH3)=2v逆(CO2)
②密闭容器中NH3的物质的量不变
③容器中NH3与CO2的物质的量之比保持不变
④密闭容器中气体总压强保持不变
⑤CO2(g)的体积分数保持不变
⑥形成6个N—H的同时有2个C=O断裂
⑦气体的平均相对分子质量保持不变
⑧混合气体的密度保持不变
| 时间/s | 0 | 1 | 2 | 3 | 5 | 6 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图中表示NO2的变化的曲线是

(2)800℃,反应达到平衡时,NO的转化率是
(3)用O2表示从0~2s内该反应的平均速率v=
Ⅱ.将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g)
(1)下图所示,反应中断开反应物化学键吸收的能量

(2)能使该反应的速率增大的是
A.及时分离出CO2气体 B.适当升高温度
C.加入少量NH2COONH4(s) D.选择高效催化剂
(3)下列不能判断该分解反应已经达到化学平衡状态的是
①v正(NH3)=2v逆(CO2)
②密闭容器中NH3的物质的量不变
③容器中NH3与CO2的物质的量之比保持不变
④密闭容器中气体总压强保持不变
⑤CO2(g)的体积分数保持不变
⑥形成6个N—H的同时有2个C=O断裂
⑦气体的平均相对分子质量保持不变
⑧混合气体的密度保持不变
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】I.如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
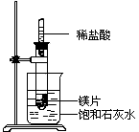
(1)实验中观察到的现象是___________ 。
(2)写出有关反应的离子方程式___________ 。
(3)由实验推知,MgCl2溶液和H2的总能量___________ (填“大于”、“小于”、“等于”)镁片和盐酸的总能量。
II.(1)若将上述反应设计成原电池,用用稀盐酸作电解质溶液,铜为原电池的某一电极材料,则铜为原电池的___________ (填“正”或“负”,下同)极。铜片的现象为___________ ,电解质溶液中H+向___________ 极移动。
(2)将铁棒和锌片连接后浸入CuCl2溶液里,当电池中有0.2 mol电子通过时,正极电极反应式:___________ ,负极质量的变化是___________ (填“增加”或“减少”)___________ g
(3)氢氧燃料电池是常见的燃料电池,在电解质溶液是KOH溶液的负极反应为___________ 。

(1)实验中观察到的现象是
(2)写出有关反应的离子方程式
(3)由实验推知,MgCl2溶液和H2的总能量
II.(1)若将上述反应设计成原电池,用用稀盐酸作电解质溶液,铜为原电池的某一电极材料,则铜为原电池的
(2)将铁棒和锌片连接后浸入CuCl2溶液里,当电池中有0.2 mol电子通过时,正极电极反应式:
(3)氢氧燃料电池是常见的燃料电池,在电解质溶液是KOH溶液的负极反应为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】I.氢能源是绿色燃料,可以减少环境污染,利用甲醇与水蒸气反应可以制备氢气。
(1)已知下列热化学方程式:
①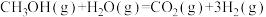

②

③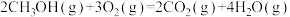

 、
、 、
、 三者的关系式为
三者的关系式为___________
(2)在一定温度下,向 密闭恒容容器中充入
密闭恒容容器中充入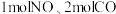 ,发生反应
,发生反应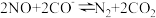 ,10s时反应达平衡,此时
,10s时反应达平衡,此时 的物质的量为1.2mol。则前10s内平均反应速率
的物质的量为1.2mol。则前10s内平均反应速率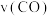 为
为___________ 。
II.甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇: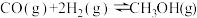
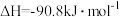
在一容积可变的密闭容器中充人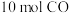 和
和 的平衡转化率随温度(T)、压强(p)的变化如图所示。
的平衡转化率随温度(T)、压强(p)的变化如图所示。
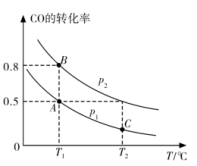
(3)该反应的化学平衡常数表达式K=___________ 。
(4)图中A、B两点的正反应速率: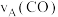
___________  ,A、C两点的平衡常数:
,A、C两点的平衡常数:
___________  (填“>”“<”或“=”)
(填“>”“<”或“=”)
(5)关于反应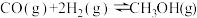 ,下列不能作为反应达到化学平衡的标志是
,下列不能作为反应达到化学平衡的标志是___________ (填字母)。
A. 的含量保持不变
的含量保持不变
B.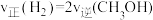
C.容器中 的浓度与
的浓度与 的浓度一定相等
的浓度一定相等
D.容器中混合气体的密度保持不变
(1)已知下列热化学方程式:
①
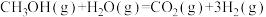

②


③
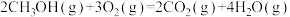

 、
、 、
、 三者的关系式为
三者的关系式为(2)在一定温度下,向
 密闭恒容容器中充入
密闭恒容容器中充入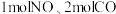 ,发生反应
,发生反应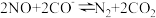 ,10s时反应达平衡,此时
,10s时反应达平衡,此时 的物质的量为1.2mol。则前10s内平均反应速率
的物质的量为1.2mol。则前10s内平均反应速率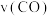 为
为II.甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:
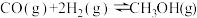
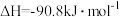
在一容积可变的密闭容器中充人
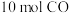 和
和 的平衡转化率随温度(T)、压强(p)的变化如图所示。
的平衡转化率随温度(T)、压强(p)的变化如图所示。
(3)该反应的化学平衡常数表达式K=
(4)图中A、B两点的正反应速率:
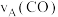
 ,A、C两点的平衡常数:
,A、C两点的平衡常数:
 (填“>”“<”或“=”)
(填“>”“<”或“=”)(5)关于反应
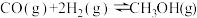 ,下列不能作为反应达到化学平衡的标志是
,下列不能作为反应达到化学平衡的标志是A.
 的含量保持不变
的含量保持不变B.
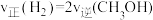
C.容器中
 的浓度与
的浓度与 的浓度一定相等
的浓度一定相等D.容器中混合气体的密度保持不变
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】随着人们的物质生活水平的不断提高和工业化快速发展,环境污染也日益加重,空气中有毒气体主要包括 SO2、CO、NOx、烃类等等。
(1)在一定条件下,CH4可与 NOx反应除去 NOx,已知有下列热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(1) ΔH =-890.3kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH =+67.0kJ/mol
H2O(1)=H2O(g) ΔH =+41.0kJ/mol
CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) ΔH =__________ kJ/mol
(2)在 2 L 的密闭容器中按物质的量之比 1∶2 充入 CO 和 H2,发生反应CO(g)+2H2(g) CH3OH(g) ΔH。测得 CO 的平衡转化率随温度及不同压强的变化如图所示,P2和 195 ℃时 n(H2)随时间的变化结果如表所示。
CH3OH(g) ΔH。测得 CO 的平衡转化率随温度及不同压强的变化如图所示,P2和 195 ℃时 n(H2)随时间的变化结果如表所示。
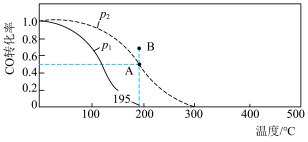
P2及195℃时n(H2)随时间变化
①该反应的ΔH___________ 0(填“>”、“<”或“=”),原因是___________ 。
②在 P2及 195 ℃时,在 0~2 min,平均反应速率 v(CH3OH)=___________ 。
③能说明该反应已达到平衡状态的是___________ 。
a.容器内混合气体压强保持不再变化 b.CO 和 H2的转化率之比不再变化
c.容器内混合气体的平均摩尔质量不再变化 d.容器内混合气体的密度不再变化
④P2及 195℃下,在 B 点时,v(正)___________ v(逆)(填“>”、“<”或“=”)。
⑤下列说法不正确的是___________ 。
a.将容器体积变为 1L,再次达平衡时,CO 的物质的量浓度为原平衡的 2 倍
b.该反应在任何条件下都能自发进行
c.充分反应后,容器内只存在 CH3OH 分子
d.升高温度,n(CH3OH)/n(CO)减小
⑥在 P2及 195 ℃时,该反应的平衡常数 Kp=___________ (用平衡分压代替平衡浓度计算, 分压=总压×物质的量分数,结果用含 P2的分式表示)。
(1)在一定条件下,CH4可与 NOx反应除去 NOx,已知有下列热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(1) ΔH =-890.3kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH =+67.0kJ/mol
H2O(1)=H2O(g) ΔH =+41.0kJ/mol
CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) ΔH =
(2)在 2 L 的密闭容器中按物质的量之比 1∶2 充入 CO 和 H2,发生反应CO(g)+2H2(g)
 CH3OH(g) ΔH。测得 CO 的平衡转化率随温度及不同压强的变化如图所示,P2和 195 ℃时 n(H2)随时间的变化结果如表所示。
CH3OH(g) ΔH。测得 CO 的平衡转化率随温度及不同压强的变化如图所示,P2和 195 ℃时 n(H2)随时间的变化结果如表所示。
P2及195℃时n(H2)随时间变化
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2) | 8 | 6 | 5 | 4 | 4 |
②在 P2及 195 ℃时,在 0~2 min,平均反应速率 v(CH3OH)=
③能说明该反应已达到平衡状态的是
a.容器内混合气体压强保持不再变化 b.CO 和 H2的转化率之比不再变化
c.容器内混合气体的平均摩尔质量不再变化 d.容器内混合气体的密度不再变化
④P2及 195℃下,在 B 点时,v(正)
⑤下列说法不正确的是
a.将容器体积变为 1L,再次达平衡时,CO 的物质的量浓度为原平衡的 2 倍
b.该反应在任何条件下都能自发进行
c.充分反应后,容器内只存在 CH3OH 分子
d.升高温度,n(CH3OH)/n(CO)减小
⑥在 P2及 195 ℃时,该反应的平衡常数 Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2相互转化的热化学方程式为N2O4(g)⇌2NO2(g) ΔH=+24.4 kJ/mol。
(1)将一定量N2O4投入固定容积的真空容器中,下列现象能说明反应达到平衡的是_______ (填字母)。
a.v正(N2O4)=2v逆(NO2)
b.体系颜色不变
c.气体平均相对分子质量不变
d.气体密度不变
(2)达到平衡后,保持体积不变,升高温度,再次达到平衡时,混合气体颜色_______ (填“变深”“变浅”或“不变”),判断理由是_______ 。
(3)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数表达式:Kp=_______ (用p总、各气体物质的量分数x表示);影响Kp的因素为_______ 。
(4)真空密闭容器中充入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4的分解百分率为α。保持温度不变,向密闭容器中充入等量的N2O4,维持总压强在2p0条件下分解,则平衡时N2O4的分解百分率为_______ (用α表示)。
(1)将一定量N2O4投入固定容积的真空容器中,下列现象能说明反应达到平衡的是
a.v正(N2O4)=2v逆(NO2)
b.体系颜色不变
c.气体平均相对分子质量不变
d.气体密度不变
(2)达到平衡后,保持体积不变,升高温度,再次达到平衡时,混合气体颜色
(3)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数表达式:Kp=
(4)真空密闭容器中充入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4的分解百分率为α。保持温度不变,向密闭容器中充入等量的N2O4,维持总压强在2p0条件下分解,则平衡时N2O4的分解百分率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:
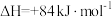 ,
,

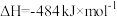 。
。
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:______ 。
(2)在一容积不变为2 L的密闭容器内,充入0.2 mol CO与0.4molH2发生反应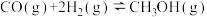 。CO的平衡转化率与温度,压强的关系如图所示。
。CO的平衡转化率与温度,压强的关系如图所示。

①A,B两点对应的压强大小关系是PA______ PB (填“>,<,=”)。
②A、B、C三点的平衡常数KA,KB、KC的大小关系是______ 。
③下列叙述能说明上述反应能达到化学平衡状态的是______ (填代号)。
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.气体的平均相对分子质量和压强不再改变
④在P1压强、T1℃时,该反应的平衡常数K=______ (填计算结果),再加入1.0 mol CO后重新达到新平衡,则CO的转化率______ (填“增大”、“不变”或“减小”)。
⑤T1°C、1 L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1 mol,H2:0.2 mol,CH3OH:0.2 mol。此时
______  (填>、<或=)。
(填>、<或=)。
(1)已知:

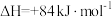 ,
, 
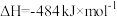 。
。工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:
(2)在一容积不变为2 L的密闭容器内,充入0.2 mol CO与0.4molH2发生反应
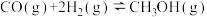 。CO的平衡转化率与温度,压强的关系如图所示。
。CO的平衡转化率与温度,压强的关系如图所示。
①A,B两点对应的压强大小关系是PA
②A、B、C三点的平衡常数KA,KB、KC的大小关系是
③下列叙述能说明上述反应能达到化学平衡状态的是
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.气体的平均相对分子质量和压强不再改变
④在P1压强、T1℃时,该反应的平衡常数K=
⑤T1°C、1 L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1 mol,H2:0.2 mol,CH3OH:0.2 mol。此时

 (填>、<或=)。
(填>、<或=)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】工业硅是我国有色金属行业的重要组成部分,其细分产品主要分为单晶硅、多晶硅、有机硅和合金硅,其下游应用已经渗透到国防军工、信息产业、新能源等相关行业中,在我国经济社会发展中具有特殊的地位,是新能源、新材料产业发展不可或缺的重要材料,展现了广阔的应用前景。
(1)已知反应a:2C(s)+O2(g)=2CO(g) △H1=-221.0kJ•mol-1
反应b:Si(s)+O2(g)=SiO2(s) △H2=-911.0kJ•mol-1
①写出工业上用过量碳与SiO2(s)制备粗硅的热化学方程式:___ ,在___ (填“高温”或“低温”)下利于该反应进行。
②粗硅中主要含有Si、焦炭、SiO2,工业上可以通过如图所示流程制取纯硅:
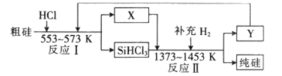
反应II的化学方程式为___ 。
(2)硅烧法制备多晶硅的核心反应是SiHCl3的歧化:2SiHCl3(g) SiH2Cl2(g)+SiCl4(g) △H=QkJ•mol-1,在323K和343K时SiHCl3的转化率随时间变化的关系如图所示。
SiH2Cl2(g)+SiCl4(g) △H=QkJ•mol-1,在323K和343K时SiHCl3的转化率随时间变化的关系如图所示。
已知:

①该反应的△H___ (填“>”或“<”)0。
②反应速率v正=k正•x2SiHCl3,v逆=k逆•xSiH2Cl2•xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,M点的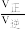 =
=___ (填数值)。
③400K下,向一容积为2L的恒容容器中通入0.3molSiH2Cl2和0.3molSiCl4发生反应,达到平衡时SiHCl3的浓度为___ mol•L-1。
(3)冷氢化技术是国内多晶硅技术开发的核心。在催化剂作用下,将SiCl4氢化为SiHCl3:起始反应物投料相同,不同温度下在某恒容密闭容器中,发生反应3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) △H<0,反应相同时间后测得SiCl4的转化率与温度的关系如图所示。
4SiHCl3(g) △H<0,反应相同时间后测得SiCl4的转化率与温度的关系如图所示。

①图中已达到平衡的点是___ 。
②B点的v逆___ (填“大于”、“小于”或“等于”)D点的v正。
(1)已知反应a:2C(s)+O2(g)=2CO(g) △H1=-221.0kJ•mol-1
反应b:Si(s)+O2(g)=SiO2(s) △H2=-911.0kJ•mol-1
①写出工业上用过量碳与SiO2(s)制备粗硅的热化学方程式:
②粗硅中主要含有Si、焦炭、SiO2,工业上可以通过如图所示流程制取纯硅:

反应II的化学方程式为
(2)硅烧法制备多晶硅的核心反应是SiHCl3的歧化:2SiHCl3(g)
 SiH2Cl2(g)+SiCl4(g) △H=QkJ•mol-1,在323K和343K时SiHCl3的转化率随时间变化的关系如图所示。
SiH2Cl2(g)+SiCl4(g) △H=QkJ•mol-1,在323K和343K时SiHCl3的转化率随时间变化的关系如图所示。已知:
| 温度/K | 323 | 343 | 400 |
| 平衡常数 | 0.01 | 0.02 | 1 |

①该反应的△H
②反应速率v正=k正•x2SiHCl3,v逆=k逆•xSiH2Cl2•xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,M点的
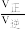 =
=③400K下,向一容积为2L的恒容容器中通入0.3molSiH2Cl2和0.3molSiCl4发生反应,达到平衡时SiHCl3的浓度为
(3)冷氢化技术是国内多晶硅技术开发的核心。在催化剂作用下,将SiCl4氢化为SiHCl3:起始反应物投料相同,不同温度下在某恒容密闭容器中,发生反应3SiCl4(g)+2H2(g)+Si(s)
 4SiHCl3(g) △H<0,反应相同时间后测得SiCl4的转化率与温度的关系如图所示。
4SiHCl3(g) △H<0,反应相同时间后测得SiCl4的转化率与温度的关系如图所示。
①图中已达到平衡的点是
②B点的v逆
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】气体之间的反应有其独特的优点,对其研究具有重要意义。
(1)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g) CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。
CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。
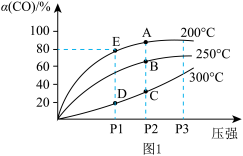
在B点条件下,下列叙述能说明上述反应能达到化学平衡状态的是__ 。
A.H2的消耗速率是CH3OH生成速率的2倍
B. CH3OH的体积分数不再改变
C.混合气体的密度不再改变
D.CO和CH3OH的物质的量之比保持不变
(2)CO(g)+2H2(g) CH3OH(g)在
CH3OH(g)在__ (填“低温”、“高温”或“任意温度”)下能自发进行。
(3)化学平衡常数K(B)、K(C)、K(D)的大小关系是:_ 。
(4)计算图中A点的平衡常数Kp=__ 。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;用P1或P2或P3表示)。
(5)已知NH3(g)+NOx(g)+O2(g) N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。
N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。
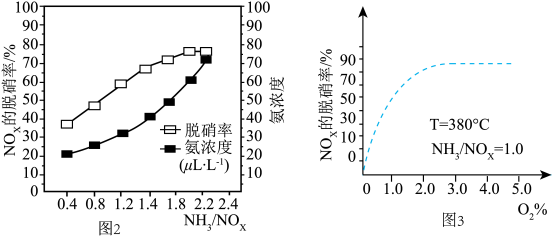 ①图2中,最佳氨氮比为2.0,理由是
①图2中,最佳氨氮比为2.0,理由是__ 。
②请在图3中,用实线画出不使用催化剂情况下(其他条件完全相同)的图示__ 。
(1)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)
 CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。
CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。
在B点条件下,下列叙述能说明上述反应能达到化学平衡状态的是
A.H2的消耗速率是CH3OH生成速率的2倍
B. CH3OH的体积分数不再改变
C.混合气体的密度不再改变
D.CO和CH3OH的物质的量之比保持不变
(2)CO(g)+2H2(g)
 CH3OH(g)在
CH3OH(g)在(3)化学平衡常数K(B)、K(C)、K(D)的大小关系是:
(4)计算图中A点的平衡常数Kp=
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;用P1或P2或P3表示)。
(5)已知NH3(g)+NOx(g)+O2(g)
 N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。
N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。 ①图2中,最佳氨氮比为2.0,理由是
①图2中,最佳氨氮比为2.0,理由是②请在图3中,用实线画出不使用催化剂情况下(其他条件完全相同)的图示
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】根据下表中的①~⑧种元素在周期表中的位置,回答下列问题。
(1)元素③、④形成的简单的离子,半径由大到小是___________ (填离子符号)。
(2)用电子式表示元素⑥和⑦的化合物的形成过程___________ 。
(3)元素②的一种核素可以用来考古,该核素的中子数是___________ ,该元素形成的一种化合物是形成温室效应的主要气体,请写出该化合物的结构式___________ 。
(4)元素④的简单氢化物的化学式是___________ ,由___________ (填“极性”或“非极性”)键形成的。
族 周期 | ⅠA | 0族 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ |
(2)用电子式表示元素⑥和⑦的化合物的形成过程
(3)元素②的一种核素可以用来考古,该核素的中子数是
(4)元素④的简单氢化物的化学式是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)氮与元素周期表同周期的相邻元素的第一电离能由小到大的顺序为_____________
(2)与阴离子(CN-)互为等电子体的两种分子有______________ 、____________________
(3)氨水溶液中存在多种氢键,任表示出其中两种_________________ 、_________________ .
(4)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13。硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因是______________
②硝酸比亚硝酸酸性强的原因是______________

(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的核外电子排布式为_________________ 与同一个N3-相连的X+有_____ 个。
(6)X的高价阳离子(X2+)在水溶液中存在离子[X(H2O)4]2+,则X2+与H2O之间的键型为________________ 该化学键能形成的原因是___________________ 请画出[X(H2O)4]2+离子的结构式(用元素符号写结构式)__________________ 。
(1)氮与元素周期表同周期的相邻元素的第一电离能由小到大的顺序为
(2)与阴离子(CN-)互为等电子体的两种分子有
(3)氨水溶液中存在多种氢键,任表示出其中两种
(4)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13。硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因是
②硝酸比亚硝酸酸性强的原因是

(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的核外电子排布式为
(6)X的高价阳离子(X2+)在水溶液中存在离子[X(H2O)4]2+,则X2+与H2O之间的键型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】已知A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次增大。B、C、D同周期,A、D同主族,B,C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。E元素的原子核外共有20种不同运动状态的电子,且E的原子序数比D大4。
(1)B、C的第一电离能较大的是______ (填元素符号)。
(2)A的氢化物的分子空间构型为______ ,其中心原子采取______ 杂化。
(3)A和D的氢化物中,沸点较高的是______ (填化学式),其原因是______ 。
(4)仅由A与B元素组成,且含有非极性键的化合物是______ (填化学式)。
(5)E的核外电子排布式是______ 。
(6)B的最高价氧化物对应的水化物,其溶液与C单质反应的化学方程式是______ 。
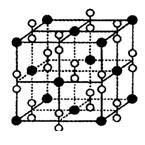
(7)E单质在A单质中燃烧时得到一种白色晶体,其晶体的晶胞结构如图所示,则该晶体的化学式为______ 。
(1)B、C的第一电离能较大的是
(2)A的氢化物的分子空间构型为
(3)A和D的氢化物中,沸点较高的是
(4)仅由A与B元素组成,且含有非极性键的化合物是
(5)E的核外电子排布式是
(6)B的最高价氧化物对应的水化物,其溶液与C单质反应的化学方程式是
(7)E单质在A单质中燃烧时得到一种白色晶体,其晶体的晶胞结构如图所示,则该晶体的化学式为

您最近一年使用:0次



