检验甲醛含量的方法有很多,其中银-Ferrozine法灵敏度较高。测定原理为甲醛与银氨溶液反应生成Ag,产生的Ag与Fe3+定量反应生成Fe2+,Fe2+与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组类比此原理设计如图装置,测定新装修居室内空气中甲醛的含量(夹持装置略去)。根据国家GB/T18883-2002《室内空气质量标准》,室内甲醛的达标标准为:在密闭门窗时间不少于12小时以后,测得甲醛含量不超过0.1mg/m³。
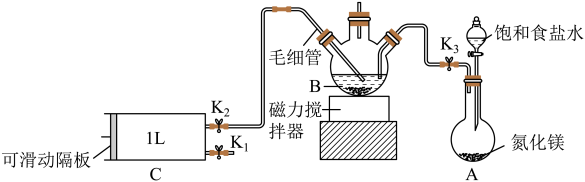
已知:①B装置中间导管所连接的尾气处理装置在图中已省略;
②毛细管内径不超过1mm。
回答下列问题:
(1)下列哪些制备气体的装置与A装置不同
________ 。
a.Cu和浓硫酸制SO2 b.CaCO3和稀盐酸制CO2 c.实验室制乙炔
用饱和食盐水代替水制备NH3的原因是________ 。
(2)银氨溶液的制备。
关闭K1、K2,打开K3。先打开________ ,再打开分液漏斗的下方活塞,使饱和食盐水慢慢滴入圆底烧瓶中,将产生的气体通入已加入适量硝酸银溶液的B中,当观察到B中________ ,关闭K3和分液漏斗旋塞,停止通入NH3。
(3)室内空气中甲醛含量的测定。
①用热水浴加热B,打开K1,将滑动隔板慢慢由最右端抽到最左端,吸入1L室内空气(在密闭门窗时间超过12小时以后),关闭K1;打开K2,向右缓慢推动滑动隔板,将气体全部排出,再关闭K2;重复上述操作4次。上述过程,空气中甲醛与B中银氨溶液反应的化学方程式为________ 。对比普通玻璃导管,使用毛细管的优点是________ 。
②待装置B中溶液充分反应后,向其中加入适量稀硫酸调节溶液pH=1,再加入足量Fe2(SO4)3溶液,充分反应后立即加入菲洛嗪,Fe2+与菲洛嗪形成有色物质,在562nm处测定吸光度,测得生成1.12mg Fe2+,则该室内空气中甲醛的含量为_________ mg•L-1。

已知:①B装置中间导管所连接的尾气处理装置在图中已省略;
②毛细管内径不超过1mm。
回答下列问题:
(1)下列哪些制备气体的装置与A装置不同
a.Cu和浓硫酸制SO2 b.CaCO3和稀盐酸制CO2 c.实验室制乙炔
用饱和食盐水代替水制备NH3的原因是
(2)银氨溶液的制备。
关闭K1、K2,打开K3。先打开
(3)室内空气中甲醛含量的测定。
①用热水浴加热B,打开K1,将滑动隔板慢慢由最右端抽到最左端,吸入1L室内空气(在密闭门窗时间超过12小时以后),关闭K1;打开K2,向右缓慢推动滑动隔板,将气体全部排出,再关闭K2;重复上述操作4次。上述过程,空气中甲醛与B中银氨溶液反应的化学方程式为
②待装置B中溶液充分反应后,向其中加入适量稀硫酸调节溶液pH=1,再加入足量Fe2(SO4)3溶液,充分反应后立即加入菲洛嗪,Fe2+与菲洛嗪形成有色物质,在562nm处测定吸光度,测得生成1.12mg Fe2+,则该室内空气中甲醛的含量为
更新时间:2023-10-30 14:35:07
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】Ⅰ.某溶液中可能含有Na+、Ca2+、NO 、CO
、CO 、SO
、SO 、Cl-等离子。为了鉴别这些离子,分别取少量溶液进行如下实验:
、Cl-等离子。为了鉴别这些离子,分别取少量溶液进行如下实验:
①加入稀盐酸后,生成无色无味的气体,将气体通入澄清石灰水,变浑浊。
②加入足量的BaCl2溶液,产生白色沉淀,过滤,在沉淀中加入足量的盐酸,沉淀不能完全溶解。
③取②中滤液,加入硝酸酸化后,再加入过量的AgNO3溶液,析出白色沉淀。
(1)由实验可知一定存在的离子是_______ ,一定不存在的离子是_______ ,可能存在的离子是_______ 。
Ⅱ.炼金废水中含有配离子[Au(CN)2]+,其电离出的CN-有毒,在酸性水溶液中,CN-与H+结合生成易挥发的HCN,其毒性更强。回答下列问题:
(2)HCN的电离方程式为_______ 。
(3)HCN的结构式为(所有元素均达8电子或2电子稳定结构)_______ 。
(4)处理炼金废水常在碱性条件下,用NaClO将CN-氧化为CO 和N2,其反应的离子方程式为
和N2,其反应的离子方程式为_______ 。
(5)实际处理该废水时不在酸性条件下进行的主要原因是_______ 。
 、CO
、CO 、SO
、SO 、Cl-等离子。为了鉴别这些离子,分别取少量溶液进行如下实验:
、Cl-等离子。为了鉴别这些离子,分别取少量溶液进行如下实验:①加入稀盐酸后,生成无色无味的气体,将气体通入澄清石灰水,变浑浊。
②加入足量的BaCl2溶液,产生白色沉淀,过滤,在沉淀中加入足量的盐酸,沉淀不能完全溶解。
③取②中滤液,加入硝酸酸化后,再加入过量的AgNO3溶液,析出白色沉淀。
(1)由实验可知一定存在的离子是
Ⅱ.炼金废水中含有配离子[Au(CN)2]+,其电离出的CN-有毒,在酸性水溶液中,CN-与H+结合生成易挥发的HCN,其毒性更强。回答下列问题:
(2)HCN的电离方程式为
(3)HCN的结构式为(所有元素均达8电子或2电子稳定结构)
(4)处理炼金废水常在碱性条件下,用NaClO将CN-氧化为CO
 和N2,其反应的离子方程式为
和N2,其反应的离子方程式为(5)实际处理该废水时不在酸性条件下进行的主要原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】(山西省晋中市2019届高三1月高考适应性考试理科综合)碲被誉为“现代工业、国防与尖端技术的维生素”,工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属其工艺流程如下:
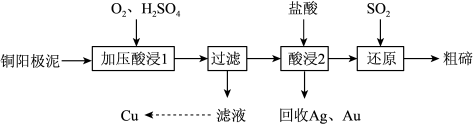
已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是_________ ,其中“加压”的目的是_____ 。写出“加压酸浸1”过程中Cu2Te发生反应的化学方程式__________ 。
(2)“酸浸2”时温度过高会使碲的浸出率降低,原因为_______ 。要从Ag和Au中分离出Au,可以向回收的Ag和Au中加入的试剂是_________ 。
(3)写出“还原”反应中发生的离子方程式__________ 。
(4)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,以石墨为电极电解溶液获得Te。电解过程中阴极的电极反应式为____ 。
(5)25℃时,向1mol/L的Na2TeO3溶液中滴加盐酸,当溶液pH值约为6时,此时溶液中c(TeO32-):c(HTeO3-)=____ (已知:H2TeO3的Ka1=1.0×10-3,Ka2=2.0×10-8)

已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是
(2)“酸浸2”时温度过高会使碲的浸出率降低,原因为
(3)写出“还原”反应中发生的离子方程式
(4)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,以石墨为电极电解溶液获得Te。电解过程中阴极的电极反应式为
(5)25℃时,向1mol/L的Na2TeO3溶液中滴加盐酸,当溶液pH值约为6时,此时溶液中c(TeO32-):c(HTeO3-)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】以钛铁矿(主要成分为FeTiO3、MgO)为原料制备高纯度钛白粉(TiO2)。同时得到绿矾的工艺流程如图。
已知:常温下,稀硫酸几乎与FeTiO3不反应;钛元素在整个流程中化合价没有变化。
(1)稀硫酸浸出的目的是______ 。
(2)下面两图分别为不同固液比、不同浸出温度下滤渣与热浓硫酸反应时的Ti浸出率,据图分析,最适合的固液比和温度分别是______ 和______ ,原因为______ 。

(3)“一系列操作”得到的绿矾先用稀钛液洗涤,再用冰水洗涤,请问先用稀钛液洗涤的目的是______ ,从FeSO4溶液中获得FeSO4•7H2O晶体的实验操作是______ 。
(4)若用浓硫酸浸出后Ti元素的存在形式为TiO2+,将钛液加热煮沸时,发生反应的离子方程式为______ 。
(5)若取10kg钛铁矿(FeTiO3的质量分数为95%),经过上述流程(钛元素在整个流程中损失率为5%),则可制得钛白粉固体(TiO2)的质量为______ kg。

已知:常温下,稀硫酸几乎与FeTiO3不反应;钛元素在整个流程中化合价没有变化。
(1)稀硫酸浸出的目的是
(2)下面两图分别为不同固液比、不同浸出温度下滤渣与热浓硫酸反应时的Ti浸出率,据图分析,最适合的固液比和温度分别是

(3)“一系列操作”得到的绿矾先用稀钛液洗涤,再用冰水洗涤,请问先用稀钛液洗涤的目的是
(4)若用浓硫酸浸出后Ti元素的存在形式为TiO2+,将钛液加热煮沸时,发生反应的离子方程式为
(5)若取10kg钛铁矿(FeTiO3的质量分数为95%),经过上述流程(钛元素在整个流程中损失率为5%),则可制得钛白粉固体(TiO2)的质量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质(夹持装置已略去)。
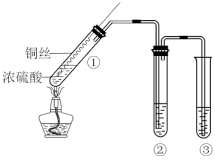
(1)试管①中反应的化学方程式是____ ;浓硫酸表现出了____ 性和____ 性。
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是____ ;若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,则说明生成的气体具有___ 性;若试管②中的试剂为新制氯水则对应的离子方程式为____ 。
(3)试管③中的试剂为NaOH溶液,其作用是___ ,反应的化学方程式是___ 。

(1)试管①中反应的化学方程式是
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是
(3)试管③中的试剂为NaOH溶液,其作用是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】利用元素的化合价推测物质的性质是化学研究的重要手段。硫及其化合物的“价—类”二维图如下:

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有___________ (填化学式)。
(2)将X与Y混合可生成淡黄色固体,该反应中还原剂与氧化剂的物质的量之比为___________ ;实验室常用热的氢氧化钠溶液洗去试管内壁附着的该淡黄色固体,其原理为___________ (用化学方程式表示)。
(3)检验N盐溶液是否变质的方法是___________ 。
(4)Z的浓溶液与碳单质在一定条件下可以发生化学反应,该反应的化学方程式为___________ 。
(5) 是重要的化工原料。从氧化还原反应的角度分析,下列制备
是重要的化工原料。从氧化还原反应的角度分析,下列制备 的方案理论上可行的是
的方案理论上可行的是___________ (填字母)。
a. b.
b. c.
c.
d. e.
e.
(6)已知 能被
能被 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与 的
的 溶液恰好完全反应时,
溶液恰好完全反应时, 元素在还原产物中的化合价为
元素在还原产物中的化合价为___________ 。

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合可生成淡黄色固体,该反应中还原剂与氧化剂的物质的量之比为
(3)检验N盐溶液是否变质的方法是
(4)Z的浓溶液与碳单质在一定条件下可以发生化学反应,该反应的化学方程式为
(5)
 是重要的化工原料。从氧化还原反应的角度分析,下列制备
是重要的化工原料。从氧化还原反应的角度分析,下列制备 的方案理论上可行的是
的方案理论上可行的是a.
 b.
b. c.
c.
d.
 e.
e.
(6)已知
 能被
能被 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与 的
的 溶液恰好完全反应时,
溶液恰好完全反应时, 元素在还原产物中的化合价为
元素在还原产物中的化合价为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
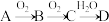
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是___________ ,检验D的稀溶液中主要阴离子的试剂是___________ 。
②在工业生产中,B气体的大量排放被雨水吸收后会形成___________ 而污染环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别为___________ 、___________ 。
②写出 转化的化学方程式
转化的化学方程式___________ 。
③D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式___________ ,该反应中D体现的性质有___________ 。
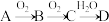
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是
②在工业生产中,B气体的大量排放被雨水吸收后会形成
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别为
②写出
 转化的化学方程式
转化的化学方程式③D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
【推荐1】从冬青中提取出的有机物A可用于合成抗结肠炎药物Y及其他化学品,合成路线如下图:
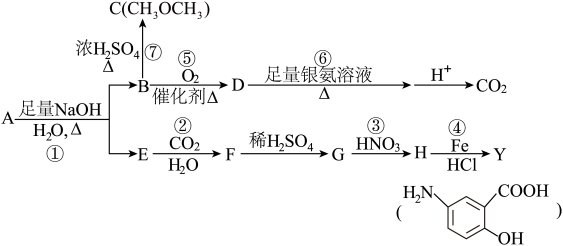
提示:
根据上述信息回答:
(1)请写出Y中含氧官能团的名称:__________________ 。
(2)写出反应③的反应类型:_________________ 。
(3)写出下列反应的化学方程式:
②______________ 。
⑤_______________ 。
(4)A的同分异构体I和J是重要的医学中间体,在浓硫酸的作用下I和J分别生成 和
和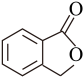 ,鉴别I和J的试剂为
,鉴别I和J的试剂为_________________ 。

提示:

根据上述信息回答:
(1)请写出Y中含氧官能团的名称:
(2)写出反应③的反应类型:
(3)写出下列反应的化学方程式:
②
⑤
(4)A的同分异构体I和J是重要的医学中间体,在浓硫酸的作用下I和J分别生成
 和
和 ,鉴别I和J的试剂为
,鉴别I和J的试剂为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】银-Ferrozine法检验甲醛含量灵敏度较高。测定原理为甲醛把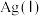 还原成Ag,产生的Ag与
还原成Ag,产生的Ag与 定量反应生成
定量反应生成 ,
, 与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组根据此原理设计如下装置测定新装修居室内空气中甲醛的含量(夹持装置略去)。
与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组根据此原理设计如下装置测定新装修居室内空气中甲醛的含量(夹持装置略去)。
Ⅰ.制备银氨溶液。
(1)向仪器A、B中加入药品,将B中的______ (填“ 溶液”或“氨水”)逐滴加入A中至
溶液”或“氨水”)逐滴加入A中至______ (填实验现象)。
Ⅱ.吸收室内空气中甲醛。
(2)取下玻璃塞→操作①→操作②→使可滑动隔板处于最右端→操作③→操作④→操作⑤→再将操作②至⑤重复4次。操作①、②、③、④、⑤依次为______ 。为保证数据样本的多样性,应______ 。
a.打开 ,关闭
,关闭 b.打开
b.打开 ,关闭
,关闭 c.将可滑动隔板拉至最左端
c.将可滑动隔板拉至最左端
d.加热仪器A e.将可滑动隔板缓慢推至最右端 f.将可滑动隔板迅速推至最右端
(3)装置中使用毛细管而非普通玻璃管的原因是______ ,甲醛与银氨溶液反应的化学方程式为______ 。
Ⅲ.测定甲醛含量。
(4)将仪器A中溶液的pH调至1,加入足量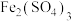 溶液,充分反应后加入菲洛嗪,测定吸光度。经测定生成1.12mg
溶液,充分反应后加入菲洛嗪,测定吸光度。经测定生成1.12mg ,则空气中甲醛的含量为
,则空气中甲醛的含量为______  。
。
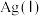 还原成Ag,产生的Ag与
还原成Ag,产生的Ag与 定量反应生成
定量反应生成 ,
, 与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组根据此原理设计如下装置测定新装修居室内空气中甲醛的含量(夹持装置略去)。
与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组根据此原理设计如下装置测定新装修居室内空气中甲醛的含量(夹持装置略去)。
Ⅰ.制备银氨溶液。
(1)向仪器A、B中加入药品,将B中的
 溶液”或“氨水”)逐滴加入A中至
溶液”或“氨水”)逐滴加入A中至Ⅱ.吸收室内空气中甲醛。
(2)取下玻璃塞→操作①→操作②→使可滑动隔板处于最右端→操作③→操作④→操作⑤→再将操作②至⑤重复4次。操作①、②、③、④、⑤依次为
a.打开
 ,关闭
,关闭 b.打开
b.打开 ,关闭
,关闭 c.将可滑动隔板拉至最左端
c.将可滑动隔板拉至最左端d.加热仪器A e.将可滑动隔板缓慢推至最右端 f.将可滑动隔板迅速推至最右端
(3)装置中使用毛细管而非普通玻璃管的原因是
Ⅲ.测定甲醛含量。
(4)将仪器A中溶液的pH调至1,加入足量
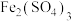 溶液,充分反应后加入菲洛嗪,测定吸光度。经测定生成1.12mg
溶液,充分反应后加入菲洛嗪,测定吸光度。经测定生成1.12mg ,则空气中甲醛的含量为
,则空气中甲醛的含量为 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某小组设计如下装置测定新装修居室内空气中甲醛的含量(夹持装置略)。
已知:①测定原理为甲醛把 还原成
还原成 ,产生的
,产生的 与
与 定量反应生成
定量反应生成 ,
, 与菲洛嗪形成有色配合物,通过测定吸光度计算出甲醛的含量;
与菲洛嗪形成有色配合物,通过测定吸光度计算出甲醛的含量;
②吸光度用A表示,计算公式为 ,其中a为吸光度系数,b为光在样本中经过的距离,c为溶液浓度。
,其中a为吸光度系数,b为光在样本中经过的距离,c为溶液浓度。
(1)仪器A的名称是__________ 。
(2)制备银氨溶液,仪器B中放置的药品是__________ (填“ 溶液”或“氨水”)。
溶液”或“氨水”)。
(3)选择正确的操作,完成室内空气中甲醛含量的测定:__________
操作①:取下玻璃塞→操作②:__________→操作③:__________→操作④:使可滑动隔板处于最右端→操作⑤:__________→操作⑥:__________→操作⑦:__________→再将操作③~⑦重复 4 次 →测定溶液吸光度。
a.打开 ,关闭
,关闭 b.打开
b.打开 ,关闭
,关闭
c.将可滑动隔板拉至最左端 d.热水浴加热仪器A
e.将可滑动隔板缓慢推至最右端 f.将可滑动隔板迅速推至最右端
(4)写出甲醛与银氨溶液反应的化学方程式__________ 。
(5)将仪器A中溶液的 调至1,加入足量
调至1,加入足量 溶液,充分反应后加入菲洛嗪,通过测定吸光度确定生成
溶液,充分反应后加入菲洛嗪,通过测定吸光度确定生成 1.12mg,则空气中甲醛的含量为
1.12mg,则空气中甲醛的含量为__________ mg/L。
(6)下列说法正确的是__________。
已知:①测定原理为甲醛把
 还原成
还原成 ,产生的
,产生的 与
与 定量反应生成
定量反应生成 ,
, 与菲洛嗪形成有色配合物,通过测定吸光度计算出甲醛的含量;
与菲洛嗪形成有色配合物,通过测定吸光度计算出甲醛的含量;②吸光度用A表示,计算公式为
 ,其中a为吸光度系数,b为光在样本中经过的距离,c为溶液浓度。
,其中a为吸光度系数,b为光在样本中经过的距离,c为溶液浓度。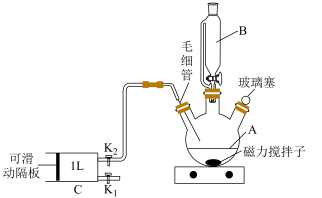
(1)仪器A的名称是
(2)制备银氨溶液,仪器B中放置的药品是
 溶液”或“氨水”)。
溶液”或“氨水”)。(3)选择正确的操作,完成室内空气中甲醛含量的测定:
操作①:取下玻璃塞→操作②:__________→操作③:__________→操作④:使可滑动隔板处于最右端→操作⑤:__________→操作⑥:__________→操作⑦:__________→
a.打开
 ,关闭
,关闭 b.打开
b.打开 ,关闭
,关闭
c.将可滑动隔板拉至最左端 d.热水浴加热仪器A
e.将可滑动隔板缓慢推至最右端 f.将可滑动隔板迅速推至最右端
(4)写出甲醛与银氨溶液反应的化学方程式
(5)将仪器A中溶液的
 调至1,加入足量
调至1,加入足量 溶液,充分反应后加入菲洛嗪,通过测定吸光度确定生成
溶液,充分反应后加入菲洛嗪,通过测定吸光度确定生成 1.12mg,则空气中甲醛的含量为
1.12mg,则空气中甲醛的含量为(6)下列说法正确的是__________。
| A.本实验缺少尾气处理装置 |
| B.实验应在室内不同点位进行空气取样,以保证数据的准确性 |
C.毛细管的作用是减小空气通入速率,保证空气中的 被吸收完全 被吸收完全 |
| D.有色配合物浓度越大,测得吸光度数值越大 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】富马酸亚铁[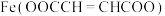 ,
,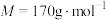 ]是一种治疗贫血的药物。实验制备富马酸亚铁并测定其纯度。
]是一种治疗贫血的药物。实验制备富马酸亚铁并测定其纯度。
Ⅰ.制备富马酸亚铁
步骤1:将4.64g富马酸(HOOCCH=CHCOOH)固体置于100mL烧杯中,加水20mL,在加热搅拌下加入 溶液10mL,使其pH为6.5~6.7,
溶液10mL,使其pH为6.5~6.7,
步骤2:将上述溶液转移至如图所示装置中(省略加热、搅拌和夹持装置),通 并加热一段时间后,缓慢滴加40mL
并加热一段时间后,缓慢滴加40mL 的
的 溶液,维持温度100℃,搅拌充分反应1.5h;
溶液,维持温度100℃,搅拌充分反应1.5h;
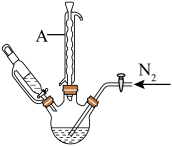
步骤3:将反应混合液冷却后,通过一系列操作,得到粗产品3.06g。
Ⅱ.纯度分析
取mg样品配制成100mL溶液,取25mL置于250mL锥形瓶中,加入煮沸过的 硫酸溶液15.00mL,待样品完全溶解后,加入煮沸过的蒸馏水50.00mL和2滴邻二氮菲指示剂(邻二氮菲遇
硫酸溶液15.00mL,待样品完全溶解后,加入煮沸过的蒸馏水50.00mL和2滴邻二氮菲指示剂(邻二氮菲遇 呈红色,遇
呈红色,遇 呈无色);立即用
呈无色);立即用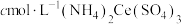 标准溶液滴定至终点(反应的离子方程式为
标准溶液滴定至终点(反应的离子方程式为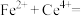
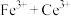 )。平行测定三次,消耗标准溶液的平均体积为VmL。
)。平行测定三次,消耗标准溶液的平均体积为VmL。
(1)仪器A的名称是______ 。
(2)“步骤1”中发生反应的方程式为______ ,pH调节不能过高,其原因是______ 。
(3)“步骤2”中持续通入 的目的是
的目的是______ 。
(4)“步骤3”一系列操作是指减压过滤,______ ,干燥等过程。证明富马酸亚铁产品已洗涤干净的实验操作及现象是______ 。
(5)纯度分析实验中判断达到滴定终点的现象是______ 。
(6)测得产品的纯度为______ 。(用含m、c、V的代数式表示)
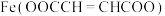 ,
,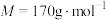 ]是一种治疗贫血的药物。实验制备富马酸亚铁并测定其纯度。
]是一种治疗贫血的药物。实验制备富马酸亚铁并测定其纯度。Ⅰ.制备富马酸亚铁
步骤1:将4.64g富马酸(HOOCCH=CHCOOH)固体置于100mL烧杯中,加水20mL,在加热搅拌下加入
 溶液10mL,使其pH为6.5~6.7,
溶液10mL,使其pH为6.5~6.7,步骤2:将上述溶液转移至如图所示装置中(省略加热、搅拌和夹持装置),通
 并加热一段时间后,缓慢滴加40mL
并加热一段时间后,缓慢滴加40mL 的
的 溶液,维持温度100℃,搅拌充分反应1.5h;
溶液,维持温度100℃,搅拌充分反应1.5h;
步骤3:将反应混合液冷却后,通过一系列操作,得到粗产品3.06g。
Ⅱ.纯度分析
取mg样品配制成100mL溶液,取25mL置于250mL锥形瓶中,加入煮沸过的
 硫酸溶液15.00mL,待样品完全溶解后,加入煮沸过的蒸馏水50.00mL和2滴邻二氮菲指示剂(邻二氮菲遇
硫酸溶液15.00mL,待样品完全溶解后,加入煮沸过的蒸馏水50.00mL和2滴邻二氮菲指示剂(邻二氮菲遇 呈红色,遇
呈红色,遇 呈无色);立即用
呈无色);立即用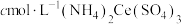 标准溶液滴定至终点(反应的离子方程式为
标准溶液滴定至终点(反应的离子方程式为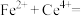
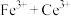 )。平行测定三次,消耗标准溶液的平均体积为VmL。
)。平行测定三次,消耗标准溶液的平均体积为VmL。(1)仪器A的名称是
(2)“步骤1”中发生反应的方程式为
(3)“步骤2”中持续通入
 的目的是
的目的是(4)“步骤3”一系列操作是指减压过滤,
(5)纯度分析实验中判断达到滴定终点的现象是
(6)测得产品的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】亚氯酸钠(NaClO2)是一种高效漂白剂,工业设计生产NaClO2的主要流程如下:
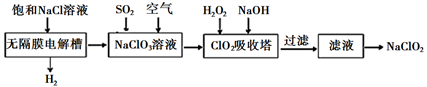
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用,ClO2气体在中性和碱性溶液中不能稳定存在。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。
(1)写出无隔膜电解槽中阳极的电极反应方程式:____________________________ 。
(2)生成ClO2的反应中需用酸进行酸化,你认为最宜选用的酸为______________ (写酸的名称)。
(3)ClO2吸收塔中发生反应的离子方程式为______________ ,H2O2的电子式为______________ 。
(4)请补充从滤液获得NaClO2的操作步骤:①减压,55℃蒸发结晶;②__________________ ;③__________________ ;④__________________ ,得到成品。
(5)NaClO2溶液浓度含量可用碘量法测定,其原理为在稀硫酸介质中,NaClO2能定量地将碘离子氧化成碘,以淀粉为指示剂,用0.1000 mol·L−1的硫代硫酸钠标准溶液滴定碘而确定NaClO2。
已知:2I2 + 2Na2S2O3 2NaI + Na2S4O6。取NaClO2溶液体积V1 mL加入到适量的稀硫酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V2 mL Na2S2O3溶液,则NaClO2的浓度为
2NaI + Na2S4O6。取NaClO2溶液体积V1 mL加入到适量的稀硫酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V2 mL Na2S2O3溶液,则NaClO2的浓度为_____________ g·L−1(杂质不参与反应,NaClO2中的氯元素被还原为Cl−)。

已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用,ClO2气体在中性和碱性溶液中不能稳定存在。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。
(1)写出无隔膜电解槽中阳极的电极反应方程式:
(2)生成ClO2的反应中需用酸进行酸化,你认为最宜选用的酸为
(3)ClO2吸收塔中发生反应的离子方程式为
(4)请补充从滤液获得NaClO2的操作步骤:①减压,55℃蒸发结晶;②
(5)NaClO2溶液浓度含量可用碘量法测定,其原理为在稀硫酸介质中,NaClO2能定量地将碘离子氧化成碘,以淀粉为指示剂,用0.1000 mol·L−1的硫代硫酸钠标准溶液滴定碘而确定NaClO2。
已知:2I2 + 2Na2S2O3
 2NaI + Na2S4O6。取NaClO2溶液体积V1 mL加入到适量的稀硫酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V2 mL Na2S2O3溶液,则NaClO2的浓度为
2NaI + Na2S4O6。取NaClO2溶液体积V1 mL加入到适量的稀硫酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V2 mL Na2S2O3溶液,则NaClO2的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】现有一定量含有 杂质的
杂质的 试样,用如图所示实验装置测定
试样,用如图所示实验装置测定 试样的纯度。(可供选用的反应物只有
试样的纯度。(可供选用的反应物只有 固体、稀盐酸、稀硫酸和蒸馏水)
固体、稀盐酸、稀硫酸和蒸馏水)
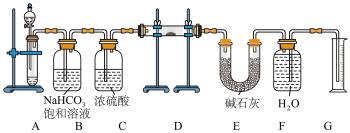
回答下列问题:
(1)组装好实验装置后,首先进行的操作是___________ 。
(2)装置A中液体试剂应该选用___________ 。
(3)装置B的作用是___________ ,装置E中碱石灰的作用是___________ 。
(4)装置D中 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(5)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则 试样的纯度为
试样的纯度为___________ 。若读取气体体积时,没有冷却至室温,则测得 的纯度会
的纯度会___________ (填“偏大”、“偏小”或“无影响”)。
 杂质的
杂质的 试样,用如图所示实验装置测定
试样,用如图所示实验装置测定 试样的纯度。(可供选用的反应物只有
试样的纯度。(可供选用的反应物只有 固体、稀盐酸、稀硫酸和蒸馏水)
固体、稀盐酸、稀硫酸和蒸馏水)
回答下列问题:
(1)组装好实验装置后,首先进行的操作是
(2)装置A中液体试剂应该选用
(3)装置B的作用是
(4)装置D中
 发生反应的化学方程式为
发生反应的化学方程式为(5)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则
 试样的纯度为
试样的纯度为 的纯度会
的纯度会
您最近一年使用:0次



