回答下列问题。
I.某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并用电导率传感器测得混合溶液的导电能力(电导率)随时间变化的曲线如图所示。
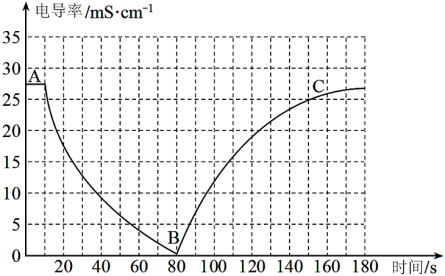
(1)Ba(OH)2在水中以离子形式存在的实验证据是___________ ;
(2)AB段发生的反应的离子方程式是___________ ;
(3)BC段电导率逐渐上升的原因是___________ ;
(4)如果将稀硫酸改为等浓度的稀盐酸,猜想此时电导率的最低点在B点的___________(填选项)
(5)该兴趣小组通过查阅资料了解到Ba2+是重金属离子,可溶性钡盐对人体有毒。医疗上常用硫酸钡作胃肠道检查的造影剂,俗称“钡餐”,而不溶性的碳酸钡却不能做钡餐。请用离子方程式解释原因___________ 。
II.回顾氧化还原反应知识内容,回答下列问题:
(6)配平反应:___________S+___________KOH = ___________K2SO3+___________K2S+___________H2O___________ ,被氧化与被还原的硫原子数目之比是___________ 。
(7)配平反应:___________KMnO4+___________HCl(浓)=___________KCl+___________MnCl2+___________Cl2↑+___________H2O___________ ,氧化剂与还原剂个数之比为___________ ,浓盐酸表现出的性质是___________ 。
(8)配平反应:___________KMnO4 +___________FeSO4 +___________H2SO4 =___________K2SO4 +___________MnSO4 +___________Fe2(SO4)3 +___________H2O___________
(9)配平反应:___________Fe(OH)3+___________NaOH+___________Cl2=___________Na2FeO4+___________NaCl+___________H2O___________
I.某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并用电导率传感器测得混合溶液的导电能力(电导率)随时间变化的曲线如图所示。

(1)Ba(OH)2在水中以离子形式存在的实验证据是
(2)AB段发生的反应的离子方程式是
(3)BC段电导率逐渐上升的原因是
(4)如果将稀硫酸改为等浓度的稀盐酸,猜想此时电导率的最低点在B点的___________(填选项)
| A.上方 | B.下方 | C.重合 | D.无法确定 |
(5)该兴趣小组通过查阅资料了解到Ba2+是重金属离子,可溶性钡盐对人体有毒。医疗上常用硫酸钡作胃肠道检查的造影剂,俗称“钡餐”,而不溶性的碳酸钡却不能做钡餐。请用离子方程式解释原因
II.回顾氧化还原反应知识内容,回答下列问题:
(6)配平反应:___________S+___________KOH = ___________K2SO3+___________K2S+___________H2O
(7)配平反应:___________KMnO4+___________HCl(浓)=___________KCl+___________MnCl2+___________Cl2↑+___________H2O
(8)配平反应:___________KMnO4 +___________FeSO4 +___________H2SO4 =___________K2SO4 +___________MnSO4 +___________Fe2(SO4)3 +___________H2O
(9)配平反应:___________Fe(OH)3+___________NaOH+___________Cl2=___________Na2FeO4+___________NaCl+___________H2O
更新时间:2023-09-29 09:39:17
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人野兽”(即能与盐酸反应的物质或者水溶液),盐酸必须避开它们,否则就无法通过。
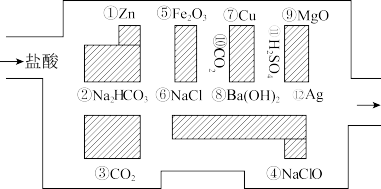
请回答下列问题:
(1)请你帮助它走出迷宫(用图中物质的序号按先后顺序连接起来表示所走的路线)___________ 。
(2) 俗称
俗称___________ ,其水溶液显___________ 性(填“酸”“碱”或“中”);除去碳酸钠固体中碳酸氢钠的反应的化学方程式为___________ 。
(3)化学工业为疫情防控提供了强有力的物质支撑,“84消毒液”是一种以次氯酸钠为主要成分的含氯消毒剂,主要用于物体表面和环境等的消毒,可有效灭活新冠病毒,这是利用了 的强
的强___________ 性(填“氧化”或“还原”);洁厕灵(主要成分是盐酸)和84消毒液不能混用,否则产生有毒氯气,其离子方程式为___________ 。
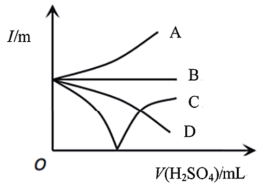
(4)向 溶液中缓缓加入
溶液中缓缓加入 直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用下图中的
直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用下图中的___________ (填字母)曲线表示。

请回答下列问题:
(1)请你帮助它走出迷宫(用图中物质的序号按先后顺序连接起来表示所走的路线)
(2)
 俗称
俗称(3)化学工业为疫情防控提供了强有力的物质支撑,“84消毒液”是一种以次氯酸钠为主要成分的含氯消毒剂,主要用于物体表面和环境等的消毒,可有效灭活新冠病毒,这是利用了
 的强
的强(4)向
 溶液中缓缓加入
溶液中缓缓加入 直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用下图中的
直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用下图中的
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)如图所示是在一定温度下向不同电解质溶液中加入新物质时其电流强度(I)随新物质加入量(m)的变化曲线。以下a、b、c三个导电性实验,其中与A图变化趋势一致的是_________________ ,与B图变化趋势一致的是______________ ,与 C图变化趋势一致的是_________________ 。
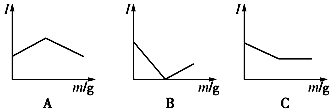
a.向Ba(OH)2溶液中逐滴加入等浓度的H2SO4溶液至过量
b.向醋酸溶液中逐滴加入等浓度的氨水至过量
c.向盐酸中逐滴加入等浓度的NaOH溶液至过量
(2)写出第(1)中,选项b所描述的离子反应方程式____________________ 。
(3)写出制备氢氧化铁胶体的化学反应方程式:_______________________ 。
在氢氧化铁胶体中加入足量的盐酸,能观察到的现象是:____________________ 。

a.向Ba(OH)2溶液中逐滴加入等浓度的H2SO4溶液至过量
b.向醋酸溶液中逐滴加入等浓度的氨水至过量
c.向盐酸中逐滴加入等浓度的NaOH溶液至过量
(2)写出第(1)中,选项b所描述的离子反应方程式
(3)写出制备氢氧化铁胶体的化学反应方程式:
在氢氧化铁胶体中加入足量的盐酸,能观察到的现象是:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】室温下,依次进行如下实验:
①取一定量冰醋酸,配制成100mL0.1mol/L醋酸溶液
②取20mL①中所配溶液,加入20mL0.1mol/LNaOH溶液;
③继续滴加a mL0.1mol/L稀盐酸,至溶液的pH=7;
④再取10mL①中所配溶液,加入20mL0.1mol/LNaOH溶液;
⑤向①中剩余醋酸溶液中逐滴加入0.1mol/L氨水至过量,用电导率传感器实时测量该过程中溶液的电导率(溶液导电性越强,电导率越大)。
(1)用化学用语解释醋酸溶液pH<7的原因:_______ ,另外配制100mL与①中醋酸溶液等pH的盐酸,分别取10mL上述两种溶液,各加入10mL蒸馏水,稀释后醋酸溶液的pH_______ 盐酸(>、=或<)。
(2)②中反应后的溶液中离子浓度由大到小 的顺序为_______ (用离子符号表示即可)。
(3)a___ 20mL(>、=或<,下同);③中反应后的溶液:
____  。
。
(4)④中反应后的溶液中各微粒浓度存在如下关系: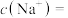
_____ 
____ 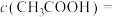
_____ mol/L。
(5)请你预测⑤中滴入氨水过程中电导率的变化情况:_______ 。
①取一定量冰醋酸,配制成100mL0.1mol/L醋酸溶液
②取20mL①中所配溶液,加入20mL0.1mol/LNaOH溶液;
③继续滴加a mL0.1mol/L稀盐酸,至溶液的pH=7;
④再取10mL①中所配溶液,加入20mL0.1mol/LNaOH溶液;
⑤向①中剩余醋酸溶液中逐滴加入0.1mol/L氨水至过量,用电导率传感器实时测量该过程中溶液的电导率(溶液导电性越强,电导率越大)。
(1)用化学用语解释醋酸溶液pH<7的原因:
(2)②中反应后的溶液中离子浓度由
(3)a

 。
。(4)④中反应后的溶液中各微粒浓度存在如下关系:
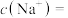

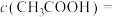
(5)请你预测⑤中滴入氨水过程中电导率的变化情况:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】Ⅰ.现有下列10种物质:①铝,②纯醋酸,③ ,④
,④ ,⑤NaOH,⑥硫酸铜溶液,⑦熔融的NaCl,⑧
,⑤NaOH,⑥硫酸铜溶液,⑦熔融的NaCl,⑧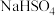 ,⑨硝酸钾晶体,⑩乙醇。
,⑨硝酸钾晶体,⑩乙醇。
(1)上述物质中属于非电解质的有_______ (填序号);①②⑥⑦⑨⑩这六种物质中能导电的有_______ (填序号)。
(2)向⑥中加入⑤的离子方程式是_______ 。
(3)⑧在水中的电离方程式为_______ 。
(4)上述物质中有两种物质在水溶液中发生的反应可用离子反应 表示,请写出该离子反应对应的其中一个化学方程式
表示,请写出该离子反应对应的其中一个化学方程式_______ 。
(5)用双线桥表示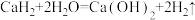 反应电子转移情况:
反应电子转移情况:_______ 。
Ⅱ.利用物质的量的相关知识进行填空:
(6)有一类物质的结构似“鸟巢”,如化学式为 的五硼烷(见下图)。含有
的五硼烷(见下图)。含有 个原子的五硼烷的质量为
个原子的五硼烷的质量为_______ 。
(7)在同温同压下,NO和 两种气体,密度比为
两种气体,密度比为_______ ,若两者质量相等,其体积比为_______ 。
(8)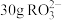 中,核外电子总数比质子总数多
中,核外电子总数比质子总数多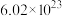 ,则R的摩尔质量为
,则R的摩尔质量为_______ 。
 ,④
,④ ,⑤NaOH,⑥硫酸铜溶液,⑦熔融的NaCl,⑧
,⑤NaOH,⑥硫酸铜溶液,⑦熔融的NaCl,⑧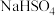 ,⑨硝酸钾晶体,⑩乙醇。
,⑨硝酸钾晶体,⑩乙醇。(1)上述物质中属于非电解质的有
(2)向⑥中加入⑤的离子方程式是
(3)⑧在水中的电离方程式为
(4)上述物质中有两种物质在水溶液中发生的反应可用离子反应
 表示,请写出该离子反应对应的其中一个化学方程式
表示,请写出该离子反应对应的其中一个化学方程式(5)用双线桥表示
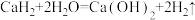 反应电子转移情况:
反应电子转移情况:Ⅱ.利用物质的量的相关知识进行填空:
(6)有一类物质的结构似“鸟巢”,如化学式为
 的五硼烷(见下图)。含有
的五硼烷(见下图)。含有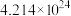 个原子的五硼烷的质量为
个原子的五硼烷的质量为
(7)在同温同压下,NO和
 两种气体,密度比为
两种气体,密度比为(8)
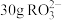 中,核外电子总数比质子总数多
中,核外电子总数比质子总数多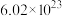 ,则R的摩尔质量为
,则R的摩尔质量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】将地球储量丰富的小分子电催化转化为有高附加值的 、
、 、
、 及
及 (如图所示)等具有巨大的经济效益和环境效益。回答下列问题:
(如图所示)等具有巨大的经济效益和环境效益。回答下列问题:
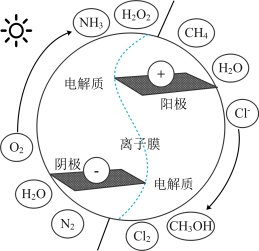
(1) 是一种绿色氧化剂,它的电子式为
是一种绿色氧化剂,它的电子式为___________ ;目前工业上采用蒽醌法生产 的原理为:
的原理为:
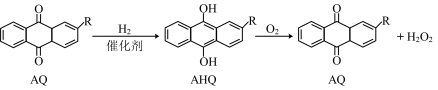 。
。
该总反应的原子利用率为___________ %;测定 的纯度可用酸性高锰酸钾溶液滴定法,该反应的离子方程式为
的纯度可用酸性高锰酸钾溶液滴定法,该反应的离子方程式为___________ 。
(2) 还原
还原 制取X(方程式中部分物质的化学计量数已略)可表示为
制取X(方程式中部分物质的化学计量数已略)可表示为
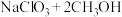


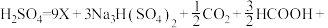

 ,则X为
,则X为___________ (填化学式)。
(3)电催化制取有高附加值物质的方法有很多。
①下列说法错误的是___________ (填标号)。
A. 及
及 电催化制
电催化制 时,
时, 在阴极区生成
在阴极区生成
B. 及
及 电催化制
电催化制 时,
时, 在阳极区生成
在阳极区生成
C.隔膜电解槽电解饱和食盐水制 时,用阴离子交换膜
时,用阴离子交换膜
②一种合成氨的装置如图所示,阴极的电极反应式为___________ ,电解总反应为___________ 。
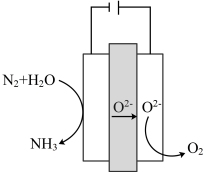
 、
、 、
、 及
及 (如图所示)等具有巨大的经济效益和环境效益。回答下列问题:
(如图所示)等具有巨大的经济效益和环境效益。回答下列问题:
(1)
 是一种绿色氧化剂,它的电子式为
是一种绿色氧化剂,它的电子式为 的原理为:
的原理为: 。
。该总反应的原子利用率为
 的纯度可用酸性高锰酸钾溶液滴定法,该反应的离子方程式为
的纯度可用酸性高锰酸钾溶液滴定法,该反应的离子方程式为(2)
 还原
还原 制取X(方程式中部分物质的化学计量数已略)可表示为
制取X(方程式中部分物质的化学计量数已略)可表示为
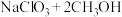


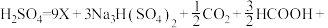

 ,则X为
,则X为(3)电催化制取有高附加值物质的方法有很多。
①下列说法错误的是
A.
 及
及 电催化制
电催化制 时,
时, 在阴极区生成
在阴极区生成B.
 及
及 电催化制
电催化制 时,
时, 在阳极区生成
在阳极区生成C.隔膜电解槽电解饱和食盐水制
 时,用阴离子交换膜
时,用阴离子交换膜②一种合成氨的装置如图所示,阴极的电极反应式为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式: NO3-+4H++3e- →NO↑+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:________________________________ 。
(2)反应中氧化剂和还原剂的物质的量之比是___________ 。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是_________ mol。
(4)若该反应生成一种化合价更高的还原产物,其他物质保持不变,则反应物中氧化剂与还原剂的物质的量之比将_______ (填增大、减小、不变或者不能确定)。
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中氧化剂和还原剂的物质的量之比是
(3)反应中若产生0.2mol气体,则转移电子的物质的量是
(4)若该反应生成一种化合价更高的还原产物,其他物质保持不变,则反应物中氧化剂与还原剂的物质的量之比将
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与NO在加热和催化剂作用下生成N2O的化学方程式为___________ 。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为:
NO+NO2+2OH-=2 +H2O
+H2O
2NO2+2OH-= +
+ +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有___________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是___________ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 ,其离子方程式为
,其离子方程式为___________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___________ 。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与NO在加热和催化剂作用下生成N2O的化学方程式为
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为:
NO+NO2+2OH-=2
 +H2O
+H2O2NO2+2OH-=
 +
+ +H2O
+H2O①下列措施能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。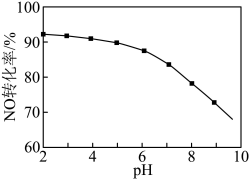
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
您最近一年使用:0次
【推荐3】请完成下列问题:
(1)下列物质中属于氧化物的是_______ (填序号,下同);属于电解质的是_______ 。
①Al ②O2 ③H2SO4 ④KOH ⑤H2O ⑥乙醇
(2)请写出硫酸氢钠在水溶液中的电离方程式:_______ 。
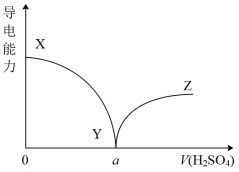
(3)向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,测得混合溶液的导电能力随加入稀硫酸溶液体积变化的曲线如图所示,下列说法不正确的是_______
(4)氯元素的价类图如图所示,其中a- f 表示对应的含氯元素的物质。
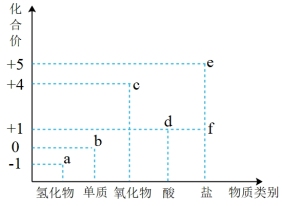
①请写出a的浓溶液和二氧化锰反应制取b的化学方程式:_______ 。
②曾有报道,因混合使用洁厕灵(主要成分是a的水溶液)与84消毒液(主要成分f是钠盐)而发生Cl2中毒事件,请用离子方程式说明两者不能混合使用的原因:_______ 。
③下列说法正确的是_______ 。
A.相同温度相同浓度的a溶液比d溶液酸性弱
B.b、c均可用于自来水的杀菌消毒
C. f露置于空气中一段时间后可能会转化为d
D. a的浓溶液与e反应生成3mol b时,转移电子的物质的量为6mol
(1)下列物质中属于氧化物的是
①Al ②O2 ③H2SO4 ④KOH ⑤H2O ⑥乙醇
(2)请写出硫酸氢钠在水溶液中的电离方程式:
(3)向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,测得混合溶液的导电能力随加入稀硫酸溶液体积变化的曲线如图所示,下列说法不正确的是_______

| A.XY段导电能力不断减弱,说明生成的BaSO4不是电解质 |
| B.当加入硫酸的体积为a时,溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子 |
| C.当加入硫酸的体积为a时,H2SO4和Ba(OH)2恰好完全中和 |
| D.YZ段溶液的导电能力不断增大,主要是由于过量的硫酸电离,使溶液中的离子浓度增大 |

①请写出a的浓溶液和二氧化锰反应制取b的化学方程式:
②曾有报道,因混合使用洁厕灵(主要成分是a的水溶液)与84消毒液(主要成分f是钠盐)而发生Cl2中毒事件,请用离子方程式说明两者不能混合使用的原因:
③下列说法正确的是
A.相同温度相同浓度的a溶液比d溶液酸性弱
B.b、c均可用于自来水的杀菌消毒
C. f露置于空气中一段时间后可能会转化为d
D. a的浓溶液与e反应生成3mol b时,转移电子的物质的量为6mol
您最近一年使用:0次

 =BaSO4↓”来表示,请按下列要求写出有关反应的化学方程式:
=BaSO4↓”来表示,请按下列要求写出有关反应的化学方程式:

